1.6: Структури Льюїса та офіційні звинувачення (огляд)
- Page ID
- 22791
Мета навчання
Малюйте, інтерпретуйте та перетворюйте між структурами Льюїса (Kekule), конденсованих та ліній зв'язку
Примітка: Огляд загальної хімії в розділах 1.3 - 1.6 інтегрований у вищезазначену ціль навчання з органічної хімії в розділах 1.7 та 1.8.
Льюїс Структури
Структури Льюїса, також відомі як діаграми точки Льюїса, показують зв'язок між атомами молекули та самотніми парами електронів у молекулі. Хоча спочатку може бути корисно писати окремі спільні електрони, цей підхід швидко стає незручним.
Одна лінія використовується для представлення однієї пари спільних електронів. Лінійні зображення використовуються лише для спільних електронів. Самотня пара (нерозділених) електрони все ще показані як окремі електрони. Подвійні та потрійні зв'язки також можуть бути пов'язані з лініями, як показано нижче.
2 спільних електрони утворюють єдиний зв'язок, показаний як «:» або «—»
4 спільних електрони утворюють подвійний зв'язок, показаний як ':' або '='
6 спільних електронів утворюються при потрійному зв'язку, показаному як ': ::' або
Нерозділені електрони також називаються «Самотніми парами» і відображаються як «:»
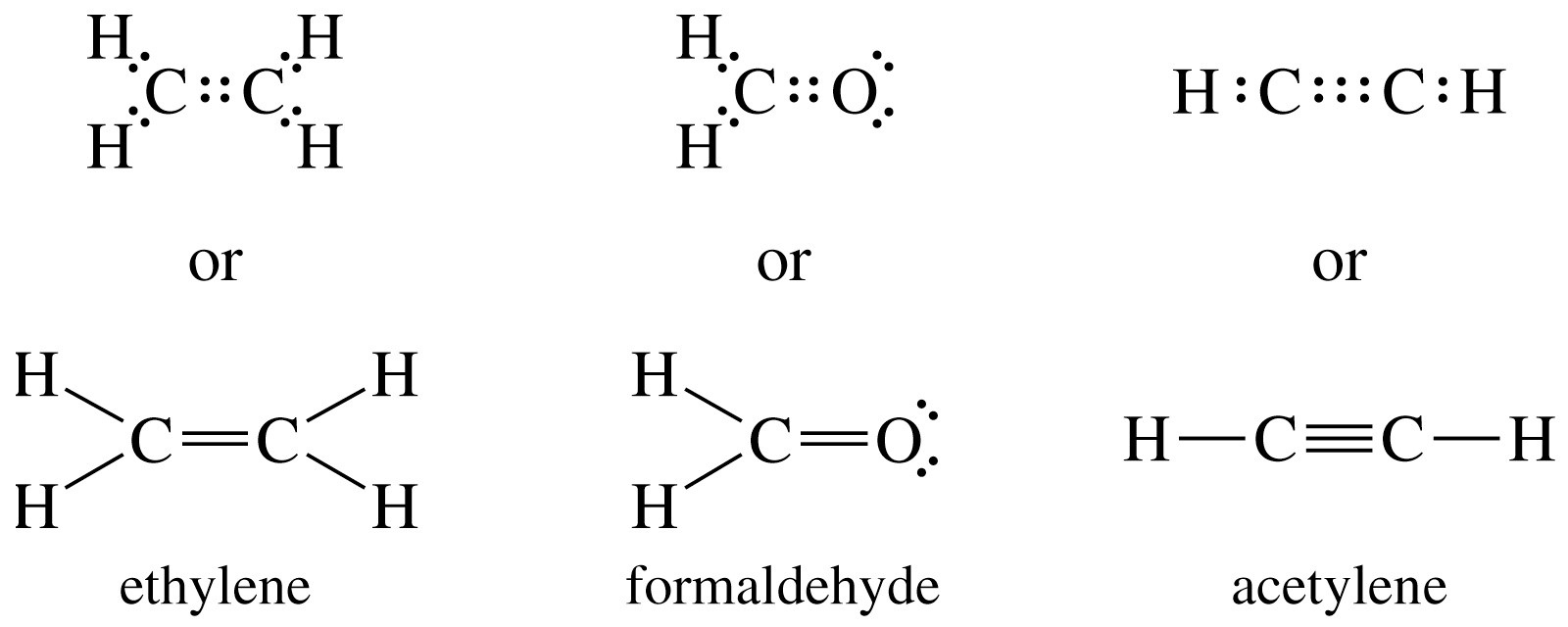
Малювання самотніх пар
Оскільки електрони одинокої пари часто НЕ відображаються в хімічних структурах, важливо подумки додати самотні пари. На початку може бути корисно фізично додати самотні пари електронів.
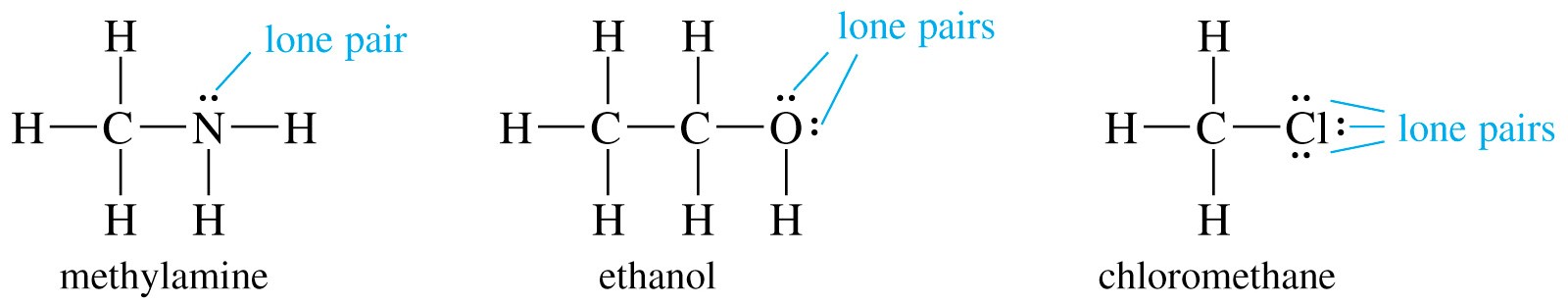
Шаблони склеювання
Для органічної хімії загальні схеми зв'язку вуглецю, кисню та азоту мають корисне застосування при оцінці хімічних структур та реакційної здатності.
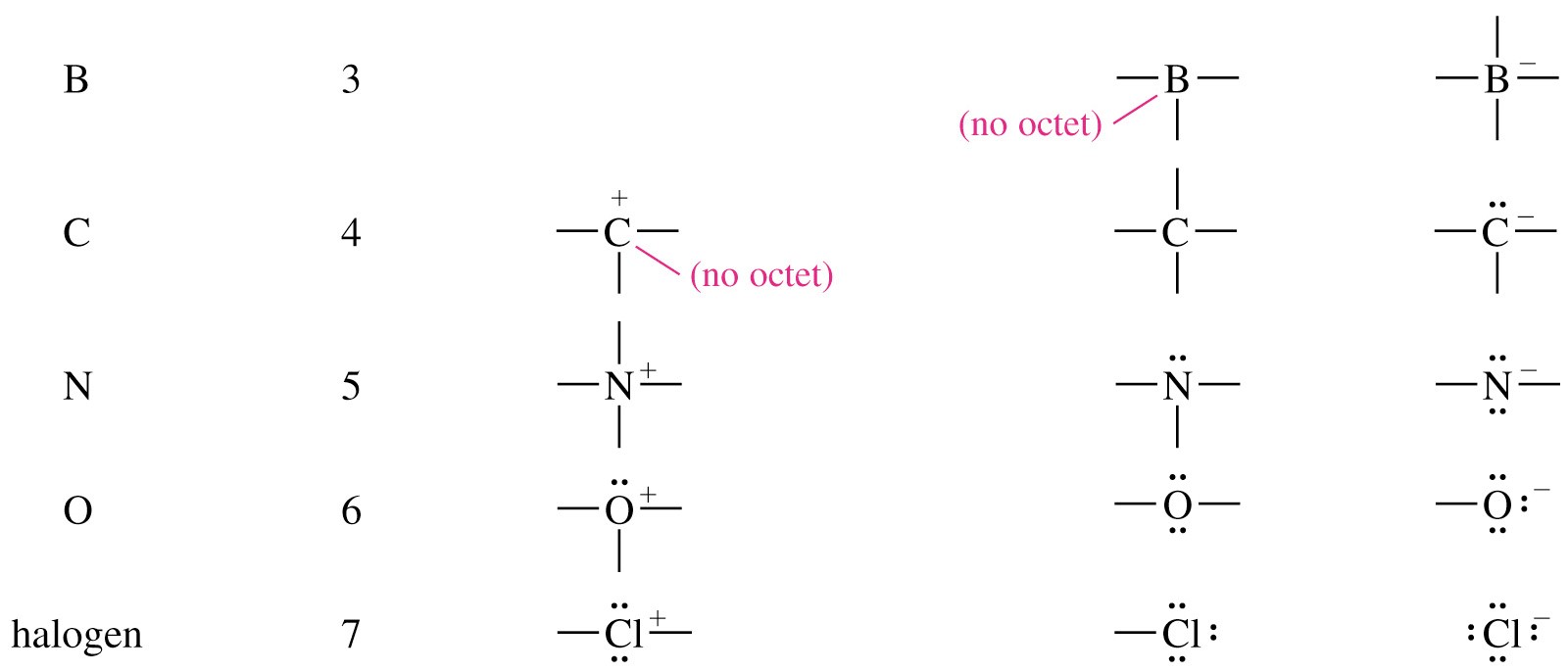
Офіційні збори
Органічні молекули також можуть мати позитивні або негативні заряди, пов'язані з ними. Під час хімічних реакцій зазвичай є реагент заряду, проміжні продукти та/або продукти. Розпізнавання та розрізнення нейтральних та заряджених моделей зв'язку буде корисним у вивченні механізмів реакції. Розглянемо структуру Льюїса метанолу, CH 3 OH (метанол - це так званий «деревний спирт», який недобросовісні бутлеггери іноді продавали під час заборони днів у 1920-х, часто викликаючи людей, які пили його, осліпнуть). Сам метанол є нейтральною молекулою, але може втратити протон, щоб стати молекулярним аніоном (CH 3 O -), або отримати протон, щоб стати молекулярним катіоном (CH 3 OH 2 +).

Молекулярний аніон і катіон мають загальні заряди -1 і +1 відповідно. Але ми можемо бути більш конкретними, ніж це - ми також можемо констатувати для кожного молекулярного іона, що формальний заряд розташований саме на атомі кисню, а не на вуглеці або будь-якому з атомів водню.
З'ясування формального заряду на різних атомах молекули є простим процесом - це просто питання складання валентних електронів.
Незв'язаний атом кисню має 6 валентних електронів. Однак, коли він пов'язаний як частина молекули метанолу, атом кисню оточений 8 валентними електронами: 4 незв'язними електронами (дві «одинокі пари») та 2 електрони в кожній з двох його ковалентних зв'язків (один до вуглецю, один до водню). У офіційній конвенції про заряди ми говоримо, що кисень «володіє» усіма 4 незв'язними електронами. Однак він «володіє» лише одним електроном від кожної з двох ковалентних зв'язків, оскільки ковалентні зв'язки передбачають спільне використання електронів між атомами. Тому атом кисню в метанолі володіє 2 + 2 + (½ х 4) = 6 валентних електронів.
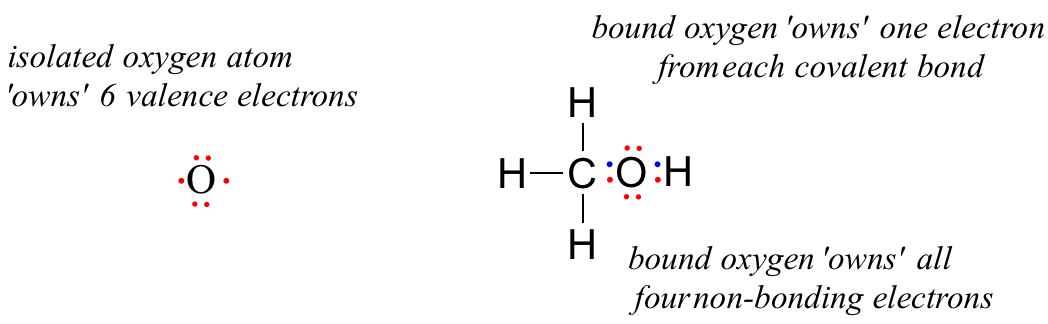
Формальний заряд на атомі обчислюється як кількість валентних електронів, що належать ізольованому атому, мінус кількість валентних електронів, що належать зв'язаному атому в молекулі: