1.7: Загальні шаблони склеювання для органічної хімії
- Page ID
- 22792
Мета навчання
Малюйте, інтерпретуйте та перетворюйте між структурами Льюїса (Kekule), конденсованих та ліній зв'язку
Примітка: Огляд загальної хімії в розділах 1.3 - 1.6 інтегрований у вищезазначену ціль навчання з органічної хімії в розділах 1.7 та 1.8.
Загальні схеми склеювання в органічних структурах
Структура Льюїса нижче (одного з чотирьох нуклеозидних будівельних блоків, що входять до складу ДНК) може здатися складною і заплутаною на перший погляд. На щастя, зустрічаються поширені шаблони склеювання, які можуть дозволити спрощення при малюванні конструкцій. Правила для спрощених конструкцій покладаються на нейтральні схеми склеювання вуглецю, оксиду, азоту, фосфору та сірки в першу чергу. Оскільки органічні сполуки мають вуглеводневу основу, атоми, які НЕ є вуглецем і воднем, називаються гетероатомами. 2'-дезоксицітидин містить сім гетероатомів: чотири атоми кисню приземляють три атоми азоту. Гетероатоми є основним джерелом хімічної реакційної здатності для органічної хімії.
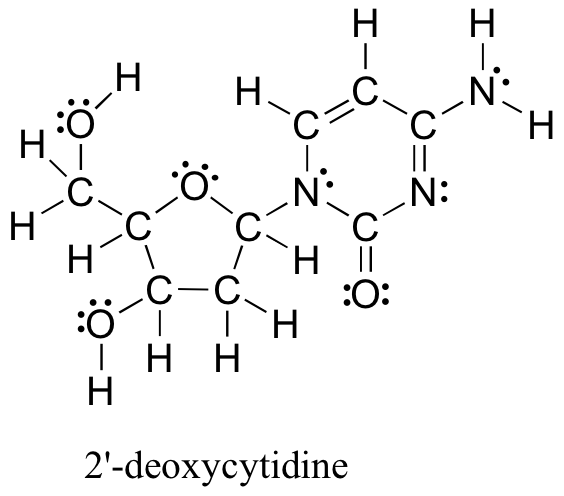
Гетероатоми: атоми в органічній сполуці, які НЕ є вуглецем або воднем,
зазвичай кисень, азот, фосфор та сірка
Здатність швидко і ефективно малювати великі структури та визначати формальні звинувачення не страшно важко прийти - все, що потрібно, це кілька ярликів і деяка практика розпізнавання загальних моделей склеювання.
Почнемо з вуглецю, найважливішого елемента для хіміків-органіків. Вуглець, як кажуть, чотиривалентний, це означає, що він має тенденцію утворювати чотири зв'язки. Якщо подивитися на прості структури метану, метанолу, етану, етану та етину на малюнках з попереднього розділу, то слід швидко визнати, що в кожній молекулі атом вуглецю має чотири зв'язку, а формальний заряд дорівнює нулю.
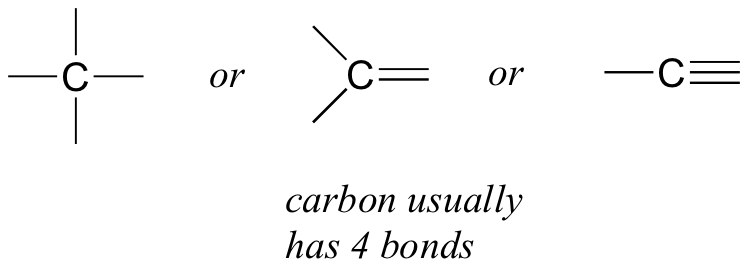
Це закономірність, яка тримається у більшості органічних молекул, які ми побачимо, але є й винятки.
<style type="text/css"></style>У вуглекислому газу атом вуглецю має подвійні зв'язки з киснем з обох сторін (O = C = O). Пізніше в цьому розділі та по всій цій книзі ми побачимо приклади органічних іонів, які називаються «карбокатіони» та карбоніони «, в яких атом вуглецю несе позитивний або негативний формальний заряд відповідно. Якщо вуглець має всього три зв'язку і незаповнену валентну оболонку (іншими словами, якщо він не виконує правило октета), він матиме позитивний формальний заряд.
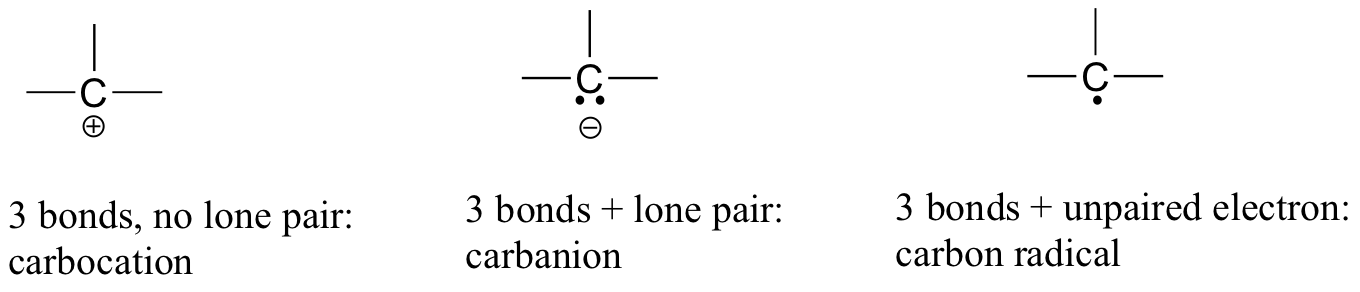
Якщо, з іншого боку, він має три зв'язку плюс одиноку пару електронів, він матиме формальний заряд -1. Інша можливість - вуглець з трьома зв'язками і єдиним, непарним (вільнорадикальним) електроном: в цьому випадку вуглець має формальний заряд нуля. (Остання можливість - це високореактивні форми, які називаються «карбене», в яких вуглець має дві зв'язки та одну одиноку пару електронів, що дає йому формальний заряд нуля. Ви можете зіткнутися з карбенами на більш просунутих курсах хімії, але вони не будуть обговорюватися далі в цій книзі).
Ви, безумовно, повинні використовувати методи, які ви навчилися, щоб перевірити, чи є ці формальні звинувачення правильними для прикладів, наведених вище. Що ще важливіше, вам потрібно буде, перш ніж ви прогресуєте набагато далі у вивченні органічної хімії, просто розпізнати ці закономірності (і шаблони, описані нижче для інших атомів) і мати можливість ідентифікувати вуглеці, які несуть позитивні та негативні формальні заряди шляхом швидкого огляду.
Схема для воднів проста: атоми водню мають тільки один зв'язок, і формального заряду немає. Винятком з цього правила є протон, Н +, і іон гідриду, Н -, який представляє собою протон плюс два електрони. Оскільки ми зосереджуємось у цій книзі на органічній хімії, застосованій до живих істот, ми не побачимо «оголених» протонів та гідридів як таких, оскільки вони занадто реактивні, щоб бути присутніми у такому вигляді у водному розчині. Тим не менш, ідея протона буде дуже важливою, коли ми обговорюємо кислотно-лужну хімію, і ідея гідридного іона стане дуже важливою набагато пізніше в книзі, коли ми обговорюємо реакції органічного окислення та відновлення. Однак, як правило, всі атоми водню в органічних молекулах мають один зв'язок, а формального заряду немає.
Далі звернемося до атомів кисню. Як правило, ви побачите зв'язок кисню трьома способами, всі з яких виконують правило октету.
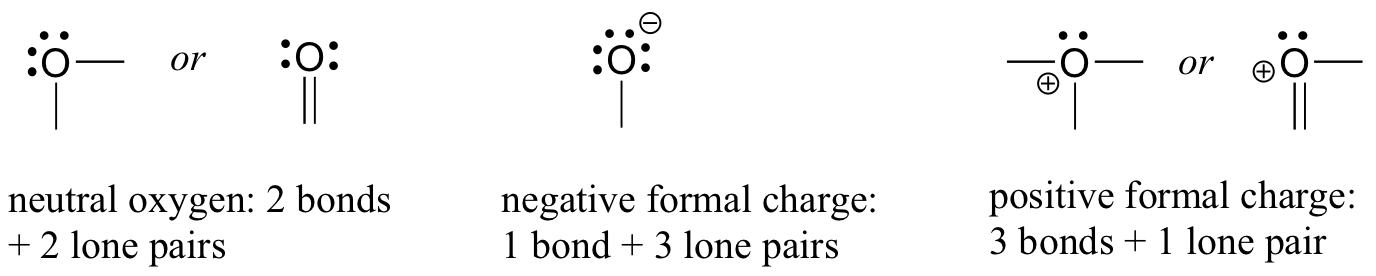
Якщо він має дві зв'язки і дві одинокі пари, як у воді, він матиме формальний заряд в нуль. Якщо він має одну зв'язок і три одинокі пари, як у гідроксид-іона, він матиме формальний заряд -1. Якщо він має три зв'язки і одну одиночну пару, як у іона гідронію, він матиме формальний заряд +1.
Коли ми перейдемо до обговорення хімії вільних радикалів у главі 17, ми побачимо інші можливості, наприклад, коли атом кисню має один зв'язок, одну одиноку пару та один непарний (вільний радикальний) електрон, даючи йому формальний заряд нуль. Наразі, однак, зосередьтеся на трьох основних нерадикальних прикладах, оскільки вони будуть враховувати практично все, що ми бачимо до глави 17.
Азот має дві основні схеми склеювання, обидва з яких відповідають правилу октету:
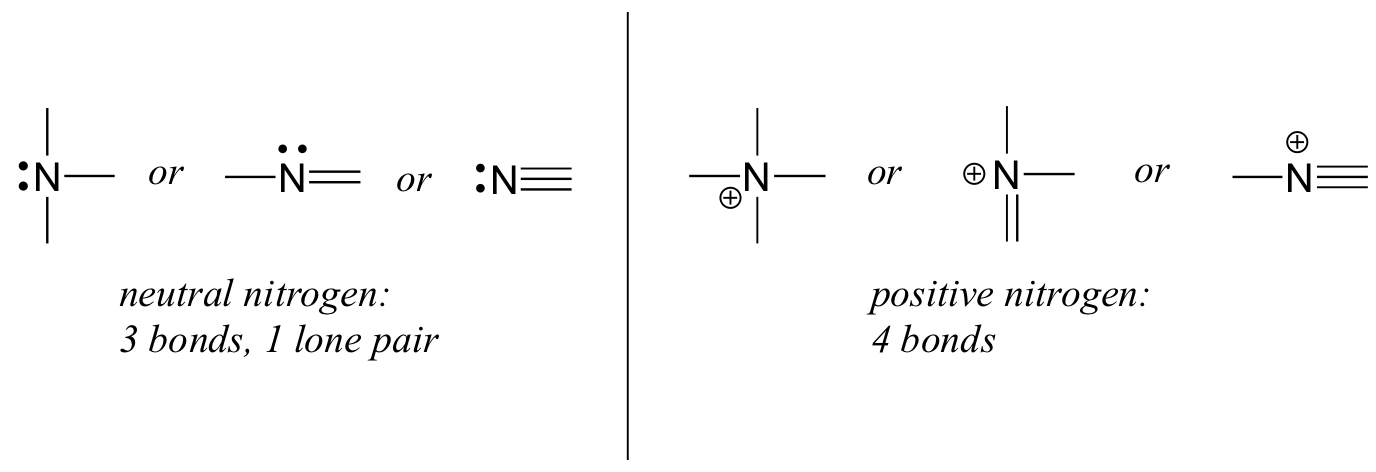
Якщо азот має три зв'язки і одиноку пару, він має формальний заряд нуль. Якщо він має чотири облігації (і немає одинокої пари), він має формальний заряд +1. У досить рідкісній схемі зв'язку негативно заряджений азот має дві зв'язки і дві самотні пари.
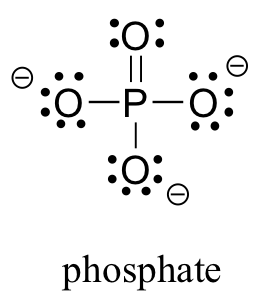
Два елементи третього ряду зазвичай містяться в біологічних органічних молекулах: сірка і фосфор. Хоча обидва ці елементи мають інші схеми зв'язку, які є актуальними в лабораторній хімії, в біологічному контексті сірка майже завжди дотримується тієї ж схеми зв'язування/формального заряду, що і кисень, тоді як фосфор присутній у вигляді фосфатного іона (PO 4 3-), де він має п'ять зв'язків (майже завжди до кисню), ніяких одиноких пар, а формальний заряд нуль. Пам'ятайте, що атоми елементів у третьому рядку і нижче в таблиці Менделєєва мають «розширені валентні оболонки» з d орбіталями, доступними для склеювання, і правило октету не застосовується.
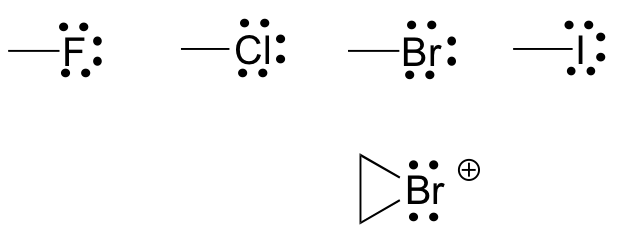
Нарешті, галогени (фтор, хлор, бром та йод) дуже важливі в лабораторній та лікарській органічній хімії, але рідше зустрічаються в природних органічних молекулах. Галогени в органічних сполуках зазвичай спостерігаються з одним зв'язком, трьома одинокими парами та формальним зарядом нульовим. Іноді, особливо у випадку з бромом, ми зіткнемося з реактивними формами, в яких галоген має дві зв'язки (зазвичай в тричленному кільці), дві одинокі пари і формальний заряд +1.
Ці правила, якщо їх вивчити та засвоїти так, що вам навіть не потрібно думати про них, дозволять вам досить швидко намалювати великі органічні структури, доповнені формальними звинуваченнями.
Після того, як ви отримали зависання малювання структур Льюїса, не завжди потрібно малювати одинокі пари на гетероатомах, оскільки ви можете припустити, що навколо кожного атома присутня належна кількість електронів, щоб відповідати вказаному формальному заряду (або його відсутності). Іноді, однак, самотні пари малюються, якщо це допомагає зробити пояснення більш чітким.