Фосфіни
- Page ID
- 104847
Дослідження епічного ліганду триває третинними фосфінами, PR 3. Фосфіни найбільш примітні своєю чудовою електронною та стеричною перебудовуваністю та їх «невинністю» - вони, як правило, уникають безпосередньої участі в металоорганічних реакціях, але мають здатність глибоко модулювати електронні властивості металевого центру, до якого вони пов'язані. Крім того, оскільки енергетичний бар'єр для парасолькового гортання фосфінів досить високий, ліганди «хірально-фосфорні» можуть бути виділені в енантіозбагаченій формі та введені в металеві центри, приводячи асиметрію приблизно так близько до металу, як це може отримати в хіральних комплексах. Фосфор ЯМР - це техніка, яка просто працює (спасибі, природа). М'які фосфіни дуже добре поєднуються з м'якими низьковалентними перехідними металами. Бідні електронами фосфіни - це навіть хороші π -кислоти!
Загальні властивості
Як і СО, фосфіни є давальними лігандами L-типу, які формально вносять два електрони в металевий центр. На відміну від СО, більшість фосфінів недостатньо малі, щоб утворити більше чотирьох зв'язків з єдиним металевим центром (а для великих R число ще менше). Стерична перешкода стає проблемою, коли п'ять і більше лігандів PR 3 намагаються пробитися в простір навколо металу. Цікавим наслідком цього факту є те, що багато фосфінсодержащие комплекси не мають 18 валентних електронів. Приклади включають Pt (PCY 3) 2, Pd [P (t-Бу) 3] 2 та [Rh (pPH 3) 3] +. Хіба це не просто зводить вас з розуму? Це також зводить комплекси з розуму - і більшість цих координаційно ненасичених сполук є чудовими каталізаторами.
Місткування фосфінами зустрічається вкрай рідко, але ліганди, що містять множинні донори фосфіну, які зв'язуються за допомогою L n (n > 1) способу з одним металевим центром, повсюдно. Ці ліганди називаються хелатними або полідентатними, щоб вказати, що вони фіксуються до металевих центрів через кілька місць зв'язування. З ентропних причин хелатні ліганди зв'язуються з одним металевим центром у декількох точках, якщо це можливо, замість приєднання до двох різних металевих центрів (влучно названий хелатний ефект). Важливою характеристикою хелатних фосфінів є кут прикусу, який визначається як переважний кут P—M—P у відомих комплексах ліганду. Ми перейдемо до цікавих ефектів кута укусу пізніше, але поки що ми можемо уявити, як «нещасний» ліганд з бажаним кутом укусу 120° буде в квадратній площинній геометрії. Було б набагато краще бути частиною тригонального біпірамідного комплексу, наприклад.
Переважна орбітальна взаємодія, що сприяє зв'язуванню фосфіну, - це та, яку ми очікуємо, самотня пара на фосфорі, що взаємодіє з порожньою металевою орбітальною d. Електронна природа R груп впливає на електронно-донорську здатність атома фосфору. Наприклад, алкілфосфіни, які мають зв'язки P—Csp 3, як правило, є кращими донорами електронів, ніж арилфосфіни, які мають зв'язки P—Csp 2. Обґрунтуванням тут є більша електронегативність гібридної орбіти sp 2 порівняно з гібридом sp3, що змушує атом фосфору міцніше утримуватися до своєї одинокої пари, коли зв'язується з вуглецем sp 2. Та ж ідея застосовується, коли електронні відводять і -донорські групи включені в R: електронна щільність на P низька, коли R містить групи, що відводить електрони, і висока, коли R містить електронні донорські групи. Ліганди (і асоційовані метали) в першому класі називаються бідними електронами, тоді як ті, що знаходяться в останньому класі, багаті електронами.
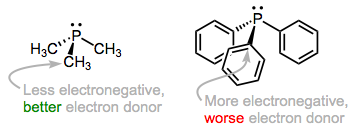
Коли ми додаємо електронегативні групи R, атом фосфору (і метал, до якого він пов'язаний) стає більш бідним на електрони.
Як і СО, фосфіни певною мірою беруть участь у зворотному зв'язку; однак явище тут має принципово інший характер, ніж зворотне з'єднання СО. З одного боку, фосфінів не вистачає π* орбіталі. У минулі дні хіміки приписували зворотне зв'язування в фосфінових комплексах взаємодії між металевою d π орбіталлю та порожньою 3d орбіталлю на фосфорі. Однак ця ідея елегантно була доведена фіктивною, і набагато більш органічно дружнє пояснення зайняло своє місце (не потрібно d орбіталів на P!). У освітлювальній серії експериментів довжини зв'язків M—P та P—R вимірювали за допомогою кристалографії для декількох окислювально-відновних пар комплексів. Я вибрав два наочних приклади, хоча пов'язане посилання є повним інших пар. Питання: як ми пояснюємо зміни довжини зв'язку при окисленні?
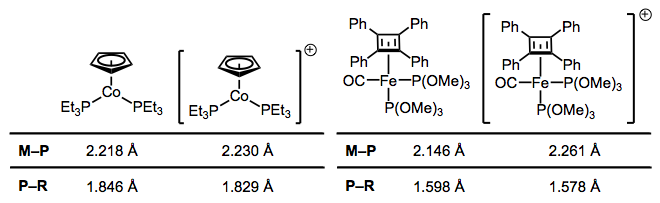
При окисленні довжини зв'язків M—P збільшуються, а довжина зв'язків P—R зменшується. Чому?
Окислення знижує здатність металу до зворотного зв'язку, оскільки він видаляє електронну щільність з металу. Це пояснює збільшення довжини зв'язку M - P - просто уявіть собі зменшення порядку зв'язку M - P через гірше зворотного зв'язку. А зменшення довжини зв'язку P—R? Важливо бачити, що виклик лише фосфорних 3d орбіталів не пояснить зміни довжини зв'язків P—R, оскільки 3d атомні орбіталі найбільш виразно локалізовані на фосфорі. Натомість ми повинні викликати участь σ p—R орбіталів у фосфінному зворотному зв'язку, щоб врахувати зменшення довжини P—R. Коли все сказано і зроблено, LUMO вільного фосфіну має в основному антизв'язуючий характер P—R, з деяким 3d кинутим у суміш. На малюнку нижче зображена одна з взаємодій, що беруть участь у M—P зворотному зв'язку, a d π → σ* взаємодія (ортогональне d π → σ* взаємодія також відіграє певну роль). Як і у випадку СО, резонансна структура, що зображує подвійний зв'язок M = P, є корисною евристикою! Природно, групи R, які краще здатні стабілізувати негативний заряд - тобто групи, що відводять електрони, полегшують зворотне зв'язування фосфінів. Метали, багаті електронами, теж допомагають.
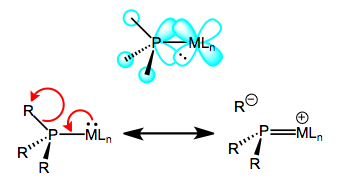
Backbonding у фосфіні, справа, що розриває сигма-зв'язок.
Стеричні та електронні властивості фосфінів надзвичайно різняться. Толман розробив деякі інтригуючі параметри, що характеризують стеричні та електронні властивості цього класу лігандів. Для вирішення стерики він розробив ідею кута конуса - кут вершини конуса, утвореного точкою 2,28 Å від атома фосфору (ідеалізована довжина зв'язку M - P), і крайніх країв атомів у групах R, коли групи R згорнуті назад якомога більше. Більш широкі кути конуса, аргументував Толман, вказують на більшу стеричну завантаженість навколо атома фосфору. Для вирішення проблем електроніки Толман використовував не дуже старий наш друг - частоту розтягування CO (Co) змішаних фосфін-карбонільних комплексів. Зокрема, він використовував комплекси Ni (CO) 3L, де L - третинний фосфін, як його стандарт. Чи можете ви передбачити логіку Толмана? Як слід змінитися Co у міру збільшення електронно-донорської здатності фосфінних лігандів?
Логіка Толмана йшла наступним чином: сильніше електрон-донорські фосфіни асоціюються з більш багатими електронами металами, які краще піддаються зворотному зв'язку СО (за рахунок принципово більш високих орбітальних енергій). Краще CO backbonding відповідає більш низькому CO через зменшення порядку облігацій C—O. Таким чином, кращі донорські ліганди повинні бути пов'язані з більш низькими значеннями Co (і навпаки для електронно-виводять лігандів). Чи був він правильний? Виставка A...
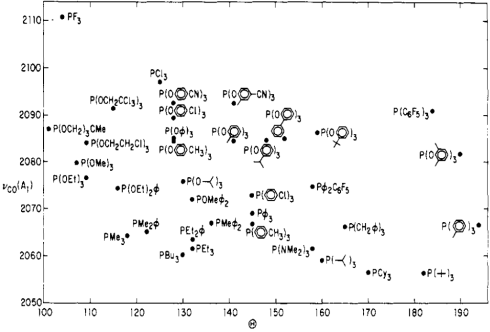
Толмана про стеричні та електронні властивості фосфінових лігандів.
Зверніть увагу на бідний ліганд трифторфосфін, що застряг у кутку «дуже маленького, дуже відведення», і його повну протилежність, гігантський три (трет-бутил) фосфін у «надзвичайно громіздкому, дуже донорському» кутку. Інтригуючий! Можна багато чому навчитися, просто вивчивши цю діаграму.
Синтез
Фосфінові комплекси найчастіше виробляються за допомогою процесів заміщення лігандів - обміну одного ліганду на інший на металевому центрі. Один цікавий метод використовує третинні N-оксиди, щоб по суті «окислювати» ліганд СО, залишаючи позаду відкриту координаційну ділянку, який може бути заповнений фосфіном. Зверніть увагу, що вуглець СО поводиться як електрофіл в цьому процесі. Ши і Базоло майстерно демонструють, що проміжний комплекс амінів не може бути задіяний в цьому механізмі. Опромінення ультрафіолетовим світлом є альтернативним методом коаксіального виведення СО ліганду від карбонільних комплексів металів.
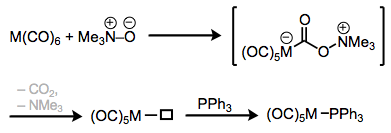
Заміна ліганду за допомогою триметиламіну оксиду.
Методи синтезу самих фосфінних лігандів дещо виходять за рамки нашої сфери, але електрофільна хімія фосфору поширена, особливо коли мішенню є арилфосфіни.
Реакції
Фосфіни найчастіше є глядацькими лігандами, тобто вони не беруть участі в реакціях, а тримаються на їзді. Є, однак, деякі важливі винятки з цього правила. Перш за все, дисоціація фосфінового ліганда часто потрібна для створення місця координаційної ненасиченості перед початком каталітичних реакцій. Хорошими прикладами є перехресні муфти, що використовують насичений Pd (pPH 3) 4. Цей комплекс насправді є лише прекаталізатором, який повинен втратити фосфінові ліганди, щоб увійти в каталітичний цикл перехресного зчеплення. Фосфінова асоціація також є важливим етапом багатьох каталітичних реакцій.
Які шляхи розкладання доступні фосфіновим лігандам? Розщеплення P—C зв'язку є напрочуд поширеним процесом. Загалом, ідея полягає в тому, що металевий центр може вставлятися в зв'язок P—C за допомогою узгодженого окислювального додавання, а потім відновним шляхом усунути, щоб встановити новий зв'язок P—C. Редуктивне усунення може відбуватися навіть після деяких проміжних етапів, як у прикладі нижче.
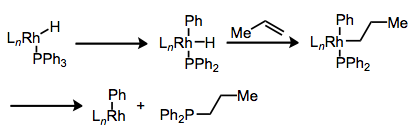
Розщеплення зв'язку P—C: також відомий як «Перемішування групи R».
Формування солей фосфонію з комплексів арилфосфіну є супутнім процесом. Тут комплекс по суті просто розпадається після редуктивної ліквідації P—C.
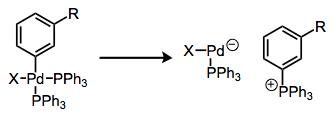
Редуктивна елімінація з утворенням солей фосфонію.
Фосфінові ліганди є скрізь, і ми обов'язково побачимо більше цього захоплюючого класу лігандів у майбутньому. Вони особливо потужні як носії асиметрії в хіральних металевих комплексах, які використовуються для приготування енантіозбагачених органічних продуктів.