Металеві алкіли
- Page ID
- 104857
Частина 1:
За допомогою цієї публікації ми нарешті досягаємо визначальних лігандів металоорганічної хімії, алкілів. Металеві алкіли мають металево-вуглецевий зв'язок σ і зазвичай є акторськими лігандами, хоча деякі алкільні ліганди поводяться як глядачі. Нашою метою буде зрозуміти загальну залежність поведінки алкільних лігандів від центру металу і замісників ліганду. Використовуючи ці знання, ми можемо зробити змістовні порівняння між спорідненими металевими алкільними комплексами та освіченими прогнозами щодо їх ймовірної поведінки. Оскільки алкілові ліганди є центральними для металоорганічної хімії, я вирішив поширити цю дискусію на кілька публікацій. Розберемося спочатку з загальними властивостями алкілів металів.
У серії «Спрощення металоорганічного комплексу» ми розкладали зв'язок М-С на позитивно заряджений метал і негативно заряджений вуглець. Ця процедура деконструкції узгоджується з відносною електронегативністю вуглецю та перехідних металів. Нам може бути дуже корисно уявити алкіли металів, по суті, як стабілізовані карбоніїни, але також важливо розуміти, що M—C зв'язки мають гаму від надзвичайно іонних та сольових (NaCH 3) до по суті ковалентних ([HGCH 3] +). Реактивність алкілліганда обернено пов'язана з електронегативністю металевого центру.
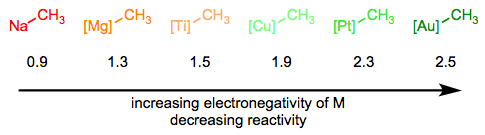
Гібридизація атома вуглецю також важлива, і тенденція тут слідує тенденції нуклеофільності як функції гібридизації в органічній хімії. sp -Гібридизовані ліганди є найменш нуклеофільними, за ними слідують ліганди sp 2 та sp 3 відповідно.
Історія алкілів перехідних металів є інтригуючим прикладом неправильної наукової парадигми. Після кількох невдалих спроб виділити стійкі алкіли металів, металоорганічні хіміки в 1920-х роках отримали уявлення про те, що метало-вуглецеві зв'язки взагалі слабкі. Однак пізніші дослідження показали, що саме кінетична нестійкість, а не термодинамічна, винна наша нездатність ізолювати алкіли металів. Іншими словами, більшість алкілів металів сприйнятливі до шляхів розкладання з низькими бар'єрами активації - нестабільність зв'язку M—C сама по собі не винна. Крабтрі наводить типові значення 30-65 ккал/моль для міцності зв'язку М-С.
Які основні шляхи розкладання алкільних комплексів металів? Елімінація β-гідридів є найбільш поширеним. Термодинамічно повсюдність елімінації β-гідридів має сенс - зв'язки M—C працюють 30-65 ккал/моль, тоді як M—H зв'язки, як правило, сильніші. На малюнку нижче узагальнено прийнятий механізм та вимоги елімінації β-гідридів. Ми переглянемо цю фундаментальну реакцію металоорганічних комплексів у майбутньому пості.
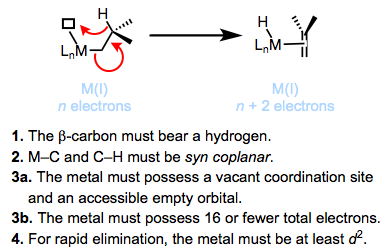
Кінетично стійкі алкільні комплекси металів порушують одну з вимог щодо елімінації β-гідридів. Метиловий і неопентиловий комплекси не мають дефіциту β-воднів, що порушують вимогу 1. Щільно зв'язуючі, хелатні ліганди можуть бути використані для запобігання утворенню порожнього координаційного ділянки, порушуючи вимоги 3а і 3b. Відомі титанові комплекси, які порушують вимогу 4 і усувають лише дуже повільно — для швидкого усунення потрібно зворотне донорство з металу до σ С—Н (див. Нижче).
Редуктивна елімінація - другий поширений шлях розкладання. Алкіловий ліганд зачеплюється з другим лігандом Х-типу на металі, а метал зменшується на дві одиниці зі зменшенням загальної кількості електронів на дві одиниці. Я опустив криволінійні стрілки тут, тому що відомі різні механізми редуктивного усунення. Ми детально обговоримо вимоги відновного усунення в майбутньому пості; наразі важливо зазначити, що термодинамічна стабільність C—X порівняно з (M—X+M—C) є критичною рушійною силою реакції.
Коли X = H, відновна елімінація майже завжди термодинамічно сприятлива; таким чином, ізольовані алкілгідридні комплекси рідкісні. Така поведінка - особливість, а не помилка, коли ми вважаємо, що хімія гідрогенізації залежить від цього! З іншого боку, коли X = галогенне відновлення, як правило, не сприяє. Редуктивної елімінації C—C (X = C) можна сприяти термодинамічно, але зазвичай повільніше, ніж відповідна елімінація С—Н.
Комплекси, які не можуть піддаватися елімінації β-гідридів, іноді сприйнятливі до α-елімінації, механістично подібного процесу, який утворює карбен металу. Цей процес особливо легкий, коли α-положення активується сусіднім донором електронів (результатом є карбени Фішера).
У деяких металевих алкільних комплексах зв'язки C—H в α, β або навіть далі позиціях можуть служити донорами електронів до центру металу. Ця ідея підкріплена кристалографічними доказами і хімічними зрушеннями ЯМР (перехід даруючих воднів на високе поле). Такі взаємодії називаються агностичними взаємодіями, і вони нагадують «перерваний» перехідний стан для елімінації гідридів. Алкільні комплекси, які не можуть піддаватися елімінації β-гідридів з електронних причин (високий ступінь окислення, d 0 металів) та вінілові комплекси зазвичай демонструють це явище. Той факт, що елімінація β-гідриду є повільною для d 0 металів - агостичні взаємодії спостерігаються замість цього - свідчить про те, що зворотне донорство від заповненої металевої орбіти до σ С—Н важливо для елімінації β-гідриду. Ось цікавий, недавній огляд агностичних взаємодій.
У наступному пості цієї серії ми більш детально розглянемо синтез алкільних комплексів металів, особливо уточнивши питання: як можна перемогти елімінацію β-гідридів?
Частина 2:
У цьому пості ми розглянемо найпоширеніші синтетичні методи синтезу алкільних комплексів. На додаток до перерахування реакцій, які виробляють алкільні комплекси, цей пост також опише стратегії обійти елімінацію β-гідридів, коли метою є ізольовані алкільні комплекси. Ось ми йдемо!
Властивості стабільних алкільних комплексів
Стабільні алкільні комплекси повинні бути стійкими до елімінації β-гідридів. В останньому дописі ми визначили чотири ключові умови, необхідні для усунення:
1. β-вуглець повинен нести водень.
2. Зв'язки M—C та C—H повинні мати можливість досягти син-компланарної орієнтації (вказуючи в одному напрямку в паралельних площинях).
3. Метал повинен нести 16 загальних електронів або менше і мати відкритий координаційний ділянку.
4. Метал повинен бути не менше d 2.
Стабільні алкільні комплекси повинні порушувати хоча б одне з цих умов. Наприклад, титанові (IV) комплекси, в яких відсутні d електрони β-елімінують дуже повільно. Комплекс нижче ймовірно також виграє від chelation (див. нижче).
Були розроблені комплекси, які не здатні досягти син-компланарної орієнтації, необхідної для ліквідації, або які не мають β-водню прямо. Нижче наведено кілька прикладів - треба захоплюватися кмітливістю дослідників, які розробили ці комплекси. Особливо вражає металевий циклобутан!
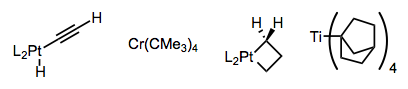
Використовуючи щільно зв'язуючі, хелатні ліганди або направляючу групу на підкладці, можна перешкоджати утворенню 16-електронних комплексів, чутливих до елімінації β-гідридів. Зверніть увагу, як гідроген-зв'язуючі ліганди L 2 в центральному комплексі нижче утримують металевий центр у смертельній хватці.
Нарешті, варто зазначити, що комплекси з відкритою координаційною ділянкою, такі як 16-електронні, квадратно-плоскі комплекси Ni, Pd та Pt, важливі для перехресного з'єднання, сприйнятливі до реакцій з розчинником або іншими видами на відкритому майданчику. Об'ємні алкілліганди допомагають запобігти цим побічним реакціям. У наведеному нижче прикладі метильні групи o -толілових лігандів простягаються в простір над і нижче квадратної площини, перешкоджаючи наближенню молекул розчинника перпендикулярно площині.
Багато комплексів перехідних металів каталізують (Е)/(Z) ізомеризацію та ізомеризацію кінцевих алкенів (α-олефінів) до внутрішніх ізомерів шляхом елімінації β-гідридів. Це свідчить про важливість цього процесу для алкільних комплексів. Звичайно, транзиторні алкільні комплекси можуть виявитися сприйнятливими до елімінації β-гідридів, але якщо інші процеси протікають швидше, елімінація не відбудеться. Таким чином, оптимізація багатьох реакцій із залученням алкільних комплексів як проміжних продуктів передбачала прискорення інших процесів за рахунок елімінації β-гідридів - гідроціанування.
Синтез алкільних комплексів
Домінуючі синтетичні методи для алкільних комплексів засновані на нуклеофільній атаці, електрофільній атаці, окислювальному додаванні та міграційній вставці. Перші два методи повинні бути інтуїтивно зрозумілими для хіміка-органіки; другі два засновані на більш езотеричних (але не менш важливих) реакціях металоорганічних комплексів.
Метали, що несуть хороші залишкові групи, аналогічні органічним електрофілам і сприйнятливі до нуклеофільної атаки органолітіями, реагентами Гріньяра та іншими поляризованими органометаліками. Ці реакції можна розглядати як різновид трансметалізації, оскільки алкілліганд переміщається з одного металу в інший. Електронно-вилучаючі ліганди X-типу, такі як —Cl та —Br, повинні вискочити як хороші групи, що залишають. З іншого боку, чисте заміщення лігандів L-типу аніоновими нуклеофілами відбувається набагато рідше (аніонні комплекси призводять).
Багато аніонних комплексів металів є нуклеофільними досить, щоб атакувати електрофільні джерела вуглецю, такі як алкіл і ацилгалогеніди в режимі електрофільної атаки. Наявна самотня пара на металі та відкритій координаційній ділянці є передумовами для цієї хімії. Заряд на комплексі збільшується на одну одиницю (по суті негативний заряд передається в відходить групу електрофіла). Ми можемо класифікувати їх як реакції окислювального лігування - зверніть увагу, що ступінь окислення металу збільшується на дві одиниці.
Окислювальне додавання призводить до розщеплення W—Z зв'язку та розміщення двох нових лігандів X-типу (—W та —Z) на металевому центрі зі збільшенням ступеня окислення металу та загальної кількості електронів на дві одиниці. Органічні галогеніди є надзвичайно поширеними субстратами для цієї реакції, перший крок у механізмі реакцій перехресного зчеплення. Окислений металевий комплекс, що містить нові алкільні та галогенідні ліганди, є кінцевим продуктом. Зверніть увагу, що потрібні два відкритих координаційних ділянки (не обов'язково одночасно), металевий центр повинен піддаватися двоелектронному окисленню, а кількість сумарних електронів комплексу збільшується на два. По суті, електрони зв'язку W—Z приєднуються до партії комплексу. Зверніть увагу, що існує багато відомих механізмів окислювального додавання! Ми детально вивчимо ці різні механізми в майбутньому пості.
Нарешті, міграційна вставка ненасичених органічних сполук є важливим методом синтезу певних алкільних комплексів та важливим етапом металоорганічних реакцій, які призводять до додавання через π зв'язки. Міграційна вставка - це мікроскопічний зворотний ефект елімінації β-гідридів. Розумний серед вас може помітити, що використання міграційної вставки для синтезу алкільних комплексів здається невідповідним нашому спостереженню, що його зворотний є повсюдним для алкілів металів - не повинна рівновага сприяти комплексу олефінгідридів? У багатьох випадках це так; однак є деякі помітні винятки. Наприклад, перфтороалкільні комплекси виключно стабільні (чому?) , тому введення фтороалкенів часто віддають перевагу над елімінацією.
Як ми зазначали вище, ми все ще можемо викликати кінетично стабільні алкільні комплекси як проміжні продукти в реакціях за умови, що наступні кроки швидше. У наступному дописі ми розглянемо загальні класи реакцій, в яких алкільні комплекси виявляють себе основними гравцями, зосередившись на конкретних механістичних кроках, що включають алкільний комплекс (відновна елімінація, трансметалізація, міграційна вставка та [природно] елімінація β-гідридів).
Частина 3:
У цьому останньому дописі про алкільні ліганди ми розглянемо основні режими реакційної здатності алкілів металів. Ми детально обговорювали елімінацію β-гідридів, але інші долі алкілів металів включають відновну елімінацію, трансметалізацію та міграційну вставку в зв'язок M—C. Подібно до наших досліджень інших лігандів, ми хотіли б пов'язати стеричні та електронні властивості алкільного комплексу металів з його схильністю до цих реакцій. Таке мислення особливо важливо, коли ми зацікавлені в контролі відносних показників та/або масштабів двох різних, конкуруючих шляхів реакції.
Реакції алкільних комплексів металів
Нагадаємо, що елімінація β-гідридів є надзвичайно поширеним, а іноді і проблемним - перетворенням алкілів металів. Знову ж таки, є реакції, для яких бажана елімінація β-гідриду, наприклад реакція Хека. Структурні модифікації, що зміцнюють зв'язок M—H щодо зв'язку M—C, заохочують елімінацію β-гідриду; крок також може керуватися захопленням продукту гідриду металу основою (реакція Хека використовує цю ідею).
З іншого боку, стабілізація зв'язку M—C перешкоджає елімінації та заохочує її зворотне: міграційне введення олефінів у М-Н, раніше ми бачили приклад перфтороалкільних лігандів, які мають виключно стабільні зв'язки M—C. Фундаментальна ідея тут - що групи відведення електронів на алкілліганді стабілізують зв'язок M—C, є досить загальною. Хартвіг описує збільшення «іонного характеру» зв'язку M—C при додаванні до алкільного ліганду груп, що відводять електрони (тим самим зміцнюючи зв'язок M—C, оскільки іонні зв'язки сильніші за ковалентні зв'язки). Енергії зв'язку з органічною хімією певною мірою несуть цю ідею; наприклад, дивіться відносні BDE Мене, Мене-Ph та Мене-КЧ у цьому посиланні. Я все ще вважаю це пояснення трохи «руко-хвилястим», але воно служить нашій меті, я вважаю.
Алкіли металів підлягають відновному елімінації, мікроскопічному зворотному окислювальному додаванню. Метал втрачає два ковалентних ліганди, його формальна ступінь окислення зменшується на дві одиниці, загальна кількість електронів зменшується на дві одиниці, утворюється зв'язок R—X. Редуктивна елімінація є сприятливою, коли зв'язок R—X в органічному продукті є більш стабільною, ніж зв'язки M—R і M—X у стартовому комплексі (термодинамічний випуск). Слід зазначити, однак, що кінетика відновної елімінації істотно залежить від стеричної основної маси лігандів, що усувають. Узгоджена відновна елімінація R—H зазвичай має меншу енергію активації, ніж R—R елімінація.
Трансметалізація передбачає перенесення алкілліганда з одного металу на інший. Цікава проблема стосується відносної реакційної здатності алкілів металів до трансметалізації. Припускаючи подібні, нескладні набори лігандів, який з двох металевих центрів частіше тримається за алкіловий ліганд? Розглянемо дві ситуації нижче.
МІСТЕР + М' М + М'Р
М'Р + М'Р' МР' + М'Р
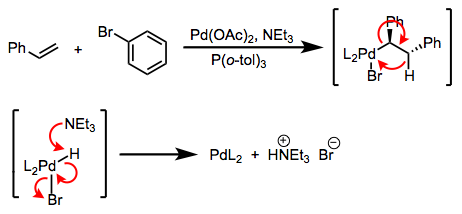
Перший - сумлінна трансметалізація; друга - дійсно подвійна реакція заміни. Відмінність рідко проводиться на практиці, але це важливо! Різниця полягає в тому, що в першому випадку повинен відбуватися одноелектронний перенесення роду, в той час як у другому - ніякої окислювально-відновної хімії не потрібно. Сприятливість в першому випадку регулюється відносними потенціалами відновлення M і M' (реакція йде вперед, коли M' легше окислюється, ніж М); у другому випадку відносна електропозитивність металів є ключовою, і інші фактори, такі як енергії решітки, можуть бути важливе. Різниця між трансметалізацією як такої та подвійною заміною пояснює парадоксальну синтетичну послідовність на малюнку нижче. На практиці обидва називаються «трансметалізація». Перегляньте ці слайди (сторінка 6) для узагальнення довідки.
Це приводить наш розширений погляд на метало-алкільні комплекси до тимчасового закриття. Звичайно, алкіли металів є скрізь в металоорганічної хімії... тому побачити їх знову майже неминуче! Наступний внесок у серії обстеження епічних лігандів стосується аллілу, циклопентадієнілу та інших непарних систем пі. Ці ліганди типу L n X можуть, як і арени, накопичувати на металевому центрі відразу шість електронів.