1.11: Прикордонні молекулярні орбіталі π-донора, π-донора та π-акцепторних лігандів
- Page ID
- 24320
Перш ніж зайнятися справою комплексу, слід враховувати природу прикордонних орбіталів ліганду. Існує три загальні класи лігандів, визначених їх прикордонними орбіталями: π-донорські ліганди, π-донорські ліганди та π-акцепторні ліганди.
σ-донорські ліганди
Ці ліганди пожертвують два e— s з орбіти σ -симетрії:
Н — (1с 2), НН 3 (2а 1 л), ПР 3 (2а 1 л), СН 3 - (2а 1 л), ОН 2 (б 1 л)
Зверніть увагу, деякі з цих лігандів є атомними, а інші - LCAO-MOS. Таким чином, прикордонні орбіталі для склеювання з металом є атомними або молекулярними орбіталями, залежно від природи ліганду.
Як приклад молекулярного ліганда розглянемо аміачний ліганд. Аміак утворюється з LCAO між валентними орбіталями центрального азоту та трьома 1s орбіталями трьох воднів,
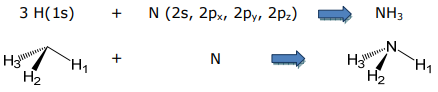
Щоб розпочати цю задачу, необхідно визначити адаптовані до симетрії лінійні комбінації трьох орбіталей 1s. Отже, основа буде виведена з орбіталів H. Оскільки орбіталі H (1s) можуть утворювати лише зв'язки σ, вибір 3 σ N—H зв'язків є відповідним базовим набором,
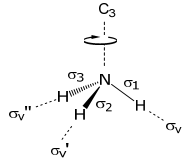
Властивості перетворення зв'язків σ (в симетрії C3v) такі:
\[ E \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} 0 & 1 & 0 \\ 0 & 0 & 1 \\ 1 & 0 & 0 \end{bmatrix} \]
\[ C_{3} \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} 1 & 0 & 0 \\ 0 & 1 & 0 \\ 0 & 0 & 1 \end{bmatrix} \]
\[ σ_{v} \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} 1 & 0 & 0 \\ 0 & 0 & 1 \\ 0 & 1 & 0 \end{bmatrix} \]
Ці уявлення цієї основи можна швидко встановити, розуміючи, що лише зв'язки (або орбіталі H (1s)), які не рухаються, сприятимуть сліду представлення матриці,
\ [\ begin {масив} {c|ccc}
\ математика {C} _ {3\ математика {v}} &\ математика {E} & 2\ математика {C} _ {3} & 3\ сигма_ {\ математика {v}}\\ лінія
\ гамма_ {\ сигма} & 3 & 0 & 1
\ кінець {масив}\\ праворуч стрілка a_ {1} + е\]
Проектуючи a1 і e SALC орбіталей 3H, ми розуміємо, що трансформаційні властивості орбіталей H зберігаються в ротаційній підгрупі С3,
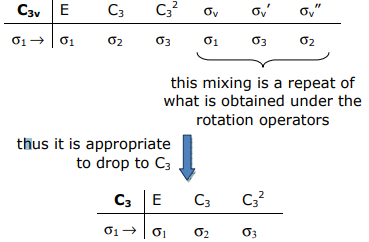
Застосування оператора проекції в циклічній групі точок С3 є легким завданням - можна просто зчитувати проекції,
\ begin {вирівняні}
&\ mathrm {P} ^ {\ mathrm {a} _ {1}}\ ліворуч (\ сигма_ {1}\ праворуч)\ праворуч 1\ cdot\ mathrm {E}\ sigma {1} +1\ cdot\ mathrm {C} _ {3}\ сигма_ {1} +1\ cdot\ mathrm {C}} _ {3} ^ {2}\ сигма_ {1} =\ сигма_ {1} +\ сигма_ {2} +\ сигма_ {3}\\
&\ матхрм {P} ^ {\ mathrm {e} (1)}\ лівий (\ сигма_ {1}\ праворуч)\ стрілка вправо 1\ cdot\ mathrm {E}\ сигма_ {1} +\ ліворуч (\ варепсилон ^ {*}\ праворуч)\ математика {C} _ {3}\ сигма_ {1} +\ варепсилон\ матрм {C} _ {3} ^ {2}\ сигма_ {1} =\ сигма_ {1} +\ varepsilon {1} +\ varepsilon lon^ {*}\ сигма_ {2} +\ varepsilon\ сигма_ {3}\\
&\ mathrm {P} ^ {\ mathrm {e} (2)}\ ліворуч (\ сигма_ {1}\ вправо)\ стрілка вправо 1\ cdot\ mathrm {E}\ сигма_ {1} + \ варепсилон\ матрм {C} _ {3}\ сигма_ {1} +\ лівий (\ варепсилон ^ {*}\ праворуч)\ математика {C} _ {3} ^ {2}\ сигма_ {1} =\ сигма_ {1} +\ варепсилон\ сигма_ {2} +\ варепсилон ^ {*}\ сигма_ {3}
\ кінець {вирівняний}
Беручи відповідні лінійні комбінації та нормалізуючи,
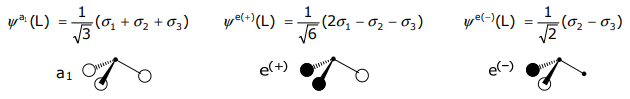
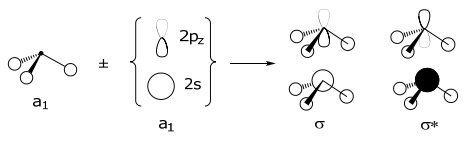
Тільки орбіталі однакової симетрії можуть утворювати LCAO; таким чином a1 SALC орбіталів 3H (1s) може поєднуватися лише з орбіталями a1 центральної N (тобто валентними орбіталями 2s та 2p z),
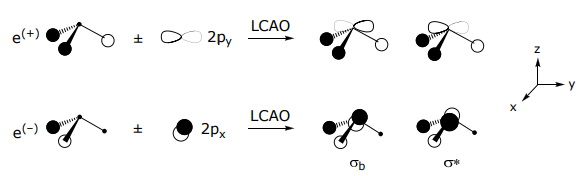
The 2p y орбітальна поєднується з e (+), вона ортогональна до e (—), тоді як протилежне вірно для 2p x орбітальної,
МО будується шляхом перекриття орбіталів однакової симетрії. Чим більше перекриття, тим більше розщеплення між орбіталями. Зверніть увагу, що a 1 SALC бере участь у двох типах σ взаємодій, один з 2s орбітальний і один з 2p z орбіталі азоту. Для склеювання з металом використовується орбітальний ліганд HOMO орбітальний. Цей орбітальний теж складається з двох типів взаємодій: (i) це зв'язок Lσ (a 1) —N (2s) і (ii) Lσ (a 1) —N (2p z) зв'язок за характером. Енергія атомних орбіталей показана в дужках.
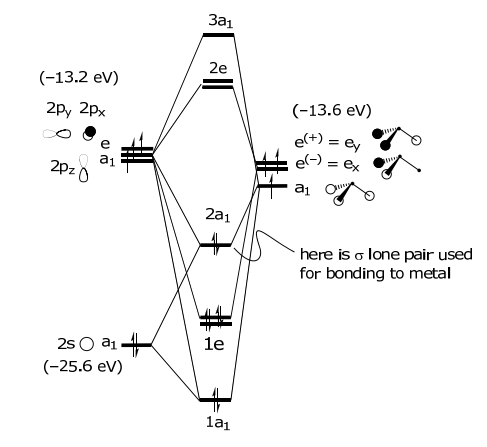
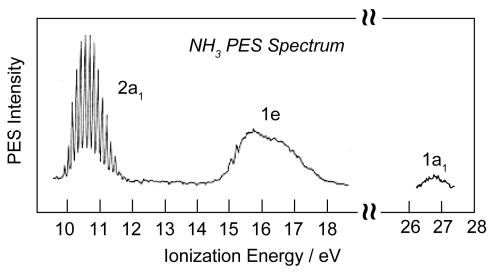
Прості аргументи гібридизації передбачають дві різні енергії зв'язку для NH 3: (1) одинична пара і (2) зв'язок σ N—H. Діаграма МО з іншого боку пророкує три різні енергії. Фотоелектронний спектр NH 3 демонструє три енергії іонізації, таким чином перевіряючи модель зв'язку МО.
Другий молекулярний ліганд - вода. Ліганд має дві одинокі пари, але в склеюванні з металом використовується тільки одна. Причина такої електронної асиметрії і чому лише одна одинока пара доступна лише для склеювання, стає очевидною з електронної структури молекули води.
Базовим набором для води є орбіталі 2H (1s) та атомні орбіталі O (2s, 2p z, 2p x, 2p y). Правильна симетрія адаптована лінійна комбінація для 2H (1s) орбіталів може бути встановлена за допомогою вищевказаних σ зв'язків.
\ почати {вирівняний}
&\ почати {масив} {c|cccc}
\ mathbf {C} _ {\ mathbf {2 v}} &\ математика {E} &\ mathrm {C} _ {2} &\ sigma_ {\ mathrm {v}} (\ математика {xz}) &\ sigma {\ mathrm {v}} (\ mathrm {yz})
\\ hline\ Gamma_ {\ сигма} & 2 & 0 & 0 &\ стрілка вправо a_ {1} + b_ {1}\
\ hline\ сигма_ {1}\ стрілка вправо &\ сигма_ {1} &\ сигма_ {2} &\ сигма_ {1} &\ сигма_ {2}
\ кінець {масив}\
\ кінець {вирівняний}
Застосовуючи оператор проекції,
\ begin {вирівняні}
&\ mathrm {P} ^ {\ mathrm {a} _ {1}}\ ліворуч (\ сигма_ {1}\ праворуч)\ праворуч 1\ cdot\ накладення {\ mathrm {E}\ сигма_ {1}}} ^ {\ сигма_ {1}} +1\ cdot\ накладення
Callstack:
at (Хімія/Неорганічна_хімія/Книга:_Принципи_неорганічної_хімії_II_(Nocera)/01:_Розділи/1.11:_Прикордонні_молекулярні_орбіталі_π-донора,_π-донора_та_π-акцепторних_лігандів), /content/body/p[35]/span, line 1, column 1
&\ mathrm {P} ^ {\ mathrm {b} _ {1}}\ ліворуч (\ сигма_ {1}\ праворуч)\ праворуч 1\ cdot\ mathrm {E}\ сигма_ {1} + (-1)\ cdot\ mathrm {C} _ {2}\ сигма_ {1} +1\ cdot\ сигма (\ математика {xz})\ cdot\ сигма_ {1} + (-1)\ cdot\ сигма (\ mathrm {yz})\ cdot\ сигма_ {1}\ стрілка вправо\ psi_ {\ mathrm {b}} =\ frac {1} {\ sqrt {2}}\ лівий (\ сигма_ {1} -\ сигма {2}\ праворуч)
\ кінець {вирівняний}
Орбіталі s і pz на O мають симетрію a1 і, таким чином, змішуватимуться з Lσ (a 1), p x має b 1 симетрію і змішуватиметься з Lσ (b 1), а орбітальна p y строго не зв'язується, тобто не має симетрії аналога атома O, а отже, немає LCAO утворюється за допомогою цієї орбіти.
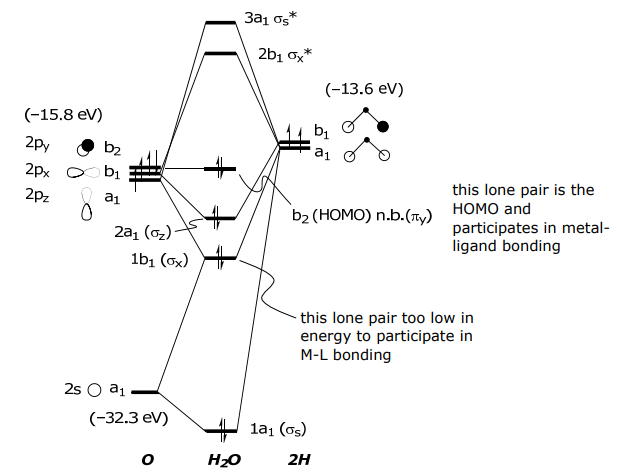
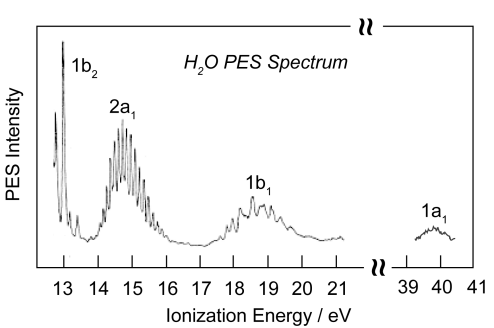
Знову ж таки, показано, що проста картина гібридизації склеювання є неправильною, а модель склеювання МО підтверджена.
π-донори
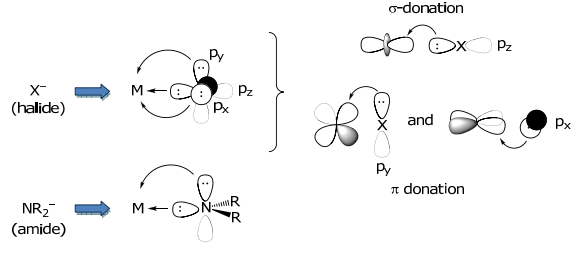
π-донори На додаток до пожертвування електронної щільності металу через σ-зв'язок, e - s можуть бути надані металу за допомогою π-симетрії взаємодії. π-донорні ліганди включають X - (галогенід), амід (NR 2 -), сульфід (S 2—), оксид (O 2—), алкоксид ( РО —).
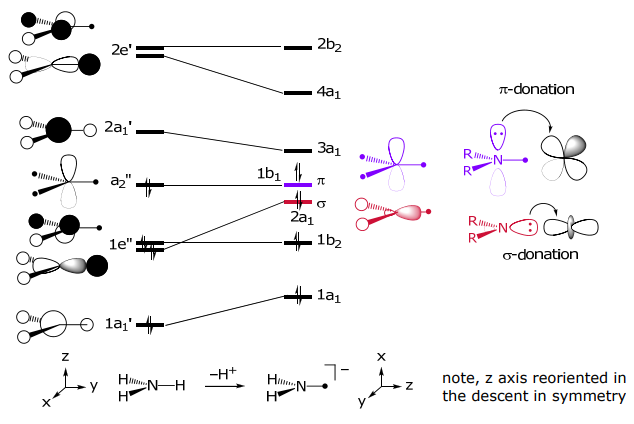
Амід МО може бути побудований, починаючи з МО «планарного» NH 3 з подальшим його збуренням при видаленні Н +,
π-акцептори
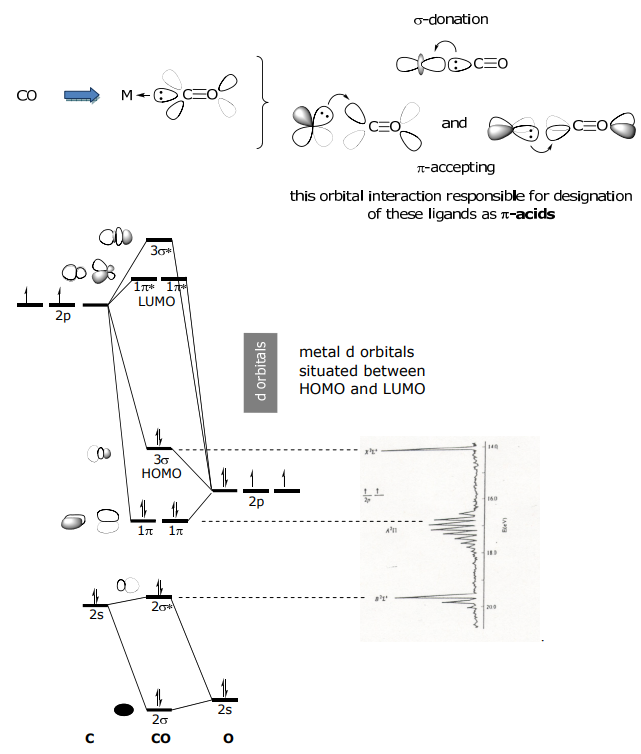
Цей клас лігандів здають e — s з a σ орбіталі і вони приймають e — s з металу в порожню π* орбіталь. СО - архетип цього класу лігандів. Інші π-акцептори NO +, CN —, CNR. Розглянемо діаграму МО СО нижче; HOMO заповнений і σ -симетрії, LUMO порожній і π* симетрії.