5.2.4: Фотоелектронна спектроскопія
- Page ID
- 32840
Фотоелектронний спектр може показувати відносні енергії займаних молекулярних орбіталей шляхом іонізації. Енергія іонізації - це пряма міра енергії, необхідної для того, щоб просто видалити відповідний електрон з початкового рівня до рівня вакууму (вільний електрон). Фотоелектронна спектроскопія вимірює відносні енергії землі і збуджені позитивні іонні стани, які отримують шляхом видалення одиночних електронів з нейтральної молекули.
\[A + \text{photon} \rightarrow A^+ + e^- \nonumber \]
Інформація, отримана в результаті фотоелектронної спектроскопії, зазвичай обговорюється з точки зору електронної структури та зв'язку в наземних станах нейтральних молекул, з іонізацією електронів, що відбуваються з склеювання молекулярних орбіталів, одиноких пар, антизв'язуючих молекулярних орбіталів або атомних сердечників. Ці описи відображають зв'язок енергій іонізації з молекулярно-орбітальною моделлю електронної структури.
Енергії іонізації безпосередньо пов'язані з енергіями молекулярних орбіталів (за теоремою Купмана).
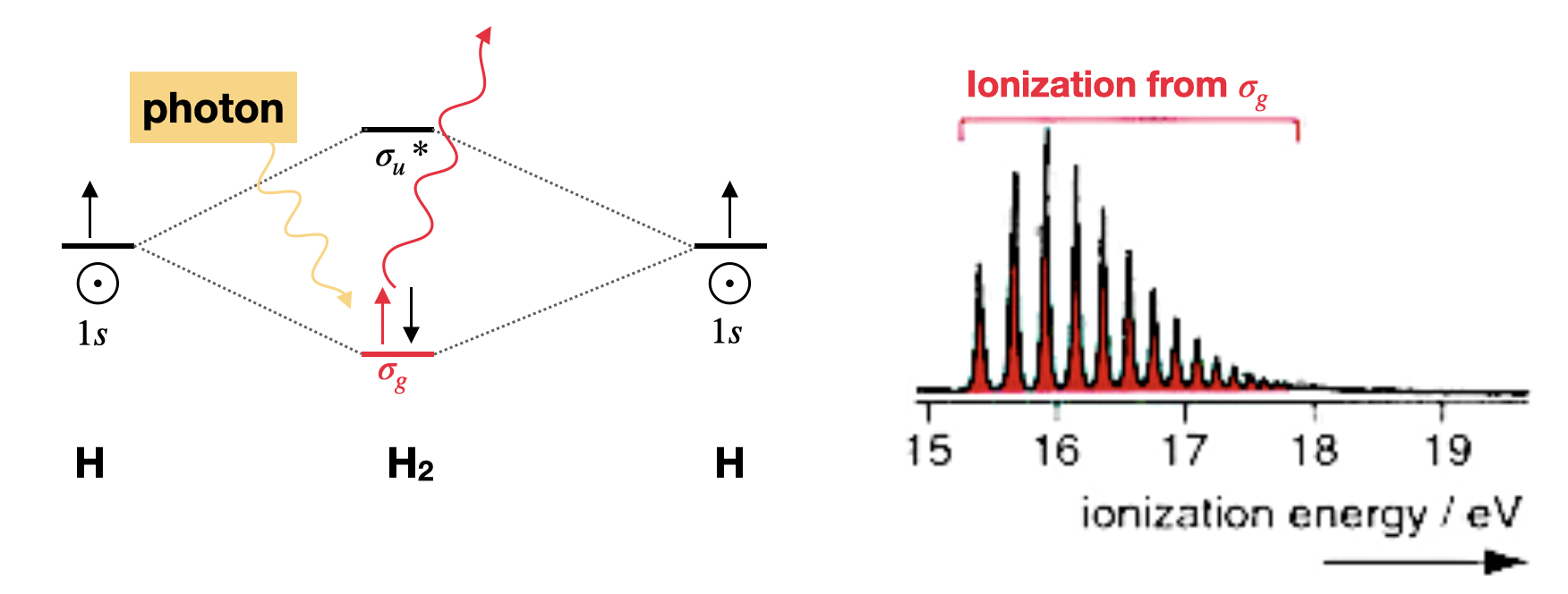
Приклад: Фотоелектронний спектр диводню
Молекулярний орбітальний опис дигідрогену включає дві\(1s\) атомні орбіталі, що генерують дві молекулярні орбіталі: зв'язок\(\sigma_g\) та антизв'язування\(\sigma_u^*\). Два електрони займають орбітальну\(\sigma_g\) зв'язок, залишаючи молекулу з порядком зв'язку один (рис.\(\PageIndex{1}\)). Спектр PES дигідрогену (рис.\(\PageIndex{1}\)) має єдину смугу, яка відповідає іонізації одного електрона з\(\sigma_g\). Множинні піки обумовлені електронами, що викидаються з діапазону стимульованих коливальних енергетичних рівнів. Коли велика коливальна структура вирішується в молекулярній орбіталі PES, то видалення електрона з цієї молекулярної орбіталі викликає значну зміну зв'язку (в цьому випадку збільшення довжини зв'язку через зменшення порядку зв'язку).
Приклад: Фотоелектронний спектр азоту
Двоатомний азот є більш складним, ніж водень, оскільки зайняті множинні молекулярні орбіталі. П'ять молекулярних орбіталей зайняті, дві з них вироджені. Три смуги в спектрі фотоелектронів відповідають іонізації електрона в\(\sigma_g(2p)\),\(\pi_u(2p)\) а\(\sigma_u^*(2s)\) молекулярні орбіталі. Іонізація четвертого типу орбіти, не відображається на малюнку\(\sigma_g(2s)\),\(\PageIndex{2}\) оскільки вона або зашкалює, або тому, що падаюче світло, що\(h\nu\) використовується, не мав достатньої енергії для іонізації електронів в цій глибоко стабілізованій молекулярній орбіталі. Зауважимо, що велика коливальна структура для\(\pi_u(2p)\) смуги вказує на те, що видалення електрона з цієї молекулярної орбіти викликає значну зміну зв'язку.
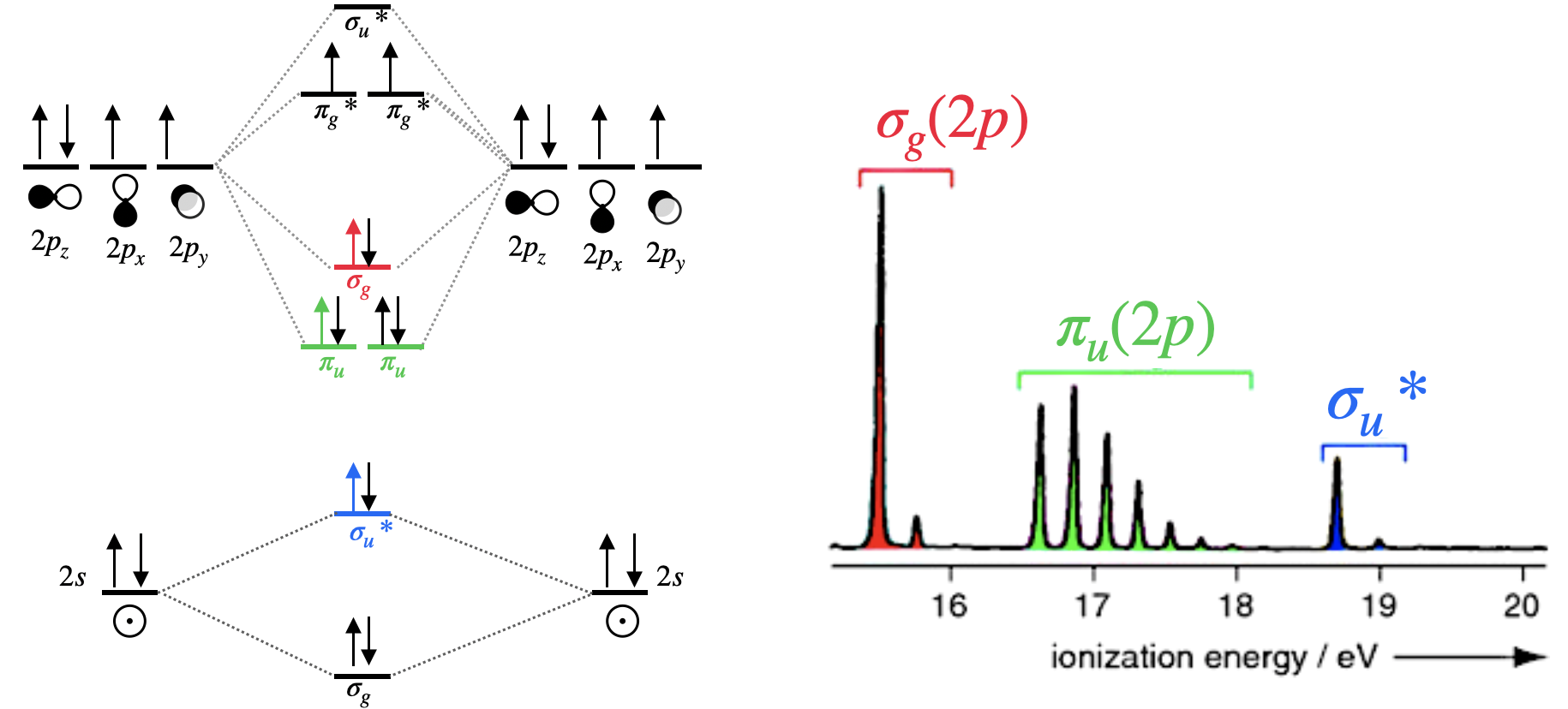
З фотоелектронного спектра азоту ми бачимо, що електрони в\(\sigma_g(2p)\) орбіталі можуть бути іонізовані, використовуючи меншу енергію, ніж потрібно для іонізації електронів в\(\pi_u(2p)\) орбіталі. Це свідчить про\(\sigma_g(2p)\) існування при більш високій енергії, ніж\(\pi_u(2p)\) орбіталі.
