5.2.3: Двоатомні молекули першого і другого періодів
- Page ID
- 32854
Гомоядерні двоатомні молекули першого періоду
У першому рядку таблиці Менделєєва знаходяться валентні атомні орбіталі\(1s\). Можливі дві гомоядерні двоатомні молекули першого періоду:
Дигідроген, Н 2\([\sigma_g^2(1s)]\): Це найпростіша двоатомна молекула. Він має лише дві молекулярні орбіталі (\(\sigma_g\)і\(\sigma_u^{*}\)), два електрони, порядок зв'язку 1, і є діамагнітним. Довжина його зв'язку становить 74 вечора. Теорія МО призведе до того, що порядок зв'язку зменшиться, а довжина зв'язку збільшиться, якщо ми або додамо або віднімемо один електрон. Розрахункова довжина зв'язку для\(\ce{H_2^{+}}\) іона становить приблизно 105 пм. 1
Дигелій, Він 2 \([\sigma_g^2\sigma_u^{*2}(1s)]\): Ця молекула має порядок зв'язку нуль через рівну кількість електронів в зв'язкових і антизв'язуючих орбіталів. Як і інші нобелівські гази, він існує в атомному вигляді і не утворює зв'язків при звичайних температурах і тисках.
Намалюйте повні молекулярні орбітальні діаграми для\(\ce{H2}\) і для\(\ce{He2}\). Включити ескізи атомних і молекулярних орбіталей.
- Відповідь
-
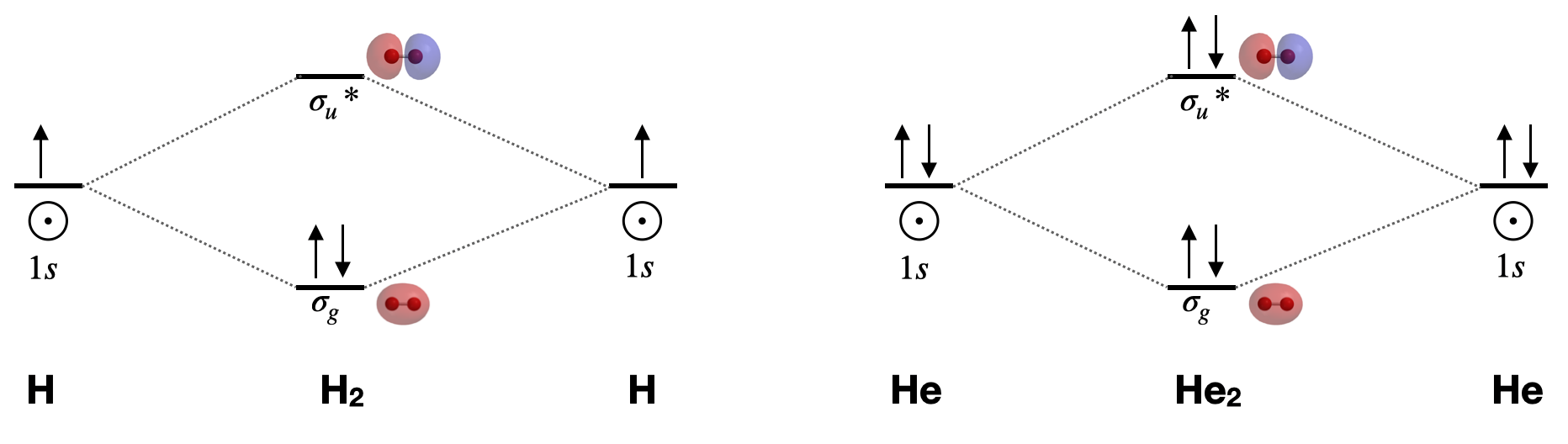
Малюнок для вправи\(\PageIndex{1}\): Молекулярні орбітальні діаграми для дигідрогену та дигелію. Молекулярні орбітальні поверхні, розраховані за допомогою програмного забезпечення Spartan. (CC-BY-NC-SA; Кетрін Хаас) Повна молекулярна орбітальна діаграма включає всі атомні орбіталі та молекулярні орбіталі, їх мітки симетрії та заповнення електронами.
Гомоядерні двоатомні молекули другого періоду
Другі елементи періоду простягаються від Лі до Ne. Валентні орбіталі - 2s і 2p. У своїх молекулярних орбітальних діаграмах невалентні орбіталі (1s в даному випадку) часто ігноруються в молекулярних орбітальних діаграмах.
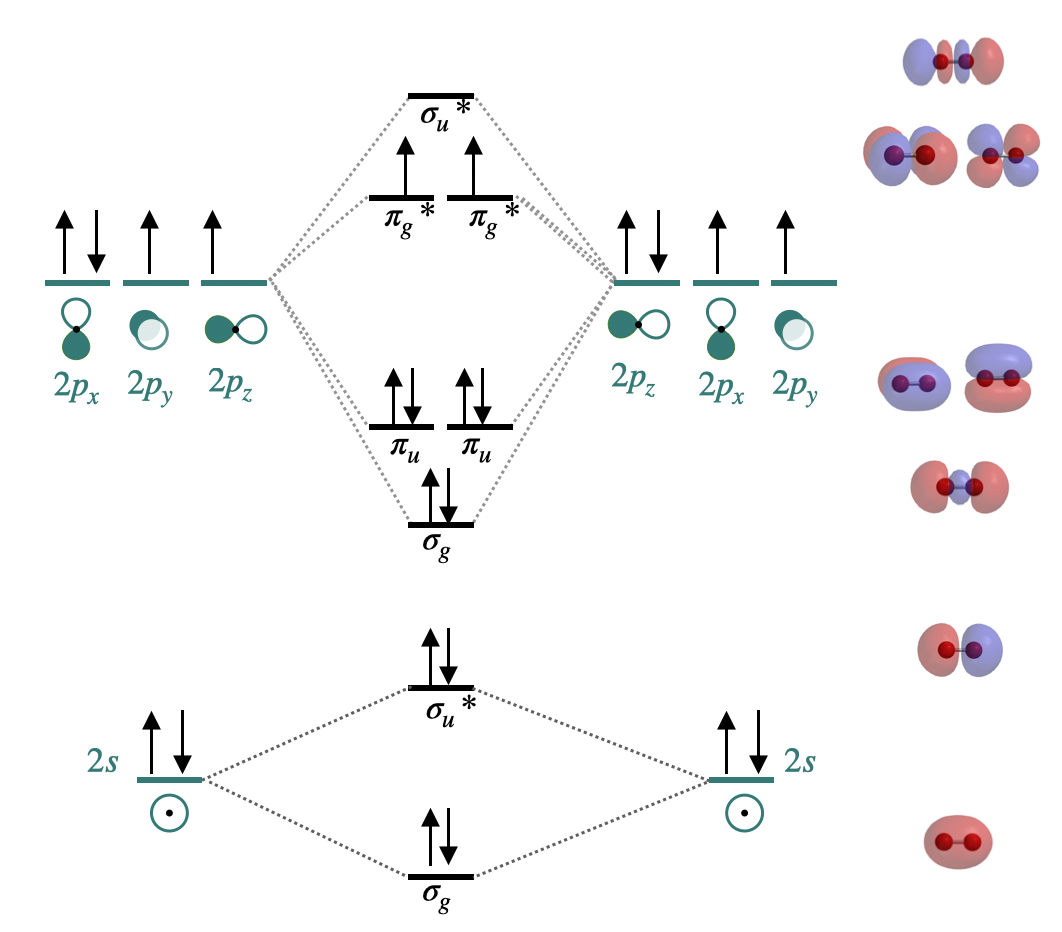
Орбітальне змішування має значні наслідки для магнітних і спектроскопічних властивостей гомоядерних двоатомних молекул другого періоду, оскільки воно впливає на порядок заповнення орбіталів\(\sigma_g(2p)\) та\(\pi_u(2p)\) орбіталів. На початку періоду 2 (аж до азоту включно)\(\pi_u(2p)\) орбіталі нижче за енергією, ніж\(\sigma_g(2p)\) (див\(\PageIndex{1})\). Рис. Однак пізніше в періоді 2\(\sigma_g(2p)\) орбіталі тягнуться до більш низької енергії. Це зниження енергії не\(\sigma_g(2p)\) є унікальним; всі\(\sigma\) орбіталі в молекулі тягнуться до зниження енергії за рахунок зростаючого позитивного заряду ядра. \(\pi\)Орбіталі в молекулі також уражаються, але в набагато меншій мірі, ніж\(\sigma\) орбіталі. Причина пов'язана з високим проникненням\(s\) атомних орбіталів порівняно з\(p\) атомними орбіталями (нагадаємо нашу попередню дискусію про проникнення та екранування та його вплив на періодичні тенденції). \(\sigma\)Молекулярні орбіталі мають більший\(s\) характер і, таким чином, на їх енергію більше впливає збільшення ядерного заряду. У міру збільшення ядерного заряду енергія\(\sigma_g(2p)\) орбіти знижується значно більше, ніж енергія\(\pi_u(2p)\) орбіталей (рис\(\PageIndex{1})\).
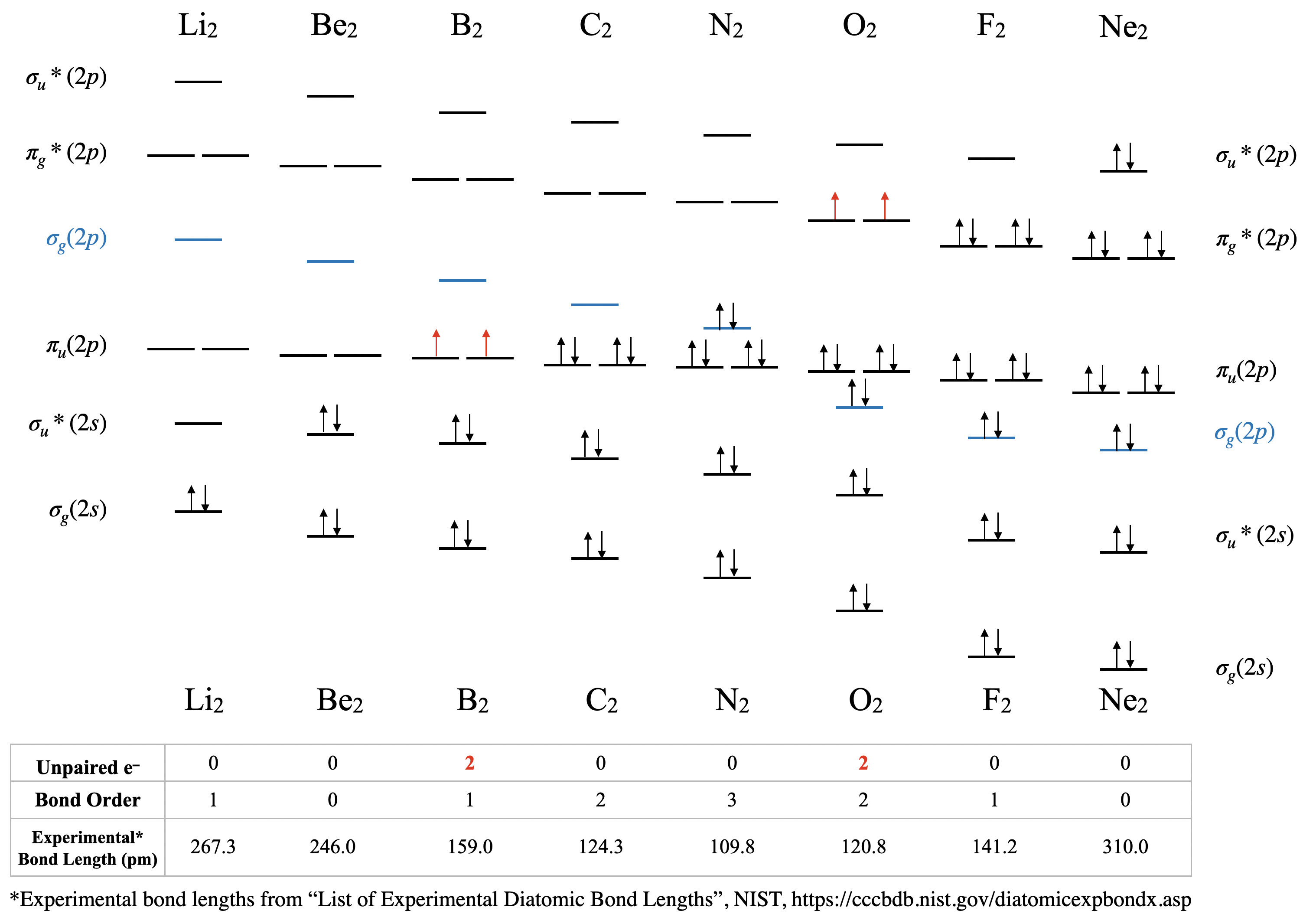
Дилітій, Li 2 \([\sigma_g^2(2s)]\): Ця молекула має порядок зв'язку один і спостерігається експериментально в газовій фазі, щоб мати один зв'язок Li-Li.
Диберилій, Be 2 \([\sigma_g^2\sigma_u^{*2}(2s)]\): Ця молекула має порядок зв'язку нуль завдяки рівній кількості електронів у зв'язкових та антизв'язуючих орбіталах. Хоча Be 2 не існує в звичайних умовах, його можна виготовити в лабораторії і виміряти довжину його зв'язку (рис.\(\PageIndex{2}\)). Хоча зв'язок дуже слабкий, його довжина зв'язку дивно звичайна для ковалентного зв'язку елементів другого періоду. 2
Дібор, B 2\([\sigma_g^2\sigma_u^{*2}(2s)\pi_u^1\pi_u^1(2p)]\): Випадок дибора - це той, який набагато краще описується молекулярною орбітальною теорією, ніж структурами Льюїса або теорією валентних зв'язків. Ця молекула має порядок зв'язку один. Молекулярний орбітальний опис дибора також точно прогнозує, що дибор є парамагнітним. Парамагнетизм є наслідком орбітального змішування, що призводить до того, що\(\sigma_g\) орбітальна знаходиться з більшою енергією, ніж дві вироджені\(\pi_u^*\) орбіталі.
Дикарбон, С 2\([\sigma_g^2\sigma_u^{*2}(2s)\pi_u^2\pi_u^2(2p)]\): Ця молекула має порядок зв'язку два. Молекулярна орбітальна теорія пророкує дві зв'язки з\(\pi\) симетрією, і без\(\sigma\) зв'язку. C 2 зустрічається рідко в природі, оскільки його аллотроп, алмаз, набагато стійкіший.
Азот, N 2\([\sigma_g^2\sigma_u^{*2}(2s)\pi_u^2\pi_u^2\sigma_g^2(2p)]\): Прогнозується, що ця молекула матиме потрійний зв'язок. Це передбачення узгоджується з його короткою довжиною зв'язку та енергією дисоціації зв'язку. Енергії\(\pi_u(2p)\) орбіталів\(\sigma_g(2p)\) і дуже близькі, і їх відносні енергетичні рівні були предметом деяких дискусій (див. Наступний розділ для обговорення).
Dioxygen, O 2\([\sigma_g^2\sigma_u^{*2}(2s)\sigma_g^2\pi_u^2\pi_u^2\pi_g^{*1}\pi_g^{*1}(2p)]\): Це ще один випадок, коли теорія валентних зв'язків не може передбачити фактичні властивості. Молекулярна орбітальна теорія правильно передбачає, що диоксиген є парамагнітним, з порядком зв'язку два. Тут молекулярна орбітальна діаграма повертається до свого «нормального» порядку орбіталів, де орбітальне змішування можна було б дещо ігнорувати, а де\(\sigma_g(2p)\) менше за енергією, ніж\(\pi_u(2p)\).
Дифтор, F 2\([\sigma_g^2\sigma_u^{*2}(2s)\sigma_g^2\pi_u^2\pi_u^2\pi_g^{*2}\pi_g^{*2}(2p)]\): Ця молекула має порядок зв'язку один і, як кисень,\(\sigma_g(2p)\) нижча за енергією, ніж\(\pi_u(2p)\).
Дінеон, Ne 2 \([\sigma_g^2\sigma_u^{*2}(2s)\sigma_g^2\pi_u^2\pi_u^2\pi_g^{*2}\pi_g^{*2}\sigma_u^{*2}(2p)]\): Як і інші благородні гази, Ne існує в атомній формі і не утворює зв'язків при звичайних температурах і тисках. Як і Be 2, Ne 2 є нестійким видом, який був створений в екстремальних лабораторних умовах, і його довжина зв'язку була виміряна (рис.\(\PageIndex{2}\))
Намалюйте повну молекулярну орбітальну діаграму для O 2. Покажіть розрахунок порядку зв'язку та скажіть, діамагнітний він чи парамагнітний.
- Відповідь
-
О 2 парамагнітний з порядком зв'язку 2. Його\(\sigma_g(2p)\) молекулярна орбіталь нижча за енергією, ніж набір\(\pi_{u}(2p)\) орбіталей.
Замовлення облігацій\(=\frac{1}{2}\left[\left(\begin{array}{c}\text { 8 electrons in} \\ \text { valence bonding orbitals }\end{array}\right)-\left(\begin{array}{c}\text {4 electrons in} \\ \text { valence antibonding orbitals }\end{array}\right)\right]\)
Малюнок для вправи\(\PageIndex{2}\). Молекулярна орбітальна діаграма O 2. (CC-BY-NC-SA, Кетрін Хаас)
Використовуйте якісну молекулярну орбітальну діаграму енергетичного рівня для прогнозування електронної конфігурації, порядку зв'язку та кількості непарних електронів у пероксидному іоні (O 2 2 −).
- Відповідь
-
Ця діаграма схожа на діаграму\(\ce{O2}\), за винятком того, що є два додаткових електрона.
\( \left ( \sigma _{g}(2s) \right )^{2}\left ( \sigma_u ^{\star }(2s) \right )^{2}\left ( \sigma _g(2p) \right )^{2}\left ( \pi _{u}(2p) \right )^{4}\left ( \pi _g(2p) \right )^{4} \); порядок зв'язку 1; немає непарних електронів.
Довжини зв'язку в одноядерних двоатомних молекулах
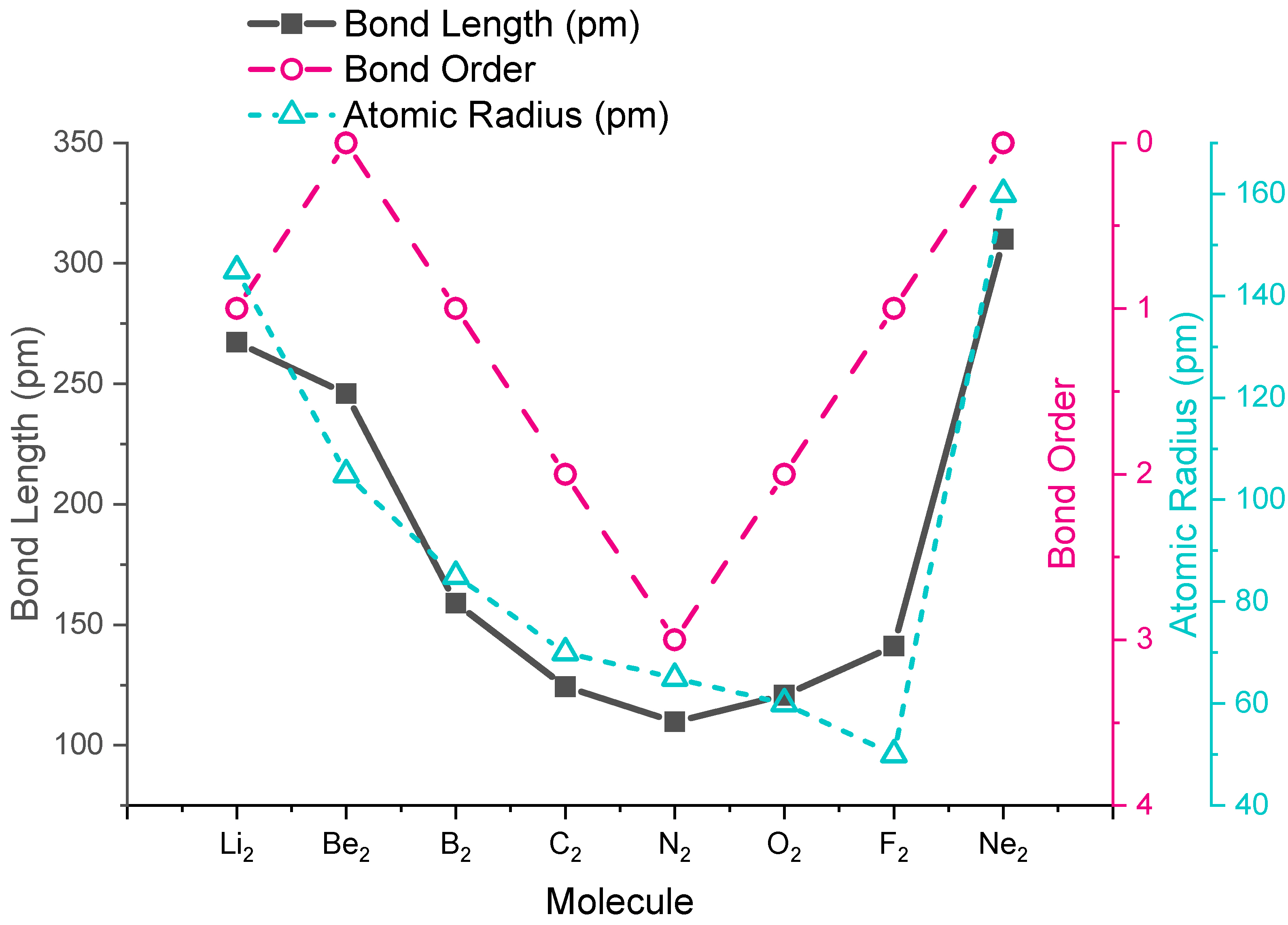
Тенденції довжини експериментальних зв'язків прогнозуються молекулярною орбітальною теорією, зокрема розрахунковим порядком зв'язків. Значення порядку зв'язку та довжин експериментальних зв'язків для двоатомних молекул другого періоду наведені на малюнку\(\PageIndex{1}\), і показані в графічному форматі на графіку на рисунку\(\PageIndex{2}\). З сюжету ми бачимо, що довжина зв'язку добре корелює з порядком зв'язку, при цьому мінімальна довжина зв'язку відбувається там, де порядок зв'язку є найбільшим (\(\ce{N2}\)). Найкоротша відстань\(\ce{N2}\) зв'язку через високий порядок зв'язку 3. Від\(\ce{N2}\) до\(\ce{F2}\) зв'язку відстань збільшується, незважаючи на те, що атомний радіус зменшується.
Посилання
- NIST, Розраховані геометрії доступні для H 2 + (катіон водню) 2σ G+D∞, доступний за адресою https://cccbdb.nist.gov/diatomicexpbondx.asp
- Мерріт, Дж. М.; Бондібей, В.Е.; Небеса, М., Берилій Димер - спійманий в акті зв'язку. Наука 2009, 324 (5934), 1548-1551.
