5.1.2: Молекулярні орбіталі з p орбіталів
- Page ID
- 32789
Склеювання з P-орбіталями
Склеювання сигми з p-орбіталями
Інші двоатомні молекули в правому верхньому куті таблиці Менделєєва можуть бути побудовані аналогічним чином. Подивіться на азот, N 2.
Ми можемо подумати про те, як би утворився азот, якби два атоми азоту були розміщені досить близько один до одного, щоб ділитися електронами. Азот має більше електронів, ніж водню, тому така взаємодія складніше.
У нашій якісній експертизі зв'язку в основній групі діатоміки ми візьмемо підхід, який використовується в структурах Льюїса, і просто подивимося на валентні електрони. Кількісний молекулярний орбітальний розрахунок за допомогою комп'ютера не приймав би цього ярлика, але включав би всі електрони в атомах, які зв'язуються між собою.
Азот має п'ять валентних електронів, і ці електрони знаходяться в рівнях 2s і 2p. Існує три можливі атомні орбіталі на рівні 2p, де можна знайти деякі з цих електронів: p x, p y та p z. Потрібно подивитися на взаємодію орбіталів s і p x, p y і p z на одному атомі азоту з орбіталями s і p x, p y і p z на іншому азоті. Цей процес може бути надзвичайно складним, але:
- Орбітальні взаємодії регулюються симетрією.
Орбіталі найбільш легко взаємодіють з іншими орбіталями, які мають той же елемент симетрії. Наразі ми можемо спростити і сказати, що орбіталі на одному атомі взаємодіють лише з однотипними орбіталями на іншому атомі.
- S орбіталі взаємодіють з s орбіталів. Ми вже можемо бачити, як це буде працювати в азоті, тому що саме це сталося в дигідрогені.
- p x орбіталі взаємодіють з p x орбіталями.
- р y орбіталі взаємодіють з p y орбіталями.
- p z орбіталі взаємодіють з p z орбіталями.
Іншим ускладненням тут є те, що орбіталі s і p не починаються на одному енергетичному рівні. Коли орбіталі змішуються, одна комбінація піднімається в енергії, а одна йде вниз. Чи є антизв'язуюча комбінація s йде вище за енергією, ніж комбінації з p орбіталів? Чи комбінації p зв'язування йдуть нижче за енергією, ніж комбінації з орбіталів s? Спростимо і припустимо, що рівні s і p залишаються повністю відокремленими один від одного. Це не завжди так, але ситуація змінюється в залежності від того, з якими атомами ми маємо справу.
- Поєднання однієї з орбітальних з іншою так само, як у водні. Дві оригінальні орбіталі об'єднають і переставляють, щоб створити дві нові орбіталі.
- Існує сполучна комбінація, при якій орбіталі знаходяться в фазі. Нова орбітальна вироблена має довшу довжину хвилі, ніж початкова орбітальна. Вона нижча за енергією.
- Існує антизв'язуюча комбінація, при якій орбіталі знаходяться поза фазою. Нова орбітальна вироблена має коротшу довжину хвилі, ніж початкова орбітальна. Вона вища за енергією.
Розглядаючи взаємодію двох p орбіталів, ми повинні мати на увазі, що p орбіталі є спрямованими. Орбіталь p лежить уздовж певної осі: x, y або z Три p орбіталі на азоті взаємно перпендикулярні (або ортогональні) один одному. Ця ситуація на відміну від s орбіталів, які є сферичними і, таким чином, виглядають однаково з будь-якого напрямку.
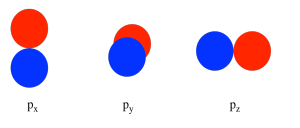
Спочатку нам потрібно визначити одну вісь як лежачу уздовж N-N зв'язку. Не має особливого значення, який саме. Ми довільно говоримо, що зв'язок N-N лежить уздовж осі z. Орбіталі p z мають різний просторовий зв'язок один з одним порівняно з p y та p x. Орбіталі p z лежать уздовж осі зв'язку, тоді як p y і p x ортогональні до неї.
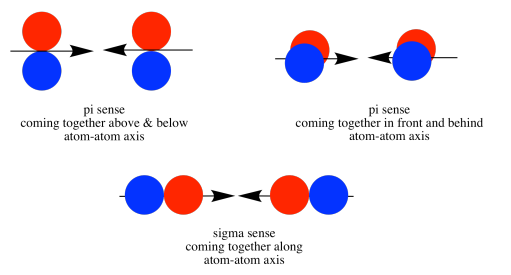
У міру зближення атомів азоту одна частка на одній p z орбіталі сильно перекривається однією часткою на іншій p z орбіталі. Інші частки вказують один від одного і не взаємодіють будь-яким очевидним чином.
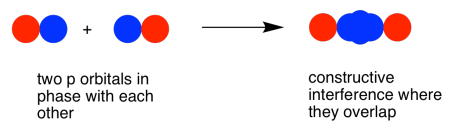
Як і в орбіталі s, орбіталі p z можуть бути в фазі або поза фазою. Поєднання фаз призводить до конструктивних перешкод. (Тут «в фазі» означає частки, які перекриваються, є фазовими; для цього дві орбіталі p фактично повністю поза фазою один з одним математично, так що одна орбітальна є дзеркальним відображенням іншої.) Ця комбінація знаходиться на більшій довжині хвилі, ніж початкова орбітальна. Це нижча енергетична комбінація.
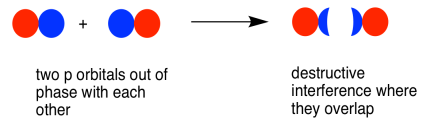
Позафазова комбінація (мається на увазі в цьому випадку, що перекриваються частки поза фазою) призводить до руйнівного втручання. Ця комбінація знаходиться на коротшій довжині хвилі, ніж початкова орбітальна. Це більш висока енергетична комбінація.
Як результат, ми маємо дві різні комбінації, що випливають з двох різних p орбіталів, що об'єднуються двома різними способами. Ми отримуємо низькоенергетичну, інфазову, зв'язуючу комбінацію та високоенергетичну, позафазову, антизв'язуючу комбінацію.
Як щодо тих інших p орбіталів, тих, які не лежать уздовж осі зв'язку? Ми розглянемо цю проблему на наступній сторінці.
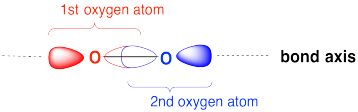
Намалюйте мультиплікацію МО орбіти, що зв'язує сигму, утворену перекриттям двох орбіталів p між двома атомами кисню. Позначте положення ядер кисню символом «О». Позначте вісь зв'язку O-O.
- Відповідь
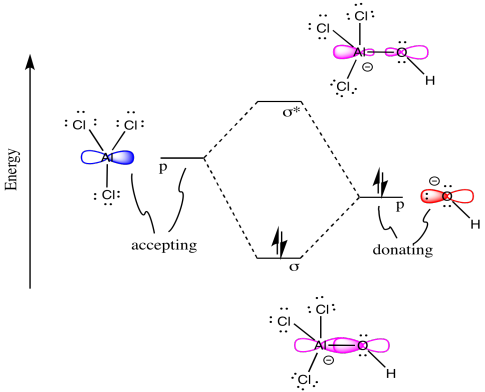
Хімічні реакції можуть бути описані діаграмами МО теж! Розглянемо наступну реакцію, при якій утворюється нова сигма-зв'язок.

Намалюйте схему МО для реакції вище. Іншими словами, почніть з одного прикордонного МО на кожному реагенті, щоб побудувати МО нової сигма-зв'язку в продукті.
o Намалюйте орбіту від основи (гідроксиду), яка, ймовірно, подарує свої електрони.
o Намалюйте орбіту з кислоти (хлориду алюмінію), яка, ймовірно, прийме електрони.
o Завершіть діаграму змішування MO цих двох орбіталей:
• Позначте електронну орбітальну
донорську • Позначте орбітальну електронну приймаючу
• Заповніть діаграму змішування МО електронами
o Намалюйте мультфільм, що показує кожен реагент і продукт МО, що сприяє взаємодії зв'язку.
- Відповідь
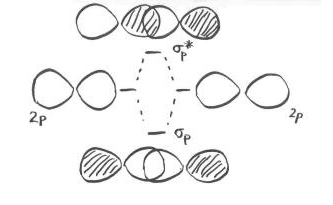
PI-зв'язування з p-орбіталями
Раніше ми бачили, що p орбіталі, які лежать уздовж однієї осі, можуть взаємодіяти, утворюючи зв'язки.
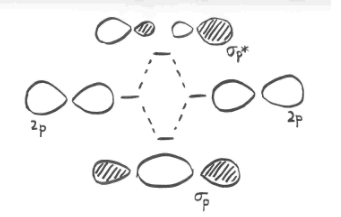
Паралельні, але не колінеарні, p орбіталі також можуть взаємодіяти один з одним. Вони наближалися б один до одного пліч-о-пліч, вище і нижче осі зв'язку між двома атомами. Вони можуть бути досить близько один до одного, щоб перекриватися, хоча і не перекриваються так сильно, як орбіталі, що лежать уздовж осі зв'язку. Вони можуть скласти однофазну комбінацію, як показано нижче.
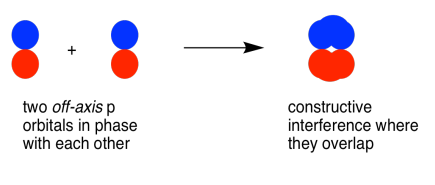
Вони також можуть скласти позафазову комбінацію, як показано нижче.
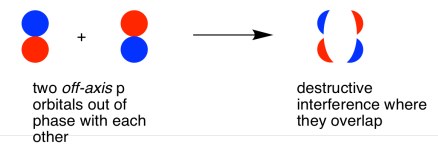
- паралельні p орбіталі можуть перекриватися для отримання сполучних і антизв'язуючих комбінацій.
- отримані орбіталі містять вузли уздовж осі зв'язку.
- електронна щільність знаходиться вище і нижче осі зв'язку.
- це називається p (pi) зв'язком.
Наведена вище ілюстрація для одного набору p орбіталів, які ортогональні осі зв'язку. Друга картинка показує результат конструктивного (або руйнівного) втручання. Аналогічна картина може бути показана для іншого набору p орбіталів.
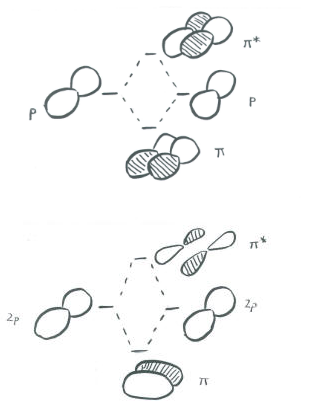
У основній групі двоатомних видів, таких як dinitrogen, одна орбітальна p, що лежить уздовж осі зв'язку, може брати участь у зв'язку. Дві орбіталі p, ортогональні осі зв'язку, можуть брати участь у склеюванні p. Будуть як склеювальні, так і антизв'язуючі комбінації.
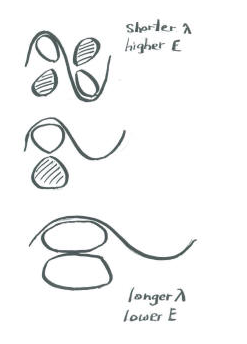
Подібно до того, як орбіталі, що зв'язують сигма, відображають поступово коротші довжини хвиль вздовж осі зв'язку, коли вони йдуть на більш високу енергію, так і орбіталі зв'язку пі. Іншими словами, на орбіталі з вищою енергією більше вузлів, ніж у нижчих енергетичних.
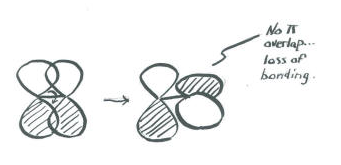
Важливим наслідком просторового розподілу або «форми» орбіти p є те, що вона не симетрична щодо осі зв'язку. На орбіталь s не впливає, коли атом на одному кінці зв'язку обертається щодо іншого. А р орбітальний впливає на таке обертання. Якщо один атом повернеться щодо іншого, орбітальний p повинен був би розтягнутися, щоб підтримувати зв'язок. Орбіталі не зможуть перекриватися, тому зв'язок між атомами буде втрачено.
Комбінації __________ атомних орбіталей призводить до σ орбіталей.
Малюємо картинки.
- Відповідь
-
Комбінації s + s АБО s + p АБО p + p АБО s + d АБО p + d атомних орбіталів можуть призвести до σ орбіталей.
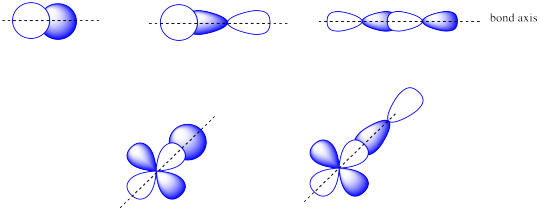
Комбінації __________ атомних орбіталей призводить до π орбіталей.
Малюємо картинки.
- Відповідь
-
Комбінації пліч-о-пліч p + p або p + d атомних орбіталей призводить до π орбіталей.

Яка молекулярна орбіталь, як правило, найвища за енергією?
а. р
б. σ
с. π*
d. π
е. σ*
- Відповідь
-
е) σ*
Чому б ядро 1s орбіталі не взаємодіяти з валентною 2s орбіталлю?
Підказка: Чому зв'язок Li 2 O міцніша за зв'язок K 2 O?
- Відповідь
-
Li + і O 2- більше схожі за розмірами, ніж K + і O 2-, тому зв'язок між Li + і O 2- міцніша.
Різниця в енергії між будь-якими основними орбіталями і валентними орбіталями занадто велика, тому вони не можуть взаємодіяти. Для того щоб орбіталі взаємодіяли, орбіталі повинні мати однакову симетрію, перебувати в одній площині і бути схожими за енергією.
Додайте кілька слів, щоб пояснити ідеї, передані на цих малюнках.
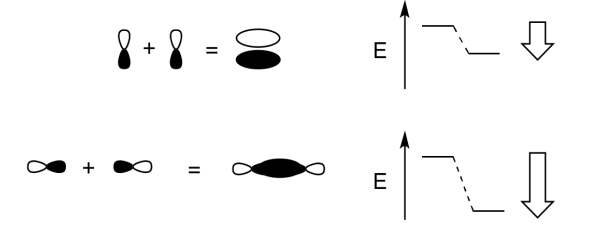
- Відповідь
-
Коли дві паралельні p орбіталі об'єднуються поза фазою, виникає деструктивна перешкода.
Між атомами є вузол.
Енергія електронів збільшується.
Коли дві паралельні p орбіталі об'єднуються в фазі, виникає конструктивна перешкода.
Між атомами немає вузла; електрони знаходяться вище і нижче осі, що з'єднує атоми.
Енергія електронів зменшується.