10.1: Міжмолекулярні сили
- Page ID
- 22497
- Опишіть типи міжмолекулярних сил, можливих між атомами або молекулами в конденсованих фазах (сили дисперсії, дипольно-дипольні атракціони та водневий зв'язок)
- Визначте типи міжмолекулярних сил, які відчувають конкретні молекули на основі їх структур
- Поясніть зв'язок між міжмолекулярними силами, присутніми всередині речовини, і температурами, пов'язаними зі змінами її фізичного стану
Як і у випадку з газоподібними речовинами, кінетична молекулярна теорія може бути використана для пояснення поведінки твердих тіл і рідин. У наступному описі термін частка буде використовуватися для позначення атома, молекули або іона. Зауважте, що ми будемо використовувати популярну фразу «міжмолекулярне тяжіння» для позначення сил привабливості між частинками речовини, незалежно від того, чи є ці частинки молекулами, атомами чи іонами.
Розглянемо ці два аспекти середовищ молекулярного рівня в твердій, рідкій та газоподібній речовині:
- Частинки в твердій речовині щільно упаковані разом і часто розташовані в регулярному порядку; в рідині вони знаходяться близько один від одного, без регулярного розташування; в газу вони знаходяться далеко один від одного, без регулярного розташування.
- Частинки в твердому тілі вібрують навколо фіксованих положень і, як правило, не рухаються по відношенню один до одного; в рідині вони рухаються повз один одного, але залишаються в основному постійному контакті; в газі вони рухаються незалежно один від одного, за винятком випадків зіткнення.
Відмінності у властивостях твердої речовини, рідини або газу відображають сили сили привабливих сил між атомами, молекулами або іонами, що складають кожну фазу. Фаза, в якій існує речовина, залежить від відносних масштабів її міжмолекулярних сил (IMF) та кінетичних енергій (КЕ) її молекул. IMF s - це різні сили тяжіння, які можуть існувати між атомами та молекулами речовини через електростатичні явища, як буде детально описано в цьому модулі. Ці сили служать для утримання частинок близько один до одного, тоді як KE частинок забезпечує енергію, необхідну для подолання сил привабливості і, таким чином, збільшення відстані між частинками. Малюнок\(\PageIndex{1}\) ілюструє, як зміни фізичного стану можуть бути викликані зміною температури, отже, середнього КЕ, даної речовини.
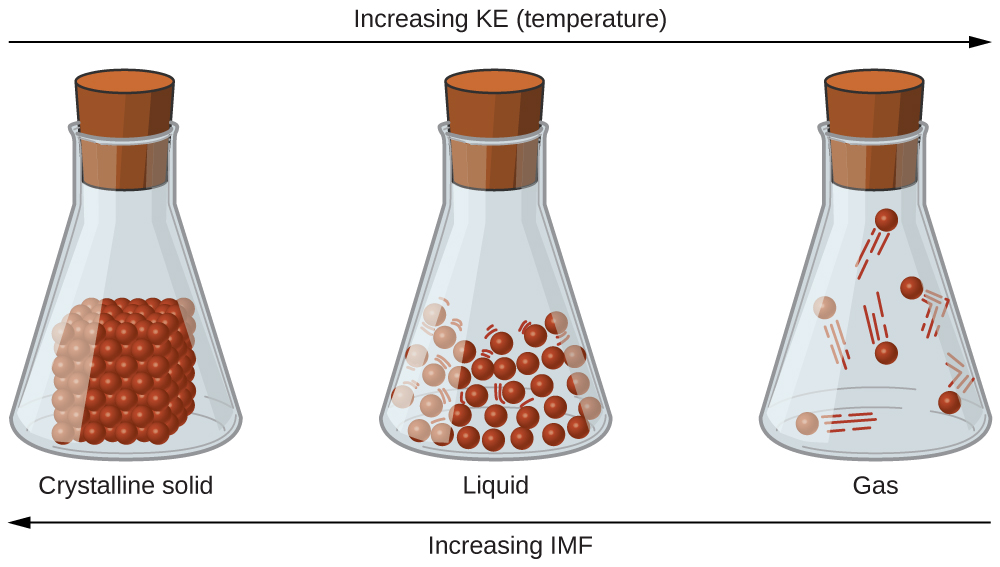
Як приклад процесів, зображених на цьому малюнку, розглянемо зразок води. При достатньому охолодженні газоподібної води атракціони між молекулами Н 2 О будуть здатні утримувати їх разом, коли вони стикаються один з одним; газ конденсується, утворюючи рідину Н 2 О. Наприклад, рідка вода утворюється на зовнішній стороні холодного скла як вода пар в повітрі охолоджується холодним склом, як видно на малюнку\(\PageIndex{2}\).

Ми також можемо розріджувати багато газів, стискаючи їх, якщо температура не надто висока. Підвищений тиск зближує молекули газу, таким чином, що атракціони між молекулами стають сильними щодо їх КЕ. Отже, вони утворюють рідини. Бутан, C 4 H 10, є паливом, що використовується в одноразових запальничках і є газом при стандартній температурі і тиску. Усередині паливного відсіку запальнички бутан стискається до тиску, що призводить до його конденсації до рідкого стану, як показано на малюнку\(\PageIndex{3}\).

Нарешті, якщо температура рідини стає досить низькою, або тиск на рідину стає досить високим, молекулам рідини більше не вистачає КЕ, щоб подолати МВФ між ними, і утворюється тверда речовина. Більш ретельне обговорення цих та інших змін стану, або фазових переходів, наведено в наступному модулі цієї глави.
Сили між молекулами
За відповідних умов атракціони між усіма молекулами газу призведуть до того, що вони утворюють рідини або тверді речовини. Це пов'язано з міжмолекулярними силами, а не внутрішньомолекулярними силами. Внутрішні молекулярні сили - це ті, що знаходяться всередині молекули, які утримують молекулу разом, наприклад, зв'язки між атомами. Між молекулярними силами є атракціони між молекулами, які визначають багато фізичних властивостей речовини. Малюнок\(\PageIndex{4}\) ілюструє ці різні молекулярні сили. Сильні сторони цих привабливих сил сильно різняться, хоча зазвичай IMF між малими молекулами слабкі порівняно з внутрішньомолекулярними силами, які зв'язують атоми разом всередині молекули. Наприклад, для подолання ІМФ в одному молі рідкого HCl і перетворення його в газоподібний HCl потрібно всього близько 17 кілоджоулів. Однак для розриву ковалентних зв'язків між атомами водню і хлору в одному молі HCl потрібно приблизно в 25 разів більше енергії — 430 кілоджоулів.
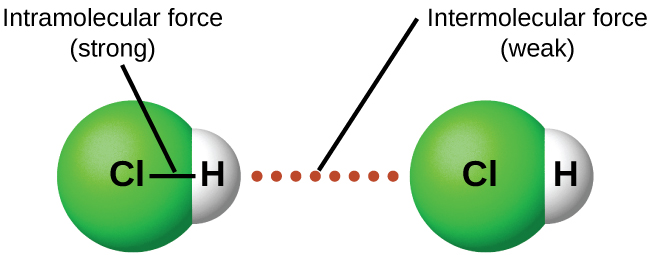
Всі сили привабливості між нейтральними атомами та молекулами відомі як сили ван дер Ваальса, хоча їх зазвичай називають більш неформально як міжмолекулярне тяжіння. Ми розглянемо різні типи IMF в наступних трьох розділах цього модуля.
Дисперсійні сили
Одна з трьох сил ван дер Ваальса присутня у всіх конденсованих фазах, незалежно від природи атомів або молекул, що складають речовину. Цю привабливу силу називають лондонською силою розсіювання на честь американського фізика німецького походження Фріца Лондона, який у 1928 році вперше пояснив це. Цю силу часто називають просто силою розсіювання. Оскільки електрони атома або молекули знаходяться в постійному русі (або, як варіант, розташування електрона піддається квантово-механічній мінливості), в будь-який момент часу атом або молекула можуть розвинути тимчасовий миттєвий диполь, якщо його електрони розподілені асиметрично. Наявність цього диполя може, в свою чергу, спотворити електрони сусіднього атома або молекули, виробляючи індукований диполь. Ці два швидко коливаються, тимчасові диполі, таким чином, призводять до відносно слабкого електростатичного тяжіння між видами - так званої сили дисперсії, як показано на малюнку\(\PageIndex{5}\).
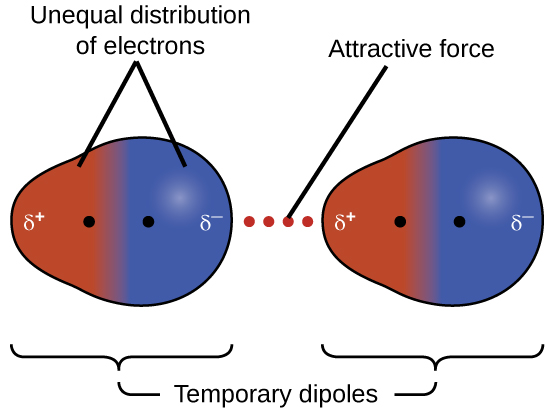
Сили дисперсії, що розвиваються між атомами в різних молекулах, можуть притягувати дві молекули один до одного. Однак сили відносно слабкі і стають значними лише тоді, коли молекули знаходяться дуже близько. Більші та важчі атоми та молекули виявляють сильніші сили дисперсії, ніж менші та легші атоми та молекули. F 2 і Cl 2 - гази кімнатної температури (відображають слабші сили притягання); Br 2 - рідина, а I 2 - тверда речовина (що відображає більш сильні сили тяжіння). Тенденції в спостережуваних температурах плавлення і кипіння галогенів наочно демонструють цей ефект, як видно в табл\(\PageIndex{1}\).
| Галогенні | Молярна маса | Атомний радіус | Точка плавлення | Точка кипіння |
|---|---|---|---|---|
| фтор, F 2 | 38 г/моль | 72 вечора | 53 КМ | 85 КМ |
| хлор, Cl 2 | 71 г/моль | 9 вечора | 172 КМ | 238 КМ |
| бром, Br 2 | 160 г/моль | 114 вечора | 266 КМ | 332 КМ |
| йод, I 2 | 254 г/моль | 133 вечора | 387 КМ | 457 КМ |
| астатин, В 2 | 420 г/моль | 150 вечора | 575 КМ | 610 КМ |
Збільшення температури плавлення та кипіння зі збільшенням атомного/молекулярного розміру може бути раціоналізовано, враховуючи, як на силу сил дисперсії впливає електронна структура атомів або молекул речовини. У більшому атомі валентні електрони знаходяться, в середньому, далі від ядер, ніж в меншому атомі. Таким чином, вони менш міцно утримуються і можуть легше утворювати тимчасові диполі, які виробляють тяжіння. Міра того, наскільки легко або важко інший електростатичний заряд (наприклад, сусідній іон або полярна молекула) спотворює розподіл заряду молекули (її електронна хмара), відома як поляризуваність. Молекула, яка має хмару заряду, яка легко спотворюється, вважається дуже поляризованою і матиме великі сили дисперсії; одна з хмарою заряду, яку важко спотворювати, не дуже поляризується і матиме малі сили дисперсії.
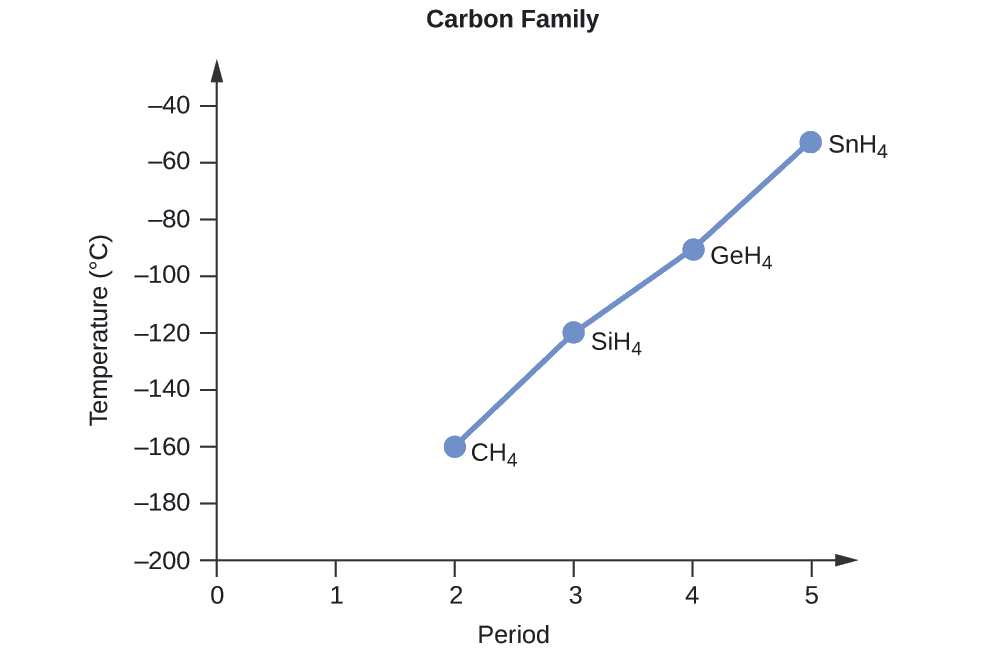
Замовте наступні сполуки елемента 14 групи та водню від найнижчої до найвищої температури кипіння: CH 4, SiH 4, GeH 4 та SnH 4. Поясніть свої міркування.
Рішення
Застосовуючи навички, набуті в розділі про хімічне зв'язування та молекулярну геометрію, всі ці сполуки прогнозуються як неполярні, тому вони можуть відчувати лише сили дисперсії: чим менше молекула, тим менше поляризуються і слабкіші сили дисперсії; чим більше молекула, тим більше сили розсіювання. Молярні маси СН 4, SiH 4, GeH 4 і SnH 4 складають приблизно 16 г/моль, 32 г/моль, 77 г/моль і 123 г/моль відповідно. Тому очікується, що CH 4 матиме найнижчу температуру кипіння, а SnH 4 - найвищу температуру кипіння. Очікується, що замовлення від найнижчої до найвищої температури кипіння буде
СН 4 < SiH 4 < ГеГ 4 < SnH 4
Графік фактичних температур кипіння цих сполук у порівнянні з періодом групи 14 елементів показує, що це прогноз є правильним:
Замовте наступні вуглеводні від найнижчої до найвищої температури кипіння: C 2 H 6, C 3 H 8, і C 4 H 10.
- Відповідь
-
Всі ці сполуки неполярні і мають лише лондонські сили дисперсії: чим більше молекула, тим більші сили дисперсії і тим вище температура кипіння. Тому замовлення від найнижчої до найвищої температури кипіння
С 2 Н 6 < С 3 Н 8 < С 4 Н 10.
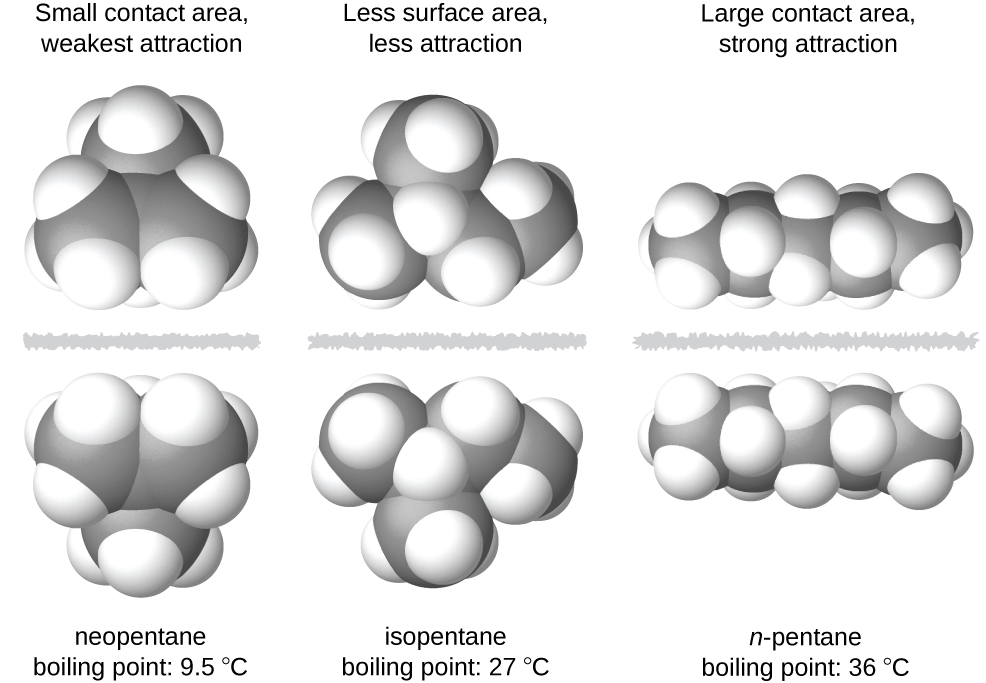
Форми молекул також впливають на величини сил дисперсії між ними. Наприклад, температури кипіння ізомерів n -пентану, ізопентану та неопентану (показані на малюнку\(\PageIndex{6}\)) складають 36° C, 27° C та 9.5° C відповідно. Незважаючи на те, що ці сполуки складаються з молекул з тією ж хімічною формулою, C 5 H 12, різниця в температурах кипіння говорить про те, що сили дисперсії в рідкій фазі різні, будучи найбільшими для n -пентану і найменше для неопентану. Подовжена форма n -пентану забезпечує більшу площу поверхні, доступну для контакту між молекулами, що призводить відповідно до більш сильних сил дисперсії. Більш компактна форма ізопентану пропонує меншу площу поверхні, доступну для міжмолекулярного контакту, і, отже, слабші сили дисперсії. Молекули неопентану є найбільш компактними з трьох, пропонуючи найменшу доступну площу поверхні для міжмолекулярного контакту і, отже, найслабші сили дисперсії. Така поведінка аналогічно з'єднанню, які можуть утворюватися між смугами застібок марки VELCRO: чим більше площа контакту смуги, тим міцніше з'єднання.
Гекони мають дивовижну здатність прилипати до більшості поверхонь. Вони можуть швидко розбігатися по гладких стінам і поперек стель, які не мають ніжок, і вони роблять це, не маючи присосок або липкої речовини на пальцях ніг. І хоча гекон може легко піднімати ноги, коли він ходить по поверхні, якщо ви намагаєтеся підняти його, він прилипає до поверхні. Як гекони (а також павуки і деякі інші комахи) здатні це зробити? Хоча це явище досліджувалося протягом сотень років, вчені лише нещодавно розкрили деталі процесу, який дозволяє ногам геконосів вести себе таким чином.

Пальці ніг Геккоса покриті сотнями тисяч крихітних волосків, відомих як щетинки, причому кожен набір, в свою чергу, розгалужується на сотні крихітних, плоских, трикутних кінчиків, званих шпателями. Величезна кількість шпателей на його щетинках забезпечують гекон, показаний на малюнку\(\PageIndex{7}\), з великою загальною площею поверхні для прилипання до поверхні. У 2000 році Келлар Осінь, який очолює багатоінституційну дослідницьку групу геконів, виявив, що гекони однаково добре дотримувалися як полярного діоксиду кремнію, так і неполярного арсеніду галію. Це довело, що гекони прилипають до поверхонь через сили дисперсії — слабкі міжмолекулярні атракціони, що виникають внаслідок тимчасових синхронізованих розподілів зарядів між сусідніми молекулами. Хоча сили розсіювання дуже слабкі, загальна привабливість понад мільйони шпателей досить велика, щоб підтримувати багато разів вагу гекон.
У 2014 році двоє вчених розробили модель, щоб пояснити, як гекони можуть швидко переходити від «липкого» до «нелипкого». Алекс Гріні та Конгконг Ху з Університету штату Орегон описали, як гекони можуть досягти цього, змінюючи кут між шпателями та поверхнею. Ноги Геккоса, які зазвичай не липкі, стають липкими, коли застосовується невелика сила зсуву. Завиваючи і розкручуючи пальці ніг, гекони можуть чергувати прилипання і відклеювання від поверхні, і, таким чином, легко переміщатися по ній. Подальші дослідження можуть врешті-решт призвести до розробки кращих клеїв та інших застосувань.
Перегляньте це відео, щоб дізнатися більше про дослідження Келлара Осінь, яке визначило, що сили ван дер Ваальса відповідають за здатність гекон чіплятися і підніматися.
Диполь-дипольні пам'ятки
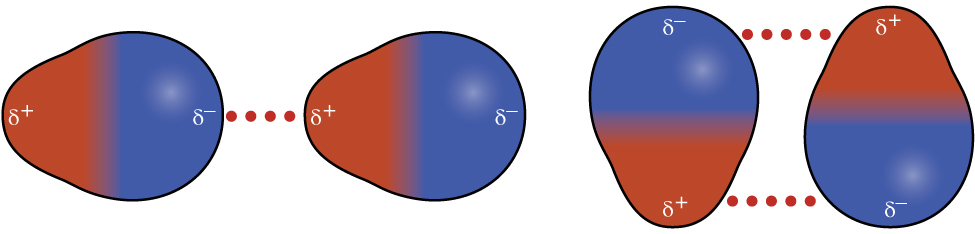
Нагадаємо з глави про хімічний зв'язок і молекулярної геометрії, що полярні молекули мають частковий позитивний заряд з одного боку і частковий негативний заряд з іншого боку молекули - поділ заряду, який називається диполем. Розглянемо полярну молекулу, таку як хлористий водень, HCl. У молекулі HCl більш електронегативний атом Cl несе частковий негативний заряд, тоді як менш електронегативний атом Н несе частковий позитивний заряд. Приваблива сила між молекулами HCl виникає внаслідок тяжіння між позитивним кінцем однієї молекули HCl та негативним кінцем іншої. Ця сила привабливості називається дипольно-дипольним притяганням - електростатичною силою між частково позитивним кінцем однієї полярної молекули та частково негативним кінцем іншої, як показано на малюнку\(\PageIndex{8}\).
Ефект дипольно-дипольного тяжіння очевидний, коли ми порівнюємо властивості молекул HCl з неполярними молекулами F 2. І HCl, і F 2 складаються з однакової кількості атомів і мають приблизно однакову молекулярну масу. При температурі 150 К молекули обох речовин мали б однакове середнє KE. Однак дипольно-дипольних атракціонів між молекулами HCl достатньо, щоб змусити їх «склеюватися», утворюючи рідину, тоді як відносно слабкі сили дисперсії між неполярними молекулами F 2 не є, і тому ця речовина газоподібна при цій температурі. Вища нормальна температура кипіння HCl (188 K) порівняно з F 2 (85 K) є відображенням більшої сили дипольно-дипольних атракціонів між молекулами HCl, порівняно з атракціонами між неполярними молекулами F 2. Ми часто будемо використовувати такі значення, як кипіння або точки замерзання, або ентальпії випаровування або плавлення, як показники відносної сили IMF тяжіння, присутніх всередині різних речовин.
Передбачте, яка буде мати більш високу температуру кипіння: N 2 або CO. Поясніть свої міркування.
Рішення
CO і N 2 є двоатомними молекулами з масою близько 28 ам, тому вони відчувають подібні лондонські сили дисперсії. Оскільки СО є полярною молекулою, вона відчуває дипольно-дипольні атракціони. Оскільки N 2 неполярний, його молекули не можуть демонструвати дипольно-дипольні атракціони. Дипольно-дипольні атракціони між молекулами СО порівняно сильніші, ніж сили дисперсії між неполярними молекулами N 2, тому CO, як очікується, матиме вищу температуру кипіння.
Поширеним методом приготування кисню є розкладання.
Передбачте, яка буде мати більш високу температуру кипіння:\(\ce{ICl}\) або\(\ce{Br2}\). Поясніть свої міркування.
- Відповідь
-
iCl. iCl і Br 2 мають подібні маси (~ 160 аму) і тому відчувають подібні лондонські сили розсіювання. iCl є полярним і, таким чином, також демонструє дипольно-дипольні атракціони; Br 2 неполярний і не має. Відносно сильніші дипольно-дипольні атракціони вимагають більше енергії для подолання, тому iCl матиме вищу температуру кипіння.
водневе склеювання
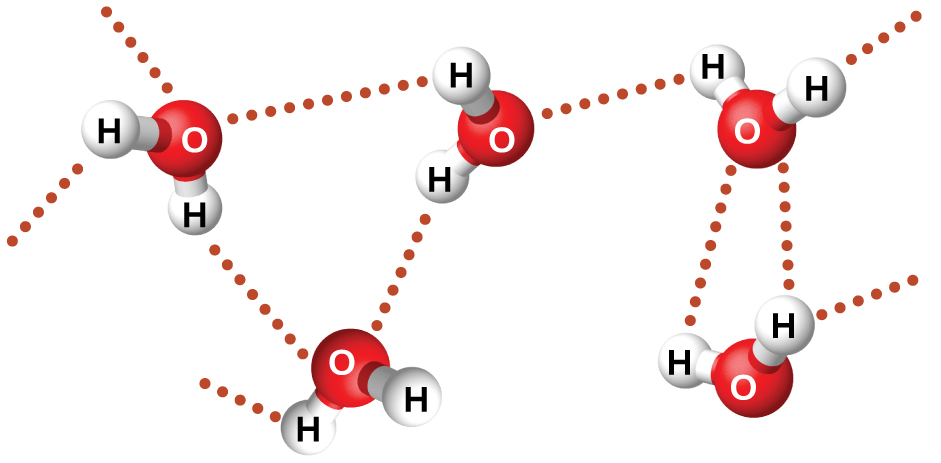
Нітрозилфторид (ОНФ, молекулярна маса 49 аму) являє собою газ кімнатної температури. Вода (H 2 O, молекулярна маса 18 аму) являє собою рідину, навіть незважаючи на те, що вона має більш низьку молекулярну масу. Ми явно не можемо віднести цю різницю між двома сполуками до сил дисперсії. Обидві молекули мають приблизно однакову форму, а ОНФ - важча і більша молекула. Тому очікується, що він відчує більш значні сили розсіювання. Крім того, ми не можемо віднести цю різницю в точках кипіння до відмінностей у дипольних моментах молекул. Обидві молекули полярні і демонструють порівнянні дипольні моменти. Велика різниця між точками кипіння обумовлена особливо сильним дипольно-дипольним атракціоном, яке може виникнути, коли молекула містить атом водню, пов'язаний з атомом фтору, кисню або азоту (трьома найбільш електронегативними елементами). Дуже велика різниця в електронегативності між атомом H (2.1) і атомом, з яким він пов'язаний (4,0 для атома F, 3,5 для атома O або 3,0 для атома N), поєднана з дуже малим розміром атома H і відносно малими розмірами атомів F, O або N, призводить до висококонцентрованої часткової заряди з цими атомами. Молекули з фрагментами F-H, O-H або N-H дуже сильно приваблюють подібні фрагменти в сусідніх молекулах, особливо сильний тип дипольно-дипольного тяжіння, який називається водневим зв'язком. Приклади водневих зв'язків включають HF HF, H 2 OHOH і H 3 NHNH 2, в яких водневі зв'язки позначаються точками. Малюнок\(\PageIndex{9}\) ілюструє водневий зв'язок між молекулами води.
Незважаючи на використання слова «зв'язок», майте на увазі, що водневі зв'язки - це міжмолекулярні сили привабливості, а не внутрішньомолекулярні сили притягання (ковалентні зв'язки). Водневі зв'язки набагато слабкіші, ніж ковалентні зв'язки, лише приблизно від 5 до 10% міцні, але, як правило, набагато сильніші, ніж інші дипольно-дипольні атракціони та сили дисперсії.
Водневі зв'язки надають виражений вплив на властивості конденсованих фаз (рідин і твердих речовин). Наприклад, розглянемо тенденції в точках кипіння для бінарних гідридів групи 15 (NH 3, PH 3, AsH 3 та SbH 3), гідридів групи 16 (H 2 O, H 2 S, H 2 Se та H 2 Te) та гідридів групи 17 (HF, HCl, HBr та ПРИВІТ). Точки кипіння найважчих трьох гідридів для кожної групи побудовані на малюнку\(\PageIndex{10}\). У міру просування будь-якої з цих груп полярності молекул дещо зменшуються, тоді як розміри молекул значно збільшуються. Ефект все більш сильних сил дисперсії домінує над тим, що все більш слабкі диполь-дипольні атракціони, і температура кипіння спостерігається неухильно зростати. Для гідридів групи 15, 16 і 17 температури кипіння для кожного класу сполук збільшуються зі збільшенням молекулярної маси для елементів в періоди 3, 4 і 5.
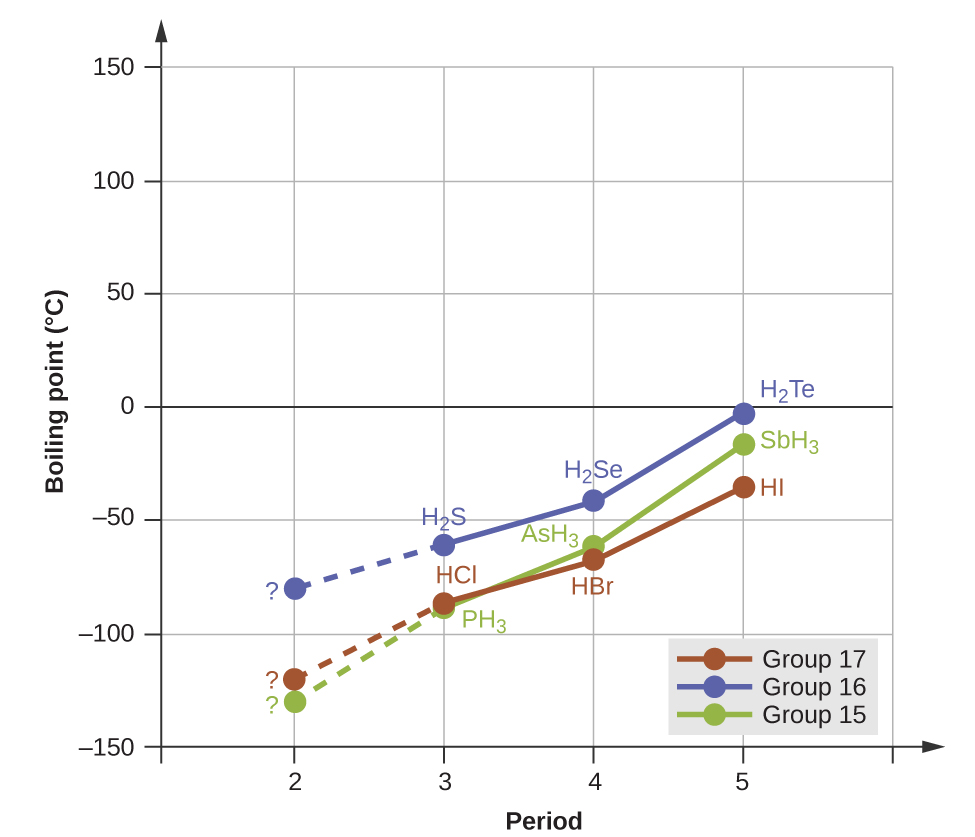
Якщо ми використаємо цю тенденцію для прогнозування температури кипіння для найлегшого гідриду для кожної групи, ми очікуємо, що NH 3 закипить приблизно при −120° C, H 2 O - при температурі близько −80° C, а HF - при температурі −110° C Однак, коли ми вимірюємо точки кипіння цих сполук, ми виявляємо, що вони різко вище, ніж передбачали б тенденції, як показано на малюнку\(\PageIndex{10}\). Суворий контраст між нашими наївними прогнозами та реальністю дає переконливі докази міцності водневого зв'язку.
Розглянемо сполуки диметилеефіру (СН 3 ОСН 3), етанолу (СН 3 СН 2 ОН) і пропану (СН 3 СН 2 СН 3). Їх температури кипіння, не обов'язково в порядку, складають −42,1° C, −24,8° C і 78,4° C. Поясніть свої міркування.
Рішення
Прогнозовані Всепр-форми СН 3 ОСН 3, СН 3 СН 2 ОН і СН 3 СН 2 СН 3 схожі, як і їх молярні маси (46 г/моль, 46 г/моль і 44 г/моль відповідно), тому вони будуть проявляти подібні сили дисперсії. Оскільки СН 3 СН 2 СН 3 є неполярним, він може проявляти лише сили розсіювання. Оскільки CH 3 OCH 3 є полярним, він також відчує дипольно-дипольні атракціони. Нарешті, CH 3 CH 2 OH має групу −OH, і тому він відчує унікальне сильне дипольно-дипольне притягання, відоме як водневе з'єднання. Отже, впорядкування з точки зору міцності ІМФ і, отже, температури кипіння, становить СН 3 СН 2 СН 3 < СН 3 ОЧ 3 < СН 3 СН 2 ОН. Температура кипіння пропану становить -42,1° C, температура кипіння диметилеефіру - −24,8° C, а температура кипіння етанолу - 78,5° C.
Етан (CH 3 CH 3) має температуру плавлення −183 °C і температуру кипіння −89 °С, прогнозують температуру плавлення та кипіння метиламіну (CH 3 NH 2). Поясніть свої міркування.
- Відповідь
-
Прогнозується, що температура плавлення та температура кипіння метиламіну будуть значно більшими, ніж температура плавлення етану. CH 3 CH 3 і CH 3 NH 2 схожі за розміром і масою, але метиламін має групу −NH і тому може проявляти водневий зв'язок. Це значно збільшує його IMF, а отже, і температури плавлення і кипіння. Важко передбачити значення, але відомі значення - температура плавлення −93° C і температура кипіння −6° C.
Водневий зв'язок і ДНК
Дезоксирибонуклеїнова кислота (ДНК) міститься в кожному живому організмі і містить генетичну інформацію, яка визначає особливості організму, забезпечує план виготовлення білків, необхідних для життя, і служить шаблоном для передачі цієї інформації потомству організму. Молекула ДНК складається з двох (анти-) паралельних ланцюгів повторюваних нуклеотидів, які утворюють її добре відому подвійну спіральну структуру, як показано на малюнку\(\PageIndex{10}\).
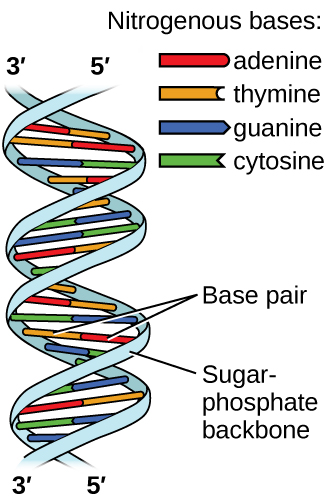
Кожен нуклеотид містить (дезоксирибозу) цукор, пов'язаний з фосфатною групою з одного боку, і один з чотирьох азотистих підстав з іншого. Дві основи, цитозин (С) і тимін (Т), є однокільцевими структурами, відомими як піримідини. Інші два, аденін (А) і гуанін (G), є двокільцевими структурами, які називаються пуринами. Ці основи утворюють комплементарні пари основ, що складаються з одного пурину і одного піримідину, з аденіном спаровування з тиміном, і цитозин з гуаніном. Кожна базова пара скріплюється водневим зв'язком. А і Т поділяють дві водневі зв'язки, C і G поділяють три, і обидві пари мають аналогічну форму і структуру (рис.\(\PageIndex{12}\)
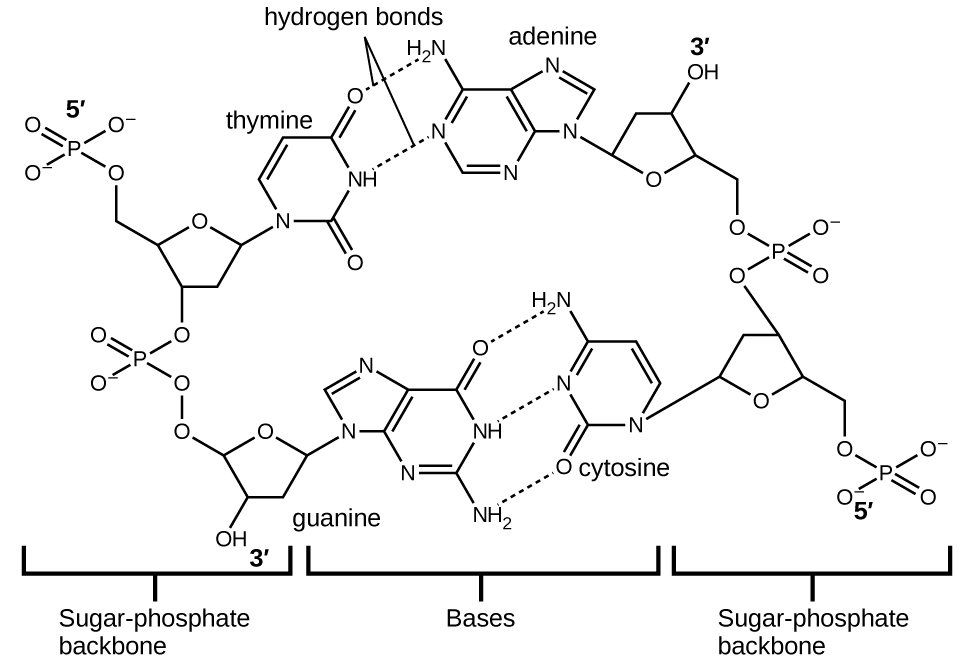
Сукупний ефект мільйонів водневих зв'язків ефективно утримує дві нитки ДНК разом. Важливо, що дві нитки ДНК можуть відносно легко «розпакувати» вниз по середині, оскільки водневі зв'язки відносно слабкі порівняно з ковалентними зв'язками, які утримують атоми окремих молекул ДНК разом. Це дозволяє обом пасмам функціонувати як шаблон для реплікації.
Резюме
Фізичні властивості конденсованого середовища (рідин і твердих речовин) можна пояснити з точки зору кінетичної молекулярної теорії. У рідині міжмолекулярні сили притягання утримують молекули в контакті, хоча вони все ще мають достатню кінетичну енергію, щоб рухатися повз один одного. Міжмолекулярні сили притягання, в сукупності іменовані силами ван дер Ваальса, відповідають за поведінку рідин і твердих тіл і мають електростатичну природу. Диполь-дипольні атракціони є результатом електростатичного тяжіння часткового негативного кінця однієї диполярної молекули для часткового позитивного кінця іншої. Тимчасовий диполь, що виникає в результаті руху електронів в атомі, може викликати диполь у сусідньому атомі і породжувати лондонську силу дисперсії. Лондонські сили збільшуються зі збільшенням молекулярних розмірів. Водневі зв'язки - це особливий тип дипольно-дипольного тяжіння, який виникає, коли водень пов'язаний з одним з трьох найбільш електронегативних елементів: F, O або N.
Глосарій
- диполь-дипольний атракціон
- міжмолекулярне тяжіння між двома постійними диполями
- сила дисперсії
- (також, Лондонська сила дисперсії) тяжіння між двома швидко коливаються тимчасовими диполями; значне лише тоді, коли частинки знаходяться дуже близько один до одного
- водневий зв'язок
- виникає, коли притягуються виключно сильні диполі; зв'язок, який існує, коли водень пов'язаний з одним з трьох найбільш електронегативних елементів: F, O або N
- індукований диполь
- тимчасовий диполь, що утворюється, коли електрони атома або молекули спотворюються миттєвим диполем сусіднього атома або молекули
- миттєвий диполь
- тимчасовий диполь, який виникає на короткий момент часу, коли електрони атома або молекули розподіляються асиметрично
- міжмолекулярна сила
- нековалентна сила притягання між атомами, молекулами та/або іонами
- поляризуваність
- міра здатності заряду спотворювати розподіл заряду молекули (електронна хмара)
- ван дер Ваальса сили
- приваблива або відштовхуюча сила між молекулами, включаючи диполь-диполь, диполь-індукований диполь та лондонські сили дисперсії; не включає сили, обумовлені ковалентним або іонним зв'язком, або тяжіння між іонами та молекулами
