1.2: Хімічне склеювання
- Page ID
- 27805
Електронні конфігурації елементів, як зазначено в попередньому розділі, застосовуються в принципі тільки до ізольованим атомам - атомам, розділеним відстанями, на яких не може відбуватися взаємна взаємодія їх електронних орбіталей (нескінченна відстань). Ця умова ніколи не виконується в конденсованих фазах (тобто рідин і твердих тіл); вона зустрічається лише у високій вакуумі, де атоми рухаються на великі відстані без взаємної взаємодії. У нормальних умовах, особливо у згаданих конденсованих фазах, атоми відокремлюються на відстані, контрольовані, по суті, розмірністю відповідних зовнішніх займаних електронних орбіталей. Всякий раз, коли зовнішні електронні оболонки двох і більше атомів стикаються один з одним (перекриваються в будь-якій мірі), потенціал взаємодії (реакції) існує. Спонтанна реакція (що складається з перестановки електронних орбіталей та/або фактичного перенесення електронів від одного атома до іншого) буде відбуватися всякий раз, коли така перестановка призводить до меншої енергетичної конфігурації. Це означає, що рушійна сила взаємної взаємодії і перестановки електронних конфігурацій в більшості випадків (але не завжди) проявляється через виділення тепла (форми енергії) в навколишнє середовище. [Типовий випадок:\(\mathrm{Mg}+1 / 2 \mathrm{O}_{2} \rightarrow\) реакція продукту\((\mathrm{MgO})+(\) світло+тепло), тобто енергія.] Оскільки однакова кількість енергії повинна подаватися в систему, якщо початковий стан - тобто відділення виду - має бути відновлено, партнери по реакції «пов'язані між собою» порівнянними енергіями. «Міцність» зв'язків може, очевидно, змінюватися від системи до системи з характером електронної перестановки.
Навіть інертні гази, особливо важчі, такі як ксенон, здатні утворювати асоціації з іншими атомами. Іноді ми виявляємо, що два атоми припускають більш стабільний стан, ділячись електронами; в інший час атом може передавати електрони іншому атому, щоб досягти більшої стабільності. В інших випадках перестановка може бути просто орбітальним спотворенням або внутрішнім перерозподілом заряду. У будь-якому випадку взаємна вигода, яка нараховується, - це формування того, що прийнято називати хімічним зв'язком. За допомогою цих зв'язків атоми об'єднуються між собою, утворюючи дуже різні види частинок, які називаються молекулами та іонами.
ХАРАКТЕР ХІМІЧНИХ ЗВ'ЯЗКІВ
Для того, щоб хімічний зв'язок утворився між двома атомами, має відбутися чисте зменшення енергії системи (двох атомів): іони або молекули, що утворюються електронними перебудовами, повинні знаходитися в нижчому енергетичному стані, ніж атоми були до взаємодії, до утворення зв'язку.
Оскільки атоми кожного з елементів мають різну електронну структуру, то різноманітність можливих хімічних зв'язків (відрізняються один від одного хоч якимось дрібним чином) значне і ще більше посилюється впливом сусідніх атомів на розглянуту зв'язок. Режими формування зв'язків можна розділити на два основних типи, кожен з яких представляє тип склеювання. Типи склеювання називаються електровалентним (або іонним) зв'язком і ковалентним зв'язком. Електровалентний зв'язок виникає внаслідок повного перенесення одного або декількох електронів від одного атома до іншого; ковалентний зв'язок виникає внаслідок спільного використання двох і більше електронів між атомами. Оскільки ці моделі представляють обмежувальні випадки, ми можемо передбачити, що більшість реальних зв'язків потраплять між цими двома крайнощами. (Два додаткових типи склеювання, металеве склеювання і склеювання Ван дер Ваальса, будуть розглянуті далі.)
Перш ніж детально обговорювати ці моделі, доречно розглянути взаємозв'язки між електронними структурами атомів і їх хімічною реакційною здатністю. Інертні гази (група VIII) є найбільш стійкими елементами щодо формування зв'язків, тобто до електронних перестановок. Тому корисно вивчити причини їх стійкості. Всі інертні гази мають електронні структури, що складаються з заповнених підоболонок. Для всіх, крім гелію, зовнішня (або валентна) оболонка містить вісім електронів, з заповненими\(s\) і\(p\) підрівнями\(\left(n s^{2} p^{6}\right)\). Електронна структура гелію є\(1 s^{2}\), що еквівалентно структурі інших інертних газів, оскільки немає\(1 \mathrm{p}\) підрівня. Інертні гази мають високі енергії іонізації, оскільки кожен електрон в підрівні вищої енергії погано екранований від ядра іншими електронами на своєму ж підрівні. Кожен електрон «бачить» відносно високий позитивний заряд на ядрі, і для його видалення з атома потрібно велика кількість енергії. Інертні гази мають дуже низьку спорідненість електронів, оскільки будь-який доданий електрон повинен увійти на значно вищий рівень енергії. Отже, ми виявляємо, що електронні структури інертних газів особливо стійкі до змін втратою або посиленням електронів і, крім того, що атоми інших елементів з меншою або більшою кількістю електронів, ніж конфігурація інертного газу, мають тенденцію отримувати або втрачати електрони відповідно для досягнення такого інертного газу структура.
ЕЛЕКТРОВАЛЕНТНОГО (ІОННОГО) ЗВ'ЯЗКУ
Електровалентний зв'язок утворюється шляхом перенесення одного або декількох електронів від одного атома до іншого. Розглянемо перші атоми, які мають електронні структури, що відрізняються від структури інертного газу лише на кілька, (1, 2 або 3) електронів. До них відносяться представницькі елементи груп I, II і III в Періодичній таблиці, які мають відповідно на 1, 2 і 3 електронів більше, ніж сусідній інертний газ, і представницькі елементи груп V, VI і VII, які мають відповідно 3, 2 і 1 електронів менше, ніж сусідній інертний газ (рис.1).

Рис.1 Стабільні та нестабільні конфігурації оболонки валентності.
Елементи I, II і III груп можуть формувати електронну структуру інертного газу, втрачаючи свої зовнішні 1, 2 і 3 (валентні) електрони. (Отримані види є позитивно зарядженими іонами.)
У подібному електронному переносі, який, однак, передбачає придбання електронів у зовнішніх валентних рівнях, елементи груп V, VI і VII утворюють електронну структуру інертного газу (шляхом утворення негативно заряджених іонів).
Саме через перенесення електронів між елементом втрати електронів та елементом, що набирає електрони, утворюються сполуки, які включають електростатичне тяжіння (електровалентні зв'язки) протилежно заряджених видів, які називаються іонами.
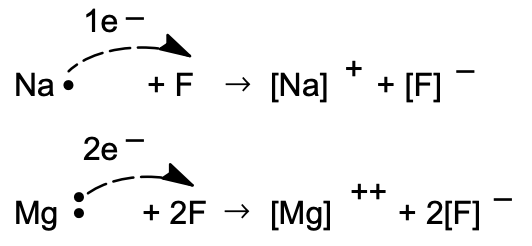
(У позначенні [Na•] точка вказує на зовнішній електрон, який перевищує конфігурацію рідкісного газу. Його називають валентним електроном.)
Елементи, що прямують за інертними газами (в горизонтальних колонках Періодичної таблиці) втрачають електрони, а ті, що безпосередньо передують інертним газам, отримують електрони при взаємодії. Отримані сполуки називаються електровалентними; валентне число (заряд на іоні) конкретного елемента, коли він утворює електровалентне з'єднання, задається кількістю електронів, втрачених або отриманих при переході від атомного до іонного стану.
Стехіометрична формула електровалентного з'єднання відображає відношення (зазвичай дуже просте) позитивних до негативних іонів, що дає нейтральний агрегат. Отже, іони\(\mathrm{Na}^{+}\) і\(\mathrm{F}^{-}\) утворюють з'єднання, формула якого полягає в\(\mathrm{NaF}\) тому, що ці іони поодиноко заряджені і присутні в з'єднанні в співвідношенні один до одного. Нітрид магнію, що складається з\(\mathrm{Mg}^{2+}\) і\(\mathrm{N}^{3-}\), має формулу,\(\mathrm{Mg}_{3} \mathrm{~N}_{2}\) оскільки цей склад являє собою електронейтральність.
Електровалентний зв'язок є результатом електростатичного тяжіння між іонами протилежного заряду. Ця приваблива сила пояснює стабільність цих сполук, характерних для\(\mathrm{NaF}, \mathrm{LiCl}, \mathrm{CaO}\), і\(\mathrm{KCl}\). Іони індивідуально володіють електронними структурами сусідніх інертних газів; їх залишковий заряд виникає внаслідок дисбалансу кількості електронів і протонів в їх структурах. Ізольовані іони і прості ізольовані пари іонів, як представлено формулою\(\mathrm{NaCl}\), існують тільки в газоподібному стані. Їх електростатичні сили активні у всіх напрямках; вони притягують протилежно заряджені види і, таким чином, можуть утворювати правильні масиви, в результаті чого утворюються впорядковані гратчасті структури, тобто твердого стану (рис.2). Навіть у рідкому стані та в розчині (де руйнівні теплові сили досягають значень, близьких до значень привабливих електростатичних сил зв'язку) тяжіння між іонами та іншими видами залишається ефективним.

Енергетика іонного склеювання
Іонне склеювання - це найпростіший тип хімічного зв'язку для візуалізації, оскільки він повністю (або майже повністю) електростатичний за своєю природою. Принцип енергетики утворення іонних зв'язків реалізується при розгляді формування\(\mathrm{NaCl}\) (нашої звичайної солі) з її складових\(\mathrm{Na}\) (металу) і\(\mathrm{Cl}_{2}\) (хлору). Формально ця реакція така:
\ begin {вирівняний}
&\ mathrm {Na} (\ mathrm {s}) +1/2\ mathrm {Cl} _ {2} (\ математика {~ g})\ Стрілка вправо\ mathrm {naCl} (\ mathrm {s})\\
&\ Дельта\ матрм {H} =-414\ mathrm {~kJ}\ математика {mol}
\ кінець {вирівняний}
Написане рівняння вказує на те, що 1\(1 / 2\) моль натрію вступає в реакцію з моль-хлором\(\left(\mathrm{Cl}_{2}\right)\) при утворенні 1 моль (іонічно зв'язаного) хлориду натрію; ця реакція супроводжується\((-)\) виділенням енергії\((\Delta \mathrm{H})\), іменованої теплотою реакції.\(414 \mathrm{~kJ}\) З більш ранніх міркувань зрозуміло, що електронна перестановка (реакція або утворення зв'язків) відбувається тому, що отриманий твердий продукт\((\mathrm{NaCl})\) знаходиться в меншому енергетичному стані, ніж сума сумарних енергій вихідних компонентів.
Енергетика, пов'язана з утворенням іонних зв'язків, може бути визначена кількісно, враховуючи енергетичні зміни, пов'язані з окремими етапами, що ведуть від вихідних матеріалів до кінцевого продукту (цикл Хабера-Борна).
Утворення зв'язку в NaCl може бути формально представлено як реакція перенесення електронів:

Реакції, що беруть участь у цьому процесі, які призводять до утворення 1 моль твердої солі, є:
(1) Іонізація\(\mathrm{Na}\):
\(\mathrm{Na}\)(газ)\(\rightarrow \mathrm{Na}^{+}+1 \mathrm{e}\) (Є.І.\(=+497 \mathrm{~kJ} / \mathrm{mole})\)
Енергетична зміна, пов'язана з цим кроком, енергія іонізації (Е.І.), становить
\(+497 \mathrm{~kJ} /\)моль.
(2) Придбання одного електрона шляхом\(\mathrm{Cl}\):
\(\mathrm{Cl}\)(газ)\(+1 \mathrm{e} \rightarrow \mathrm{Cl}^{-}\) (Е.А.\(=-364 \mathrm{~kJ} / \mathrm{mole}\))
Енергетична зміна, пов'язана з цим кроком, спорідненість електронів (Е.А.), є\(-364 \mathrm{~kJ} / \mathrm{mole}\). Знак мінуса відображає виділення енергії, зниження енергетичного стану, пов'язане з досягненням стійкої конфігурації рідкісних газів хлором.
Поки енергетичний баланс виявляється позитивним (\(\Delta \mathrm{E}=+133 \mathrm{~kJ}\)); це означає, що реакція не сприятлива, оскільки кінцеві продукти знаходяться в більш високому енергетичному стані, ніж вихідні продукти. Однак існують додаткові кроки, оскільки:
(3) Випаровування\(\mathrm{Na}\):
\(\mathrm{Na}\)(метал)\(\rightarrow \mathrm{Na}\) (газ)\(\left(\Delta \mathrm{H}_{\mathrm{V}}=+109 \mathrm{~kJ} /\right.\) моль)
Енергія, необхідна для перетворення\(\mathrm{Na}\) (метал) в\(\mathrm{Na}\) (газ), прихована теплота випаровування\(\left(\Delta \mathrm{H}_{\mathrm{v}}\right)\), є\(109 \mathrm{~kJ} /\) моль (зараз реакція виявляється ще менш сприятливою).
(4) Дисоціація\(\mathrm{Cl}_{2}\):
\(\mathrm{Cl}_{2} \rightarrow 2 \mathrm{Cl} \quad(\text { E.D. }=+242 \mathrm{~kJ} \text { ) }\)
Енергія, пов'язана з розпадом (стабільної) молекули хлору на два реактивних атома хлору, енергія дисоціації (Е.Д.), становить\(+242 \mathrm{~kJ} / \mathrm{mole}\). (Так як в утворенні однієї родимки\(\mathrm{NaCl}\) бере участь всього 1 родимка\(\mathrm{Cl}\), а так як з одного крота утворюється 2 родимки\(\mathrm{Cl}_{2}\), енергія, необхідна на цьому етапі, є\(1 / 2 \mathrm{E} . D\)., або\(121 \mathrm{~kJ}\).)
Загальна зміна енергії, пов'язана з реакціями (1) через (4),\(\Delta \mathrm{H}_{\mathrm{T}}=+364 \mathrm{~kJ}\) Це свідчить про те, що одна або кілька основних реакцій, які призводять до загального зниження енергії, все ще не розглядаються.
(5) Ще не розглянуто куломбічне притягання продуктів реакції, які мають протилежний заряд і енергетичний термін, пов'язаний з утворенням продукту «твердого стану»,\(\mathrm{NaCl}\). Два іонних виду, спочатку при нульовій енергії (нескінченна відстань поділу), притягуються один до одного супутньою зміною енергії (зменшенням).
Енергетику, пов'язану з наближенням партнерів реакції (рис. 3), найкраще розглядати, зафіксувавши положення одного, наприклад\(\mathrm{Na}^{+}\), і дозволивши наблизитися до іншого: у міру\(\left(\mathrm{Cl}^{-}\right)\)\(\mathrm{Cl}^{-}\)\(\mathrm{Na}^{+}\) наближення Е зменшується за законом Кулона с\(\mathrm{e}^{2} / 4 \pi \varepsilon_{0} r\). З наближенням двох протилежно заряджених іонів зовнішні електронні оболонки вступлять в контакт і сила відштовхування стане активною, коли оболонки взаємопроникають. Сила відштовхування\(\left(E_{\text {rep }}\right)\) збільшується з\(+b / r^{12}\) і, таким чином, активна лише в безпосередній близькості від іона натрію, але на цьому етапі швидко зростає. Два іони в безпосередній близькості знаходяться під впливом як привабливих, так і відштовхуючих сил і припускають відстань поділу, на якій дві сили врівноважують один одного - відстань, яке називається рівноважним поділом (\(r_o\)) і яке відповідає енергетичному мінімуму для NaCl молекули:
\(E_{\text {coul }}=-\dfrac{e^{2}}{4 \pi \varepsilon_{0} r_{0}}+\dfrac{b}{r_{0}^{12}}\)
де\(e=\) електронний заряд, діелектрична\(\varepsilon_{0}=\) проникність вільного простору\(\left(8.85 \times 10^{-12} \mathrm{~F} / \mathrm{m}\right)\) і\((\mathrm{b})\) є постійною. (\(r_{0}\)Для газоподібних молекул можна отримати за фізичними вимірами.)

Якщо розглянутий в даний час куломбічний (привабливий) енергетичний термін розглядати як реакцію (5), він зменшить загальну позитивну енергетичну зміну,\(\Delta \mathrm{H}_{\bar{T}}\) однак, це не змусить його змінити знак з (+) на (-). Таким чином,\(\mathrm{NaCl}\) молекули в газоподібній формі не є кінцевим продуктом реакції; і реакція не відбуватиметься, якщо б\(\Delta \mathrm{H}_{\mathrm{T}}\) залишитися позитивною.
Розглядаючи іонічно зв'язану, газоподібну\(\mathrm{Na}^{+} \mathrm{Cl}^{-}\) молекулу, зрозуміло, що її електростатичні сили\((+)\) і\((-)\) не насичені - вони залишаються активними у всіх можливих напрямках. Це означає, що\(\mathrm{Cl}^{-}\) буде притягувати\(\mathrm{Na}^{+}\) іони з інших напрямків, як і\(\mathrm{Na}^{+}\) атоми будуть притягувати додаткові\(\mathrm{Cl}^{-}\) іони. Результатом цих привабливих сил у всіх напрямках є формування іонного тіла «гігантських розмірів» - «твердого» тіла макроскопічних розмірів. З попереднього визнається, що мінімальна енергетична конфігурація задається тілом, в якому\(\mathrm{Na}^{+}\) і\(\mathrm{Cl}^{-}\) розташовані з надзвичайною періодичністю та порядком, оскільки будь-який іон, розташований поза його «положенням рівноваги», буде перебувати в «конфігурації вищої енергії»; таке впорядковане тіло посилається до як кристалічне тверде тіло, або часто просто називають твердим тілом (рис.2).
Загальна зміна енергії, пов'язана з утворенням одного моля кристалічного іонного твердого тіла з його іонних складових, наведено як:
\(\mathrm{E}_{\text {cryst }}=-\dfrac{M \mathrm{~N}_{\mathrm{A}} \mathrm{e}^{2}\left(\mathrm{Q}_{1} \mathrm{Q}_{2}\right)}{4 \pi \varepsilon_{0} r_{o}}\left(1-\dfrac{1}{\mathrm{n}}\right)\)
де\(\mathrm{M}=1.747\) (константа «Маделунга» для\(\mathrm{NaCl}\), що відображає множинні взаємодії для конкретного геометричного розташування іонів у твердому тілі), число\(\mathrm{N}_{\mathrm{A}}=\) Авогадро,\(\mathrm{Q}=\) кількість зарядів на іон (1 для\(\mathrm{Na}^{+}\) і\(\left.\mathrm{Cl}^{-}\right), \mathrm{r}_{0}=\) рівноважна відстань поділу іонів, і \(n=\)відразливий показник\((n=12\) для\(\mathrm{NaCl})\).
[Зв'язок для кристалічної енергії легко\(\left(\Delta \mathrm{E}_{\text {cryst }}\right)\) отримується з міркувань енергії рівноваги:
\(\mathrm{E}_{\text {coul }}=-\dfrac{\mathrm{e}^{2}}{4 \pi \varepsilon_{0} r}+\dfrac{\mathrm{b}}{4 \pi \varepsilon_{0} r^{n}}\)
На рівноважній відстані іонного поділу\(\left(r_{0}\right),(\mathrm{dE} / \mathrm{dr})=0\). Таким чином:
\(\left(\dfrac{d E}{d r}\right)_{r_{0}}=\dfrac{e^{2}}{4 \pi \varepsilon_{0} r_{o}^{2}}-\dfrac{n b}{4 \pi \varepsilon_{0} r_{o}^{n+1}}=0\)
і
\(\mathrm{b}=\dfrac{\mathrm{e}^{2} \mathrm{r}_{\mathrm{o}}^{\mathrm{n}-1}}{\mathrm{n}}\)
і
\ почати {вирівняний}
&E_ {o (\ текст {Coul})} =-\ розрив {e^ {2}} {4\ pi\ varepsilon_ {o} r_ {o}} +\ frac {e^ {2}} {n 4\ pi\ varepsilon_ {o} r_ {o}}\ &E_ {o}}\
&E_ {o (\ текст {Coul})} =-\ розрив {e^ {2}} {4\ pi\ varepsilon_ {o} r_ {o}}\ лівий (1-\ frac {1} {n}\ праворуч)
\ кінець {вирівняний}
Для «молярного» кристала з іонними зарядами\(\mathrm{Q}_{1}\) і\(\mathrm{Q}_{2}\), таким чином, моляр\(\Delta \mathrm{E}_{\mathrm{o}(\text { Coul) }}\) дається як:
\(\Delta \mathrm{E}_{\text {cryst }}=-\dfrac{\mathrm{MN}_{\mathrm{A}} \mathrm{Q}_{1} \mathrm{Q}_{2} \mathrm{e}^{2}}{4 \pi \varepsilon_{\mathrm{o}} \mathrm{r}_{\mathrm{o}}}\left(1-\dfrac{1}{\mathrm{n}}\right)\)
Тут\(M\) і\(N_{A}\) стоять, як зазначено вище, для умовних термінів, константа Маделунга та число Авогадро.]
Для нинішньої системи (\(\mathrm{NaCl})\):
\(\Delta \mathrm{E}_{\text {cryst }}=-777 \mathrm{~kJ} /\)моль.
Тепер розглядаємо реакції (1) через (5):
\(\Delta \mathrm{H}_{\text {Total }}=-414 \mathrm{~kJ} /\)моль
яка ідентична значенню експериментально визначеної і наведеної для реакції:
\ begin {вирівняний}
&\ mathrm {Na} (\ текст {метал}) +\ mathrm {Cl} _ {2}\ текст {(газ)}\ стрілка вправо\ mathrm {NaCl}\ текст {(твердий)}\
\\ дельта\ математика {H} _ {\ текст {реакція}} =-414\ mathrm {~kJ}/текст {моль}
\ кінець {вирівняний}
У циклі Хабера-Борна енергія реакції,\((\Delta \mathrm{H})\) пов'язана з утворенням\(\mathrm{NaCl}\) від,\(\mathrm{Na}+\mathrm{Cl}_{2}\) може бути узагальнена як:
\(\Delta \mathrm{H}=\text { E.I. }+\text { E.A. }+\Delta \mathrm{H}_{\mathrm{V}}+1 / 2 \text { E.D. }+\Delta \mathrm{H}_{\text {cryst }}\)
\(\Delta \mathrm{H}\), теплота реакції, таким чином, може бути отримана від енергетики кроків, що ведуть до кінцевого продукту. Однак у більшості випадків енергія реакції\((\Delta \mathrm{H})\) визначається експериментально в калориметрі і цикл Хабера-Борна використовується для отримання значення\(\Delta \mathrm{E}_{\text {cryst }}\) або\(\mathrm{E} . \mathrm{A} .\), які обидва надзвичайно важко отримати.
Висновки: Першочерговим приводом для атомних взаємодій, що призводять до «зв'язування», є досягнення октетів валентної оболонки, які демонструють високий ступінь стабільності. Якщо взаємодіють атоми з лівого і правого боку Періодичної таблиці, тобто атоми з великою різницею спорідненості електронів (\(\triangle \mathrm{E} . \mathrm{A} .)\), стабілізація досягається утворенням октета електронів за допомогою перенесення заряду. Продукти реакції виявляють протилежні заряди (\(\oplus\)катіони,\(\ominus\) аніони) і підлягають куломбовому залученню - утворюються іонні зв'язки. Оскільки електростатичні сили ненаправлені і ненасичені, мінімізація енергії призведе до утворення макроскопічних тіл, які високо впорядковані в атомному масштабі, кристалічних іонних твердих тіл. Іонні тверді речовини мають переважно передбачувані, основні властивості:
- атомні домовленості є функцією співвідношення розмірів іонів, співвідношення заряду іонів та їх електронної структури;
- електрична та теплопровідність, як очікується, буде низькою, оскільки висока стабільність утворених октетів призводить до виникнення зв'язаних електронів, які не сприяють провідності (існує великий «енергетичний зазор», який слід перетнути для переходу електронів у вищий енергетичний стан);
- оптично іонні тверді тіла в основному прозорі, або напівпрозорі, що відображають октетну стабільність електронів і макро- або мікрокристалічність;
- температури плавлення високі, збільшуються з електронними зарядами на катіони і аніони;
- іонні тверді речовини, як правило, тверді і крихкі.
КОВАЛЕНТНОГО ЗВ'ЯЗКУ
Механічні поняття та висновки
У 1924 р. Л. Деброглі висунув гіпотезу про те, що вся речовина в русі має хвильові властивості і може бути віднесена до довжини хвилі частинки.
\(\lambda_{P}=\mathrm{h} / \mathrm{mv}\)
де\(\mathrm{h}\) - постійна\(\mathrm{m}\) Планка, - маса речовини і\(v\) її швидкість.
Достовірність цієї гіпотези була встановлена Девіссоном і Гермером в 1927 році, коли вони продемонстрували, що електрони (як електромагнітне випромінювання) дифрагуються кристалічними гратами. Важливим наслідком двоїстої природи матерії (вона проявляє як частинки, так і хвильові властивості) є принцип невизначеності, встановлений в 1927 р. У ньому зазначено, що неможливо одночасно з упевненістю дізнатися як імпульс, так і положення рухомої частинки:
\(\left(\Delta p_{x}\right)(\Delta x) \gtrsim h\)
Ми можемо перефразувати принцип невизначеності наступним чином: Якщо енергія частинки відома (вимірюється) з високою точністю, її розташування пов'язане з високим ступенем невизначеності.
Якби електрони займали прості орбіти (як постулюється Бор-Зоммерфельдом), їх імпульс і положення можна було б визначити точно в будь-який момент - з порушенням принципу невизначеності. За словами Гейзенберга, якщо енергія електрона задана з точністю (різкість спектральних ліній), то її розташування можна задати лише через ймовірність знаходження цього електрона в певному місці (об'ємному елементі). Ці аргументи породжують поняття густини ймовірностей та електронної хмари, які притаманні хвильово-механічній електронній концепції, що виходить з розв'язків хвильового рівняння Шредінгера, яке пов'язує енергію орбітального електрона з його хвилею. властивості. При вирішенні саме хвильового рівняння Шредінгера для електрона в атомі водню результати квантування, згідно з яким електрони можуть приймати лише певні енергії, які знаходяться в кількісній узгодженості з тими, що отримані з теорії Бора.
Порівняно з теорією Бора, значні відмінності спостерігаються для орбітального квантування (орбітального квантового числа\(I\)), що визначає орбітальну форму. Для\(n=1\)\(I=0\) (1s орбітальної) хвильова механіка прогнозує сферичний розподіл електронної густини з максимальною щільністю ймовірності\(\left(\psi^{2}\right)\) на відстані\(0.529 \AA\left(\mathrm{a}_{0}\right)\) від ядра. Однак для\(I=1\) (p орбіталів) встановлено, що орбіталі (три) утворюють частки, вирівняні з прямокутними координатами (див. LN-1, рис.3). Для\(I=2\) (d орбіталів) отримують п'ять складних орбітальних конфігурацій.
Попередні міркування дозволяють припустити, що всі елементи намагаються припустити стабільну конфігурацію октета з вісьмома електронами в валентній оболонці. (Для водню, з зайнятою лише однією оболонкою, стабільна конфігурація складається з двох електронів в\(\mathrm{K}\) оболонці - це максимальна кількість електронів, які можуть бути розміщені.) Стабільне утворення октета можливо через перенесення електронів (і утворення іонних зв'язків), коли, наприклад, елементи в колонках IA, IIA і IIIA реагують з елементами в колонках VA, VIA і VIIA відповідно. У цих випадках партнери по реакції виявляють досить виражені відмінності в спорідненості електронів, і після реакції один приймає конфігурацію октету, втрачаючи один або кілька електронів, тоді як інший робить це, набуваючи відсутню кількість електронів.
Цей механізм явно неможливий, якщо\(\mathrm{H}\) реагує з\(\mathrm{H}\) утворенням\(\mathrm{H}_{2}\) молекули, де два атоми пов'язані між собою. Той же аргумент тримає і для утворення\(\mathrm{N}_{2}, \mathrm{Cl}_{2}\) і\(\mathrm{O}_{2}\) молекул. Конфігурація інертного газу (конфігурація октета) в таких елементах досягається механізмом, званим орбітальним поділом, а отриманий зв'язок називається ковалентної, або електронно-парної зв'язком.
Ковалентний зв'язок дещо складніше візуалізувати, ніж іонний або електровалентний зв'язок, оскільки він передбачає спільне використання пари електронів між атомами. Стійкість цього зв'язку можна віднести до складного взаємного тяжіння двох позитивно заряджених ядер спільною парою електронів. В принципі, зв'язок можна зрозуміти, якщо визнати, що обидва електрони в орбіталі зв'язку проводять більше часу між двома ядрами, ніж навколо них, і, таким чином, повинні здійснювати привабливі сили, які складають зв'язок. У такому розташуванні зрозуміло, що кожен електрон, незалежно від його джерела, надає привабливу силу на кожне з «зв'язаних» ядер. Пара електронів в ковалентному зв'язку унікальна в тій мірі, що принцип виключення Паулі виключає наявність додаткових електронів в тій же орбіталі. Крім того, явище спарювання нейтралізує окремі електронні спини одиночних електронів, і отримана електронна пара зі своїм нульовим спіновим імпульсом менш сильно взаємодіє зі своїм оточенням, ніж два незалежні електрони. [Ковалентні зв'язки зручно символізуються через точкове позначення, введене спочатку Льюїсом (рис. 4).]
ПОЗНАЧЕННЯ ЛЬЮЇСА:
У позначенні LEWIS ковалентний молекулярний зв'язок позначається як BAR або як дві DOTS (що стоять для парних електронів)

Формальна стабілізація валентної оболонки октет може бути досягнута шляхом спільного використання електронів, в результаті чого по одному електрону від кожного партнера реакції ділять - спінові парні - молекулярні зв'язки орбіталі.
Квантова механіка дає можливість суворо описати ці зв'язки для дуже простих випадків, таких як молекула водню, яка складається з двох протонів і двох електронів. Таким чином, можна показати, що потенційна енергія для системи досягає мінімуму для певної рівноважної відстані між ядрами, при цьому підвищується електронна щільність між ядрами. На більш коротких відстанях між ядрами виявляється, що сили відштовхування збільшуються дуже швидко.
У молекулі\(\left(\mathrm{H}_{2}\right)\) водню два атоми водню ефективно пов'язані між собою однією молекулярною електронною орбіталлю, яка називається\(\sigma\) орбітальною, яка включає обидва атоми і містить два електрони. (Рис. 5) Кожен з цих двох електронів можна вважати, що походить від одного з двох атомів - спочатку вони були обома\(1 \mathrm{~s}\) електронами з однаковим значенням спіна\((s=+1 / 2)\). На молекулярній орбіті, що містить обидва атоми, спини

два електрони повинні вирівняти анти-паралельно (протилежний спін). Цей процес спін-спарювання призводить до значного вивільнення енергії і, таким чином, значно сприяє стабільності (міцності) утвореного ковалентного зв'язку. Цікаво, що згідно ньютонівської механіці ніяка стабільна конфігурація не може виникнути від розміщення двох електронів в одну область (орбіту) - хвильова механіка (див. Нижче), однак, пророкує підвищену стійкість від таких конфігурацій. (Подібне спін-спарювання відбувається при заповненні атомних орбіталей.) У молекулярному випадку спін-парування має наслідок того, що як розподіли ймовірностей, так\(\left(\psi^{2}\right)\) і просторовий розподіл електронів такі, що відбувається максимальне перекриття орбіталів об'єднаних атомів.
Утворена у водні зв'язок являє собою єдиний зв'язок, що містить два електрони з парними спинами. Ця формулювання передбачає, що буде фіксоване міжядерне розділення, яке для молекули водню має значення\(0.74 \AA\). [\(\sigma\)зв'язки утворюються не тільки s орбітальним перекриттям, але також p-s і p-p орбітальним перекриттям, а також перекриттям\(s\) або\(p\) орбіталями з гібридизовані орбіталі; мова піде нижче (див. Рис. 5).]
Важливо визнати, що стабілізація октета шляхом електронно-орбітального обміну призводить до властивостей зв'язку, які принципово відрізняються від тих, що зустрічаються в іонному (електровалентному) зв'язку: з утворенням ковалентного зв'язку між атомами водню (формування\(\left(\mathrm{H}_{2}\right.\) молекули) зв'язок. Формуючі можливості двох атомів водню насичені; кінцевий продукт - це окрема молекула,\(\left(\mathrm{H}_{2}\right)\) а не тверде тіло гігантського розміру, яке отримують як кінцевий продукт з утворенням іонних зв'язків. Ковалентні тверді тіла, однак, також існують: вони утворюються, якщо задіяні елементи мають здатність утворювати більше одного зв'язку. Наприклад, вуглець буде утворювати чотири ковалентні зв'язку в чотиригранної конфігурації - в результаті вийде алмаз, ковалентно зв'язана, тривимірна мережа.
Двоатомні молекули за участю різнорідних атомів
Розглянемо з'єднання хлористого водню (в газоподібному, рідкому або твердому стані). Це з'єднання не є іонним (тому що енергетичний стан при повній іонізації було б вище. Натомість зв'язок між атомами водню та хлору здійснюється шляхом спільного використання електронів в молекулярній орбіталі, утворюючи таким чином єдиний ковалентний зв'язок (рис.6).

Задіяні електрони - це 1 с електрон атома водню і непарний\(3 p_{z}\) електрон атома хлору. Після спін-спарювання утворюється типова\(\sigma\) зв'язок, в якій кожен атом досягає структури благородного газу: в\(\mathrm{HCl}\) атомі водню «задіяний» два електрони, як у гелію, а атом хлору з 18 електронами, як у аргону. Інші (внутрішні) електрони хлору не беруть участі в зв'язуванні; їх називають незв'язуючими.
Відповідно до вищезазначених міркувань, склеювання\(\mathrm{HCl}\) може сприйматися як дуже схоже на те, що\(\mathrm{H}_{2}\). Однак у молекулі водню електрони, що беруть участь у утворенні\(\sigma\) зв'язку, не сприяють близькості жодного з ядер водню - натомість вони однаково поділяються. З іншого боку, перевагу одному ядру (хлору) показують електрони\(\sigma\) зв'язку в хлористому водні. Це пов'язано з тим, що електрони з енергетичних причин сприяють навколишньому середовищу більш електронегативного атома; у хлористого водню це атом хлору і, отже, електрони\(\sigma\) зв'язку проводять більше часу поблизу атома хлору. Ця ситуація призводить до того, що хлорний кінець молекули є фракційно негативно зарядженим,\(\left(\delta^{-}\right)\) а кінець водню - фракційно позитивно зарядженим\(\left(\delta^{+}\right)\). Позначимо такий внутрішній перерозподіл заряду символікою\(\mathrm{H}^{\delta+}-\mathrm{Cl}^{\delta-}\), де\(\delta\) знак вказує на частковий електронний заряд; зв'язок, як кажуть, полярна. (Молекула водню апріорі не проявляє такого «асиметричного розподілу заряду»; однак вона може придбати тимчасову поляризацію.) Молекули з асиметричним електронним розподілом заряду мають постійний дипольний момент, величина якого задається добутком дробового заряду (\(\delta^{+}\)повинно бути рівним\(\delta^{-}\)) і відстанню поділу заряду\((\mathrm{L})\). Хоча дипольні моменти можна виміряти, їх значення не дозволяють безпосередньо обчислити полярність зв'язків між атомами, оскільки детальний внутрішній розподіл заряду невідомий. Напрямок дрейфу електронів і в деякій мірі величину його впливу можна оцінити за величиною різниці спорідненості електронів між партнерами по реакції. Через обмежену базу даних про спорідненість електронів, Л.Паулінг ввів споріднений термін, відносну електронегативність (див. Нижче). З перерахованих вище міркувань повинно бути зрозуміло, що різкої лінії розподілу між іонним і ковалентним зв'язком не існує. Ми могли б розглянути повністю іонний зв'язок, що призводить до випадків, коли дрейф електронів такий, що один атом (катіон) стає повністю дефіцитним в одному або декількох електронах, а інший атом (аніон) стає відповідно багатим електроном, а зв'язкові електрони повністю знаходяться під впливом останнього . Галогеніди водню пов'язані $\ sigma$ і мають дипольні моменти; зв'язки називаються полярною ковалентністю. Гомоядерні двоатомні молекули, утворені галогенами, а саме.\(\mathrm{F}_{2}, \mathrm{Cl}_{2}, \mathrm{Br}_{2}\) і\(\mathrm{I}_{2}\), всі\(\sigma\) -зв'язані системи, що включають спін-спарювання різних\(p_{z}\) електронів\(\left(2 p_{z}, 3 p_{z}\right.\),\(4 p_{z}\) і\(5 p_{z}\) відповідно). У них немає постійних дипольних моментів.
Енергетика ковалентного зв'язку
Паулінг широко розглядав енергетику полярних ковалентностей, що зустрічаються у всіх гетероядерних системах (таких як\(\mathrm{H}-\mathrm{Cl}\)), які мають постійні дипольні моменти\(\left(\mathrm{H}^{\delta+}-\mathrm{Cl}^{\delta-}\right)\). Його підхід візуалізує зв'язок, що складається з двох компонентів - чистої ковалентності та іонного зв'язуючого компонента з тяжінням, що виникає в результаті взаємодії дробових зарядів на задіяних ядрах.
Паулінг визначає основний компонент ковалентного зв'язку, наприклад, при утворенні\(\mathrm{HCl}\), з експериментально отриманих енергій зв'язку, пов'язаних з молекулярними видами компонентів,\(\mathrm{H}_{2}\) і\(\mathrm{Cl}_{2}\). Для цього він зробив основне припущення, що компонент ковалентного зв'язку між різнорідними атомами задається середнім геометричним енергій чистого ковалентного зв'язку, пов'язаних з цими молекулярними видами. Таким чином:
Чиста енергія ковалентного зв'язку\(\mathrm{HCl}\):
\ begin {вирівняний}
\ математика {BE} _ {\ mathrm {HCl}} &=\ sqrt {\ математика {BE} _ {\ математика {H} _ {2}}\ час\ mathrm {E} _ {2}}}\\
&\ mathrm {H} _ {2}:\ mathrm {H} -\ математика {H}\ text {(Енергія зв'язку} =\ mathrm {BE} _ {\ mathrm {H} _ {2}} =430\ mathrm {~kJ}/\ mathrm {mole}\ text {)}\\
&\ mathrm {Cl} _ {2}:\ математика {Cl} -\ mathrm {Cl}\ текст {(Енергія зв'язку} =\ математика {BE} _ {\ mathrm {Cl}} =238\ mathrm {~kJ}/\ mathrm {mothrm}\ text {)}\\
&\ mathrm {BE} _ {\ mathrm {HCl}} =\ sqrt {430\ раз 238} =320\ mathrm {~kJ}/\ текст {моль}
\ кінець {вирівняний}
Іонний внесок\((\Delta)\) в полярний ковалентний зв'язок потім отримують з різниці між експериментально визначеною енергією зв'язку (наприклад)\(\mathrm{HCl}\), яка, очевидно, повинна містити обидва компоненти, і розрахованої чистою енергією ковалентного зв'язку:
\(\left.\Delta=\left[\mathrm{BE}_{\mathrm{HCl}} \text { (experimental }\right)\right]-\left[\mathrm{BE}_{\mathrm{HCl}} \text { (theoretical - covalent) }\right]\)
\(\text{(The experimentally determined} \mathrm{BE}_{\mathrm{HCl}}=426 \mathrm{~kJ} / \mathrm{mole}.)\)
\(\Delta=426-320=106 \mathrm{~kJ} / \text { mole }\)
У зв'язку з нині обговорюваною роботою Лінус Полінг встановив загальновикористовувану зараз шкалу електронегативності, або, що краще, шкалу відносних електронегативностей. Ця шкала, включена до Періодичної таблиці елементів, надзвичайно корисна, оскільки значення спорідненості електронів відомі поки що лише для дуже небагатьох елементів.
\((\mathrm{x})\)Шкала електронегативності перераховує відносну тенденцію нейтральних елементів до залучення додаткового електрона. (Значення\(x\) умовно перераховані в електронвольтах.) Наведена шкала була отримана шляхом довільного закріплення значення\(x_{H}=2.2\). Полінг отримав значення для інших елементів, зв'язавши відмінності електронегативності партнерів реакції з дробовим іонним характером (іонним зв'язковим компонентом) зв'язку, встановленого між ними:
\ begin {вирівняний}
&\ текст {експериментальний}\ mathrm {BE} _ {\ mathrm {AB}} =\ sqrt {\ mathrm {BE} _ {\ mathrm {M}}\ mathrm {m}\ left (\ mathrm {x} _ {\ mathrm} {A}} -\ mathrm {x} _ {\ mathrm {B}}\ праворуч) ^ {2}\ &\ text {або}\\
&\ Delta=96.3\ ліворуч (\ mathrm {x} _ { \ mathrm {A}} -\ mathrm {x} _ {\ mathrm {B}}\ праворуч) ^ {2}\ mathrm {~kJ}
\ кінець {вирівняний}
За словами Полінга, характер зв'язку між двома різними елементами може бути визначений як:
іонний зв'язок для:\(\Delta x>1.7\); ковалентного зв'язку для:\(\Delta x<1.7\)
Дробова іонність полярного ковалентного зв'язку, перерахована в P/T, отримується співвідношенням:
\(\%\)іонне склеювання\(=\left(1-\mathrm{e}^{-0.25\left(\mathrm{x}_{\mathrm{A}}-\mathrm{x}_{\mathrm{B}}\right)^{2}}\right) \times 100\)
Склеювання в багатоатомних молекулах
При утворенні ковалентних зв'язків між атомами в багатоатомних молекулах умови, які атомні орбіталі спотворюють так, що максимальне перекриття може бути досягнуто, коли відбувається зв'язок, виробляють більш широкі зміни геометрії орбіти, ніж у випадку з двоатомними молекулами. Пам'ятайте, що зміни, які призводять до утворення\(\sigma\) зв'язку в двоатомних молекулах, є спотворенням s орбіталів або\(p\) часточок, так що найсильніше утворення зв'язку виникає внаслідок максимального перекриття між двома з'єднаними ядрами. Для багатоатомних молекул відбуваються великі зміни в просторовому розташуванні атомних орбіталів, і дуже часто унікальна орбітальна геометрія вихідних атомних орбіталів повністю втрачається (рис.7). Іноді зручно розглядати ці зміни як відбуваються в кожному атомі перед зв'язуванням процесом, що включає змішування або гібридизацію атомних орбіталів.

Склеювання за участю вуглецю
У метані\(\left(\mathrm{CH}_{4}\right)\) чотири зовнішні, або валентні, електрони вуглецю поділяються з електронами водню; між кожним окремим електроном водню та одним із валентних електронів вуглецю існує спін-спарування (що призводить до утворення зв'язків). Таким чином, структура благородного газу досягається кожним ядром: вуглецеве ядро «бачить» вісім зовнішніх електронів і кожне\(\mathrm{H}\) ядро «бачить» два електрони. Розглянемо тепер орбіталі, які задіяні більш докладно. Кожен водень має одну сферичну валентну орбіталь (1-а орбіталь), що містить один електрон, і утворення ковалентного зв'язку виникає внаслідок його спотворення, перекриття валентних орбіталів вуглецю та спін-парювання.
Згідно з принципом Ауфбау та правилом Гунда, у своєму основному стані вуглець має два електрони в заповненій\(\mathrm{K}\) оболонці та чотири електрони в\(\mathrm{L}\) оболонці: два електрони 2 с і два\(2 p\) електрони на однозайнятих орбіталах, які здатні утворювати ковалентні зв'язки. Така конфігурація забезпечує, в принципі, тільки дві орбіталі\(\left(2 p_{x}, 2 p_{y}\right)\) для формування ковалентного зв'язку. Однак при двох ковалентностях вуглець не дасть бажаної конфігурації октет. Така конфігурація може бути отримана, якщо один з двох електронів 2s «просувається» в порожню\(2 p_{z}\) орбіталь, оскільки цей процес призводить до чотирьох одиночно зайнятих орбіталів - всі з яких, будучи поодиноко зайнятими, здатні до утворення зв'язків. Різноманітні одиночно зайняті орбіталі можуть припускати (і, отже, припускають) при утворенні зв'язку нижчу енергетичну конфігурацію, що включає процес, який називається гібридизацією, за допомогою якого чотири орбіталі (двох різних типів) гібридизуються на чотири однакові орбіталі з максимальним рівним інтервалом один від одного (рис. 8). Таким чином, гібридизовані орбіталі (\(sp^3\)гібриди) являють собою частки, що виходять від атома вуглецю в кути тетраедра, утворюючи зв'язкові кути\(109^{\circ} 28^{\prime} . \mathrm{sp}^{3}\) гібридизації характерні для вуглецю; однак, інші види гібридизації,\(\mathrm{sp}^{2}\) і\(\mathrm{sp}\), зустрічаються в інших елементах, як добре. Наприклад, бор, як правило, сприятиме одному з двох своїх електронів 2s у\(2 p\) стан і, шляхом гібридизації, утворює три еквівалентні\(s p^{3}\) орбіталі, які припускають планарну орієнтацію з кутами смуги\(120^{\circ}\). Берилій утворює sp гібридні орбіталі лінійної орієнтації (кут зв'язку дорівнює\(\left.180^{\circ}\right)\). Всі гібридні орбіталі здатні до формування\(\sigma\) зв'язків.
Велике розмаїття вуглецевих сполук (він утворює більше сполук, ніж всі інші елементи в Періодичній таблиці) можна віднести до здатності гібридизації вуглецевих орбіталей\(\left(\mathrm{sp}^{3}, \mathrm{sp}^{2}\right.\) і\(\left.\mathrm{sp}\right)\). Як наслідок, вуглець утворює не тільки осесимметричні\(\sigma\) зв'язки (через осьове орбітальне перекриття), але і\(\pi\) зв'язки (через бічне орбітальне перекриття). У з'єднанні етану\(\left(\mathrm{H}_{2} \mathrm{C}=\mathrm{CH}_{2}\right)\) інтерактивні атоми вуглецю піддаються\(\mathrm{sp}^{2}\) гібридизації для\(\sigma\) зв'язку шляхом перекриття двох\(\mathrm{sp}^{2}\) гібридних орбіталей і утворюють, крім того,\(\pi\) зв'язок бічним перекриттям решти негібридизованих\(p\) орбіталей. (Подвійні облігації включають одну\(\sigma\) і одну\(\pi\) облігацію.) В ацетилені\((\mathrm{HC} \equiv \mathrm{CH})\) виявлено sp гібридизацію і, шляхом осьового перекриття, утворення\(\sigma\) зв'язків, а також бічне перекриття решти негібридизованих\(p_{x}\) і\(p_{y}\) орбіталів, які утворюють два\(\pi\) зв'язки (рис.9).


МЕТАЛЕВЕ СКЛЕЮВАННЯ
Стабільність як ковалентних, так і металевих зв'язків може розглядатися як виникає внаслідок зниження потенційної енергії, що відчувається валентними електронами під впливом більш ніж одного ядра. У металах, де валентні електрони не так щільно пов'язані зі своїми іонними ядрами, не можна очікувати утворення сильних електронно-парних зв'язків. Енергії зв'язку відомих двоатомних молекул металевих елементів, по суті, менше, ніж ті, що складаються з неметалічних елементів:\(104 \mathrm{~kJ} /\) моль для\(\mathrm{Hg}_{2}\). Тільки двоатомні молекули напівметалів мають відносно високі енергії зв'язування (\(\left(385 \mathrm{~kJ} / \mathrm{mole}\right.\)для\(\mathrm{As}_{2}\),\(293 \mathrm{~kJ} / \mathrm{mole}\) для\(\mathrm{Sb}_{2}\) і\(163 \mathrm{~kJ} /\) моль для\(\mathrm{Bi}_{2}\)). Ці значення відображають багаторазове склеювання. Набагато більша стабільність можлива в більших агрегатах атомів, таких як об'ємні метали.
Відомі властивості металів, такі як низький електричний опір і податливість, підтримують концептуальну думку про те, що валентні електрони в металах ніколи не залишаються поблизу якогось
конкретного атома дуже довго, але дрейфують випадковим чином через решітку іонних сердечників. Тому ми можемо візуалізувати метали як решітку іонних сердечників, що утримуються разом газом вільних електронів.
(Склеювання в металевих системах більш детально розглянуто в LN-3.)
ВТОРИННЕ (ван дер ВААЛС) СКЛЕЮВАННЯ
Первинний зв'язок (іонний, ковалентний і металевий) є сильним, а задіяні енергії коливаються приблизно від 100 до 1000 кДж/моль. На відміну від цього, вторинний зв'язок слабкий, залучаючи енергії в діапазоні приблизно від 0,1 до 10 кДж/моль. Хоча цей тип зв'язку, який також називають «залишковим», є слабким, він має важливе значення для функціонування нашого середовища. Кокс, швидше за все, буде газоподібним, а не бульбашковим, освіжаючим заварюванням, якби не вторинне склеювання, а також не функціонувало б каталітичні нейтралізатори.
Різниця енергій між рідким і паровим станами даної системи задається теплотою випаровування, тобто теплотою, необхідною для перетворення даної рідини в пар (нормально) при температурі кипіння при тиску 1 атм. Різниця енергій обумовлена міжмолекулярним притяганням між молекулами на близькій відстані поділу. Це явище тяжіння за допомогою вторинного зв'язку найкраще можна розглядати між однією парою молекул, але визнаючи, що сили мають більший діапазон. Можна виділити чотири типи міжмолекулярних сил.
1. Дипольно-дипольна взаємодія: Молекули з постійними диполями (такими як вода, спирт та інші органічні сполуки з функціональними групами) надають чисту привабливу силу один на одного в результаті різного ступеня вирівнювання протилежно заряджених частин молекул (рис.10). Для двох полярних молекул з дипольним моментом,\((\mu)\) розділеним на відстань (r), енергію тяжіння можна кількісно визначити як:

де\(\mu\) дипольний момент,\(r\) - відстань наближення протилежно заряджених молекулярних частин,\(k\) є постійною Больцмана (див.\(P / T)\) І\(T\) є абсолютною температурою в\(\mathrm{K}\).
Молярні енергії тяжіння, пов'язані з дипольно-дипольною взаємодією, коливаються від 0 до приблизно\(10 \mathrm{~kJ} /\) моль. Ці сили в першу чергу відповідають за рідкий стан (при кімнатній температурі) більшості полярних органічних молекул; вони є фактором, що сприяє тому,\(\mathrm{H}_{2} \mathrm{O}\) щоб бути рідким при кімнатній температурі, і відповідають за те, що алкоголь є рідиною.
2. Дипольно-індукована дипольна взаємодія: Диполь в одній молекулі може взаємодіяти з електронами сусідньої неполярної молекули і поляризувати, таким чином, генеруючи індукований диполь, який буде відчувати привабливу силу з поляризуючим полярним диполем (рис. 11). Дебая показав, що в молекулі з «поляризуемостью» привабливий потенціал, що виникає внаслідок дипольно-індукованої дипольної\((\alpha)\) взаємодії, наведено як:
\(\mathrm{E}_{\text {Dipole-Induceddipole }}=-\dfrac{2 \alpha \mu^{2}}{\mathrm{Dr}^{6}}\)

Індукована дипольна взаємодія важлива у водних розчині і дуже ефективна при адсорбції інертних молекул на активних твердих субстратах.
3. Лондонські сили дисперсії: Відомий факт, що всі речовини, включаючи рідкісні гази та водень, припускають рідкий стан при кінцевій температурі, що свідчить про існування привабливих міжатомних та міжмолекулярних сил, навіть за відсутності постійних дипольних систем. Походження цієї сили було запропоновано Ф.Лондоном в 1930 році. Відповідно, орбітальні електрони в будь-якому випадку будуть генерувати «тимчасовий диполь», конфігурація якого змінюється в міру руху електронів. Оскільки всі атоми даної системи аналогічно відчувають тимчасові миттєві дипольні моменти, їх ефект, як очікується, буде скасований через статистично випадкову орієнтацію диполів. Очевидно, що, якщо диполі будуть синхронізовані в заданій збірці атомів, то чиста сила притягання призведе до (рис. 12). Але оскільки така приваблива сила являє собою зниження енергії даної системи, синхронізація може і буде відбуватися тому, що всі системи будуть намагатися прийняти мінімальну енергетичну конфігурацію. Лондонська сила дисперсії може бути сформульована як:
\(\mathrm{E}_{\text {London }}=-\mathrm{K} \dfrac{\alpha^{2}}{\mathrm{r}^{6}}\)
Привабливі лондонські сили невеликі, що проявляється дуже низькими температурами кипіння менших рідкісних газів, водню та азоту.
4. Водневий зв'язок: Дипольні взаємодії короткого та довгого діапазону, розраховані на молекулярних дипольних моментах, недостатні в поясненні безлічі явищ в органічних, а також деяких неорганічних системах. Л. Паулінг вивчав такі

явища і дійшли висновку про існування високоспецифічної привабливої взаємодії між воднем, який є кислим (несе дробовий позитивний заряд) і елементами O, F, N і, в меншій мірі, S як в органічних, так і в неорганічних молекулах. Ця взаємодія, яка поки що не може бути сформульована, називається водневим зв'язком; його величина, що становить до 40 кДж/моль, значно більша, ніж у будь-якого іншого вторинного типу зв'язку. Водневий зв'язок вважається інструментальним у контролі більшості властивостей води, є ключовим елементом у структурі нуклеїнової кислоти і вважається важливим компонентом у функціях пам'яті людського мозку.