1.4: Природа кристалічних твердих речовин
- Page ID
- 27778
У збірці атомів або молекул тверда фаза утворюється всякий раз, коли міжатомні (міжмолекулярні) сили притягання значно перевищують руйнівні теплові сили і тим самим обмежують рухливість атомів, змушуючи їх у більш-менш фіксовані положення. З енергетичних міркувань видно (як обговорювалося в LN-2), що в таких твердих тілах атоми або молекули завжди намагатимуться припустити високо впорядковані структури, які характеризуються симетрією. Залежно від характеру діючих міжатомних сил всі тверді речовини можуть поділятися на:
- Іонні тверді речовини (NaCl)
- Ковалентні тверді речовини (алмаз)
- Металеві тверді речовини (Fe, Ni та ін.)
- Ван-дер-Ваальс тверді речовини (лід, твердий Він)
Тверді речовини, як ми стикаємося з ними в природі, можуть або не можуть відображати внутрішньо впорядковане розташування в їх зовнішньому вигляді. Ми знаходимо, наприклад, добре сформовані кварцові кристали, гранати, діаманти та сніжинки, які характеризуються плоскими обмежуючими площинами, які перетинаються під характерними кутами. З іншого боку, ми також спостерігаємо округлі камені та рукотворні литі тверді предмети без зовнішніх доказів внутрішнього порядку (рис.1).

Для розуміння зовнішнього вигляду твердого стану необхідно розглянути утворення твердих тіл з різних фаз. Тверді речовини, наприклад, утворюються при охолодженні рідин (розплавів) - шляхом заморожування або затвердіння; цей процес затвердіння зазвичай протікає в повному ув'язненні і отримана «лита» структура матиме зовнішній вигляд, який детально відображає обмежує геометрію (а не внутрішній порядок). Причому, в залежності від умов затвердіння тверде тіло може бути як монокристалічним, так і полікристалічним. Полікристалічні тверді речовини (понад 95% твердого стану, що зустрічаються) можна розглядати як збірку мікроскопічних монокристалів з випадковою орієнтацією, що утримуються разом, як структура лабіринту, переплетеними неправильними формами окремих кристалів.
Типовим прикладом «необмеженого» фазового перетворення є утворення сніжинок, де зовнішні межі твердого тіла приймали кристалічний вигляд, детально відображаючи внутрішньо впорядковане молекулярне\(\left(\mathrm{H}_{2} \mathrm{O}\right)\) розташування. Ще одним беззамкнутим утворенням твердої речовини є осадження з розчину (кристалів цукру тощо).\(\mathrm{CuSO}_{4}\) Аналогічним чином утворення кристалів з парової фази призводить до тіл, які зовні відображають елементи внутрішнього порядку.
КРИСТАЛІЧНА СТРУКТУРА
З попереднього обговорення повинно бути очевидним, що, коли існують сильні міжатомні сили, атоми, як правило, щільно упаковуються один до одного - близькість упаковки особливо виражена в твердому стані. У цьому випадку атоми можна розглядати як тверді сфери, а проблему тісної упаковки можна розглядати як таку, в якій вся збірка має тенденцію до ефективної упаковки. Трохи роздумів або кілька простих експериментів з м'ячами для пінг-понгу швидко переконують нас, що регулярні розташування сфер, як правило, призводять до більш компактних збірок, ніж нерегулярні розташування (рис.2). Цей же принцип застосовується і до розташування атомів в твердому стані. Там, де діють сильні сили привабливості, ми виявляємо, що відповідні атоми або молекули розташовуються в регулярній тривимірній схемі. Саме ця закономірність і є основою кристалічності в матеріалах: тобто кристалічна структура - це не що інше, як впорядкований масив атомів або молекул. Це визначення кристала відрізняється від популярного поняття, заснованого на спостереженні за зовнішньою симетрією кристалів, часто спостерігається при вивченні елементарної хімії, в якій одні кристали фігурують кубічними, в інших голчастими і так далі. Правильна зовнішня форма виходить тільки тоді, коли умови кристалізації сприятливі для розвитку плоских, геометричних граней. У більшості випадків, особливо з металами, ці умови відсутні, і кристали мають нерівні поверхні, хоча внутрішнє розташування ідеально геометричне.

Атомні масиви в кристалах зручно описані щодо тривимірної сітки прямих ліній. Розглянемо решітку з ліній, як на рис. 3, що розділяють простір на однакові за розміром призми, які стоять поруч з усіма стикаються гранями, тим самим заповнюючи весь простір і не залишаючи пустот. Перетину цих ліній є точками просторової решітки, тобто геометричної абстракції, яка корисна як орієнтир при описі і співвіднесення симетрії дійсних кристалів. Ці точки решітки мають принципове значення при описі кристалів, оскільки вони можуть бути позиціями, зайнятими окремими атомами в кристалах, або вони можуть бути точками, навколо яких кластеризовано кілька атомів. Оскільки через точки просторової решітки можна провести призми безлічі різних форм, щоб розділити її на осередки, спосіб малювання мережі опорних ліній довільний. Не обов'язково, щоб лінії проводилися так, щоб атоми лежали тільки по кутах одиничних призм. Насправді, зручніше описувати деякі кристали щодо призм, в яких атоми лежать у центрах призми або в центрах граней призми, а також у кутах призми.

Важливою характеристикою просторової решітки є те, що кожна точка має однакове оточення: угруповання точок решітки щодо будь-якої заданої точки ідентична групуванню щодо будь-якої іншої точки решітки. Іншими словами, якби ми могли рухатися в решітці, ми не змогли б відрізнити одну точку від іншої, оскільки ряди та площини біля кожної точки були б однаковими. Якби ми блукали серед атомів твердого металу або хімічної сполуки, ми б знайшли погляд з будь-якої точки решітки точно такий же, як і з будь-якої іншої.
Існує чотирнадцять космічних решіток (рис.4). Тобто можна знайти не більше чотирнадцяти способів, за допомогою яких точки можна розташувати в просторі так, щоб кожна точка мала ідентичне оточення. Звичайно, існує багато більше чотирнадцяти способів розташування атомів у фактичних кристалах; таким чином, існує велика кількість кристалічних структур. Занадто часто термін «решітка» вільно використовується як синонім «структура», неправильна практика, яка часто збиває з пантелику. Відмінність можна чітко побачити, якщо згадати, що космічна решітка - це масив точок у просторі. Це геометрична абстракція, яка корисна лише як орієнтир при описі та співвідношенні симетрії фактичних кристалів. Кристалічна структура, однак, - це розташування атомів або молекул, які насправді існують у кристалі. Це динамічне, а не статичне розташування і схильне до багатьох недосконалостей. Хоча будь-яка кристалічна структура має властиву симетрію, яка відповідає одній з чотирнадцяти космічних решіток, один, два або кілька атомів або молекул в кристалічній структурі можуть бути пов'язані з кожною точкою космічної решітки. Цю симетрію можна підтримувати за допомогою нескінченної кількості різних фактичних розташувань атомів - що робить можливим нескінченну кількість кристалічних структур.

Для задання заданого розташування точок в просторовій решітці прийнято ідентифікувати одиничну комірку з набором осей координат, обрану для того, щоб мати початок в одній з точок решітки (рис.5). У кубічній решітці, наприклад, ми вибираємо три осі однакової довжини, які взаємно перпендикулярні і утворюють три ребра куба. Кожна космічна решітка має якийсь зручний набір осей, але вони не обов'язково рівні по довжині або ортогональні. У кристалографії використовуються сім різних систем осей, кожна з яких володіє певними характеристиками щодо рівності кутів і рівності довжин. Ці сім кристалічних систем зведені в таблицю I (слід розглядати спільно з рис.4).

Таблиця I. Сім кристалічних систем
\ (\ begin {масив} {lll}
\ hline\ text {Система} &
\ text {Параметри} &\ text {Міжосьові кути}\\ hline
& a\ neq
\ neq c &\ neq\ beta\ neq\ neq\ гамма\\\ текст {триклініка} & a\ neq c &
\ альфа =\ гамма\\\ текст {Триклініка} & a\ neq c &\ альфа\\ гамма\\ =90^ {\ circ}\ neq\ бета\
\ текст {моноклінічний} & a\ neq b\ neq c &\ альфа =\ бета =\ гамма\\
\ текст {Орторомбічний} & a=b\ neq c &\ альфа =\ бета =\ гамма\\
\ текст {тетрагональний} & a = c &\ альфа =\ бета =\ beta=\ гамма = 90^ {\ circ}\
\ текст {Кубічний } & a=b\ neq c &\ альфа =\ бета = 90^ {\ circ},\ гамма = 120^ {\ circ}\
\ текст {шестикутна} & a=b = c &\ альфа =\ бета =\ гамма\ neq 90^ {\ circ}
\\ текст {ромбоедричний} & a=c h\
\ hline
\ кінець {масив}\)
Мережа ліній через точки просторової решітки (рис. 3) ділить її на одиничні осередки (див. Також рис.4). Кожна одинична комірка в просторовій решітці ідентична за розміром, формою та орієнтацією до кожної іншої одиничної клітинки. Це будівельний блок, з якого побудований кристал шляхом повторення в трьох вимірах. Одиничні осередки чотирнадцяти космічних решіток показані на рис.4. Всі кристалічні структури засновані на цих чотирнадцяти композиціях.
Кубічні, граноцентричні кубічні та шестикутні решітки, зосереджені на тілі, є загальними та мають першочергове значення в металах. Деякі метали, пов'язані з ядерним застосуванням, такі як уран і плутоній, мають кристалічні структури, які є більш складними, ніж ці три відносно прості типи. Взагалі, кристалічна кераміка також більш складна.
КЛІТИНИ ПРОТИ ПРИМІТИВНИХ КЛІТИН
У літературі ми часто знаходимо посилання на одиничні клітини і на примітивні клітини. Примітивну клітинку можна визначити як геометричну форму, яка при повторенні нескінченно в трьох вимірах заповнить весь простір і є еквівалентом одного атома. Одинична клітина відрізняється від примітивної клітинки тим, що вона не обмежується еквівалентом одного атома. У деяких випадках вони збігаються. Наприклад, на рис. 4 всі чотирнадцять космічних решіток показані одиничними осередками. З цих чотирнадцяти тільки сім (які ті?) є також примітивними клітинами.
Примітивні клітини малюються точками решітки по всіх кутах, а кожна примітивна клітина містить еквівалент одного атома. Наприклад, проста кубічна одинична клітина має атом у кожному куті. Однак у будь-якому з цих заданих кутів цей атом повинен бути розділений з сімома іншими однаковими кубами, які заповнюють об'єм навколо цієї точки. Таким чином, фактично існує лише 1/8 атома, який може бути присвоєний цій конкретній одиничній клітині. Оскільки в кубі є вісім кутів, існує еквівалент одного атома, і, таким чином, примітивна клітина і одинична клітина збігаються.
Продовжуючи, розглянемо кубічну (ОЦК) решітку, орієнтовану на тіло. У цьому випадку в центрі куба знаходиться один атом і один атом, внесений вісьмома кутами. Тоді ця клітина має два атоми і, щоб уникнути плутанини, її слід називати одиничною клітиною. У граноцентрированной кубічній решітці є шість лицьових атомів, але кожен граньовий атом розділений двома клітинами. Отже, кожна грань вносить 1/2 атома. Таким чином, грані вносять три атоми і кути один, загалом чотири атоми в одиничній клітині. Кубічну структуру, орієнтовану на обличчя (FCC), також можна розглядати як чотири взаємопроникаючі прості кубічні клітини.
При вивченні кристалів примітивна клітина має обмежене використання, оскільки одинична клітина більш наочно демонструє симетричні особливості решітки. Іншими словами, одиничну клітинку зазвичай можна легко візуалізувати, тоді як примітивна клітина не може. Наприклад, кубічна природа гранецентрированной кубічної решітки відразу видно в одиничній клітині, але вона не настільки очевидна в ромбоедричній примітивній клітині.
УПАКОВКА АТОМІВ
Кристалічна структура являє собою правильний масив атомів, розташованих на одній з чотирнадцяти космічних решіток. Найменш складними кристалічними структурами є ті, що мають один атом в кожній точці решітки. Полоній має найпростішу будову, будучи простим кубічним. У звичайних металах атоми (або позитивні іони) утримуються разом хмарою вільних електронів, так що кожен атом має тенденцію притягуватися однаково і без розбору до всіх своїх геометрично найближчих сусідів вільними електронами, що проходять між ними. Ця умова сприяє утворенню тісно упакованих структур типів, які можна продемонструвати, ефективно упаковуючи рівномірно розміщені сфери в заданий об'єм.
Ви можете краще зрозуміти упаковку, провівши експеримент наступним чином. Припустимо, що у нас є кількість невеликих сфер, які ми повинні ефективно упакувати в коробку («двовимірний» підхід може бути зроблений за допомогою жменьки копійок). Після деякого перетасування очевидно, що найбільш близька можлива упаковка виходить, коли сфери знаходяться в контакті і їх центри займають позиції, які відповідають верхівкам рівносторонніх трикутників (рис.6). Також очевидно, що існує два множини трикутників - один набір з вершинами, спрямованими від спостерігача (точки вгору), а інший набір з вершинами, спрямованими на спостерігача (точки вниз).
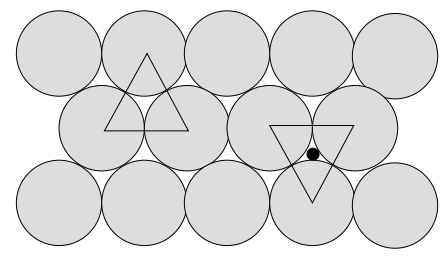
При додаванні другого шару відбувається тісна упаковка, якщо сфери в цьому новому шарі спочивають у западищах, утворених сферами першого шару. Центри сфер у другому шарі будуть лежати над центрами трикутників точки-вгору або над центрами трикутників точки-вниз, але не обидва одночасно. Який набір використовується, несуттєво. Однак для нашого обговорення припустимо, що другий шар зосереджений на трикутниках точок вгору.
Коли ми почнемо додавати третій шар, сфери знову впираються в западини, утворені сферами другого шару. І знову у нас є можливість розмістити третій шар на точках вгору або на трикутниках точок вниз. Якщо ми центруємо третій шар на трикутниках точок вниз, ми виявимо, що третій шар знаходиться безпосередньо над першим шаром. Якщо додаткові шари додаються за допомогою чергової послідовності укладання (тобто поперемінного центрування шарів на трикутниках «точки-вгору» і «точки-вниз»), послідовність може бути записана як ABABABAB. Таке розташування сфер, перекладене на розташування атомів, є гексагональної тісно упакованої (HCP) структурою - дуже важливо, але не обговорюється тут детально.
Багато елементів, що мають ковалентний зв'язок, утворюють домовленості, в яких координаційне число дорівнює (8-N), де N - кількість валентних електронів. Що ж тоді щойно продемонстровано координаційний номер структури HCP? Геометрія структури показує, що будь-який один атом має дванадцять рівновіддалених сусідів. Очевидно, що якщо в будь-якому шарі дана сфера розміщена в прилеглому шарі, вона вписується в порожнину, утворену трьома сферами, і, отже, дотична до трьох сфер в прилеглому шарі. Таким чином, будь-який даний атом у структурі HCP дотичний до дванадцяти інших атомів - шість у власному шарі і три в двох сусідніх шарах.
Коли третій шар сфер був доданий у вищезгаданому обговоренні, ми припустили, що цей шар був зосереджений на трикутниках точки вниз другого шару. Що станеться, якщо замість нього використовуються центри трикутників points-up другого шару? Розподіл сфер в третьому шарі таке ж, як і в перших двох шарах, але не лежить безпосередньо над жодним з цих двох шарів. Якщо додається четвертий шар, зосереджений на точках вгору трикутників третього шару, ми знаходимо четвертий шар безпосередньо над першим шаром і дублює його повністю. Послідовність укладання для цієї структури може бути записана як ABCABCABC. Таке розташування має таку ж щільність упаковки і той же координаційний номер, що і структура HCP. Однак це кубічна структура, орієнтована на обличчя (FCC).
Кристалічні структури HCP та FCC мають однакову щільність упаковки та однакове координаційне число. Тому ми можемо очікувати, що поведінка двох структур HCP та FCC буде дуже схожою щодо фізичних та механічних властивостей. Це, однак, в більшості випадків не так.
Максимальна щільність упаковки зустрічається тільки в кристалічних структурах HCP і FCC. Чому металевий зв'язок не завжди виробляє те чи інше з цих двох найщільніших розташування атомів, ще є предметом інтенсивних досліджень. Одинична клітина BCC містить два атоми, а координаційне число - вісім. Є часткова компенсація цього в тому, що є шість найближчих сусідів на відстанях лише трохи більше, ніж у восьми найближчих сусідів. Деякі характеристики кубічних структур наведені в таблиці II.
Цікавим прикладом типу кристалічної структури, отриманої в ковалентно зв'язаних елементах, які підпорядковуються правилу координаційного числа (8—N) (де N - кількість валентних електронів) є структура алмазу. Ця структура міститься у вуглеці, германії, кремнії та олові при низьких температурах і в певних сполуках. Кожен атом має чотирьох найближчих сусідів - конфігурацію, яку по-різному називають алмазним кубічним, чотиригранним або чотиригранним кубічним.
ТАБЛИЦЯ II. Характеристики кубічних решіток
\ (\ begin {масив} {lcccc}
&\ підкреслити {\ текст {Простий}} &\ підкреслити {\ текст {по центру тіла}} &\ підкреслити {\ текст {Face-Centered}}
\\ text {Одиниця об'єму комірки} &\ mathrm {a} ^ {3} &\ mathrm {a} 3}\
\ text {Решітка точок на Клітинка} & 1 & 2 & 4\\
\ text {Відстань найближчого сусіда} & a &\ frac {a\ sqrt {3}} {2} &\ frac {a} {\ sqrt {2}}\
\ text {Кількість найближчих сусідів} & 6 & 8 & 12\\
\ text {Друга найближча сусідська відстань} & a\ sqrt {2} & a amp; a\
\ text {Кількість других сусідів} & 12 & 6 & 6\\
\ end {масив}\)
Багато сполук кристалізуються в варіаціях кубічних форм. Наприклад, кам'яна сіль (NaCl) характерна для багатьох оксидів, фторидів, хлоридів, гідридів і карбідів. Іноді його розглядають як просту кубічну з чергуються атомами Na і Cl на кубічних кубах. Насправді структура являє собою дві взаємопроникаючі решітки FCC - одна з Na, а інша з Cl - і кут однієї знаходиться в точці 1/2, 0, 0 іншого.
Багато інших оксиди, фториди і деякі інтерметалідні сполуки мають\(\left(\mathrm{CaF}_{2}\right)\) структуру флюориту. Це\(\mathrm{FCC}\)\(\mathrm{Ca}\) у кутах кубів та центрах граней та\(\mathrm{F}\) у всіх точках чверті уздовж діагоналей куба.
РЕШІТКИ ПЛОЩИН І НАПРЯМКІВ
Бажано мати систему позначень площин всередині кристалічної або космічної решітки таку, щоб система задавала орієнтацію, не даючи положення в просторі. Для цього використовуються індекси Міллера. Ці показники базуються на перехопленнях площини з трьома осями кристалів - тобто трьома ребрами одиничної комірки. Перехоплення вимірюються з точки зору довжини країв або розмірів одиничної комірки, які є одиничними відстанями від початку по трьох осях. Наприклад, площина, яка розрізає\(x\) -вісь на відстані від початку, рівному половині\(x\) -виміру комірки, як кажуть, має\(x\) -перехоплення рівним\(1 / 2\), і якщо вона вирізає\(y\) -вісь\(1 / 2\) на\(y\) -розмірності комірки, то\(y\) - перехоплення є\(1 / 2\), незалежно від відносних величин\(x\) - і\(y\) -розмірів. Якщо площина паралельна осі, вона перехоплює вісь на нескінченності.
Для визначення індексів Міллера (hkl) площини робимо наступні кроки:
- Знайдіть перехоплення на трьох осях кратними або частками довжин ребра уздовж кожної осі.
- Визначте зворотні ці числа.
- Зменшіть зворотні до трьох найменших цілих чисел, що мають таке ж відношення, як і зворотні.
- Закріпіть ці три інтегральні числа в дужки, наприклад, (hkl).
Куб має шість рівнозначних граней. Якщо ми маємо певну орієнтацію і хочемо обговорити одну конкретну площину з цих шести, можна вказати цю площину, використовуючи відповідні індекси Міллера. Дужки використовуються навколо індексів Міллера для позначення певної площини. З іншого боку, часто вигідно говорити про площини «форми» - тобто сімейство еквівалентних площин, таких як шість граней куба. Для цього прийнято використовувати індекси Міллера, але укладати їх в фігурні дужки (дужки). Таким чином, набір граней куба може бути представлений у вигляді {100}, в якому
\(\{100\}=(100)+(010)+(001)+(\overline{100})+(0 \overline{1} 0)+(00 \overline{1})\)
Таким чином, це позначення забезпечує скорочену схему, щоб уникнути написання індексів для всіх шести граней куба.
Корисність схеми ще більш очевидна у випадку (110) площин — тобто додекаедричних площин (у кубічній системі), де
\ begin {вирівняний}
\ {110\} =& (110) + (101) + (011) + (\ overline {1} 10) + (\ overline {1} 01) + (0\ overline {1} 1)\
&+ (1\ overline {1} 0) + (10\ overline {1}) + (01\ overline {1}) + (01\ overline {1}) + (\ overline {1}) + (\ overline {1}) + (\ overline {1}) + (\ overline {1}) + (\ over{ 110}) + (\ overline {1} 0\ overline {1}) + (0\ overline {11})
\ end {вирівняний}
Еквівалентною формою для орторомбічної системи є
\ begin {вирівняний}
&\ {110\} =( 110) + (\ оверлайн {110}) + (1\ оверлайн {1} 0) + (\ оверлайн {110})\\
&\ {101\} =( 101) + (\ overline {1} 01) + (10\ overline {1}) + (\ overline {1}) + (\ overline {1}) + (\ overline {1})
&\ {011\} =( 011) + (0\ оверлайн {1} 1) + (01\ оверлайн {1}) + (0\ overline {11})
\ кінець {вирівняний}
Восьмигранні площини для куба
\ begin {вирівняний}
\ {111\} =& (111) + (\ overline {1111}) + (1\ overline {1} 1) + (11\ overline {1})\
&+ (\ overline {111}) + (\ overline {111}}) + (1\ overline {1}}) + (1\ overline {11}) + (\ overline {111})
\ кінець {вирівняний}
Індекси напряму визначаються по-іншому. Лінія будується через початок осі кристала в розглянутому напрямку і визначаються координати точки на лінії в кратних параметрам решітки одиничної комірки. Індекси напрямку приймаються як найменші цілі числа, пропорційні цим координатам і закриваються в квадратні дужки. Наприклад, припустимо, що координати є\(x=3 a, y=b\) і\(z=c / 2\), тоді найменші цілі числа, пропорційні цим трьом числам, є 6, 2 та 1, а лінія має напрямок [621]. Як подальші приклади,\(x\) -вісь має індекси напрямку [100],\(y\) -вісь [010] та\(z\) -вісь [001]. Лицьова діагональ\(x y\) грані одиничної комірки має індекси напрямку [110], а діагональ тіла клітини має індекси напрямку [111]. Негативні показники виникають, якщо будь-яка з координат від'ємна. Наприклад,\(-y\) вісь має індекси [010]. Повний набір рівнозначних напрямків, тобто напрямки форми, позначаються каретками:\(\langle u v w\rangle\).