20.1: Вуглеводні
- Page ID
- 22416
- Поясніть важливість вуглеводнів і причину їх різноманітності
- Назвіть насичені і ненасичені вуглеводні і молекули, отримані з них
- Опишіть реакції, характерні для насичених і ненасичених вуглеводнів
- Визначте структурні та геометричні ізомери вуглеводнів
Найбільша база даних 1 органічних сполук перераховує близько 10 мільйонів речовин, до яких відносяться сполуки, що походять від живих організмів і синтезовані хіміками. Кількість потенційних органічних сполук оцінюється 2 при 10 60 - астрономічно високе число. Існування такої кількості органічних молекул є наслідком здатності атомів вуглецю утворювати до чотирьох міцних зв'язків з іншими атомами вуглецю, в результаті чого утворюються ланцюги та кільця різних розмірів, форм і складнощів.
Найпростіші органічні сполуки містять тільки елементи вуглецю і водень, і називаються вуглеводнями. Незважаючи на те, що вони складаються лише з двох типів атомів, існує велика різноманітність вуглеводнів, оскільки вони можуть складатися з різної довжини ланцюгів, розгалужених ланцюгів та кілець атомів вуглецю або комбінацій цих структур. Крім того, вуглеводні можуть відрізнятися типами вуглецево-вуглецевих зв'язків, присутніх в їх молекулах. Багато вуглеводнів міститься в рослині, тварині та їх скам'янілості; інші вуглеводні були підготовлені в лабораторії. Ми використовуємо вуглеводні щодня, головним чином як паливо, такі як природний газ, ацетилен, пропан, бутан та основні компоненти бензину, дизельного палива та мазуту. Звичні пластмаси поліетилен, поліпропілен та полістирол також є вуглеводнями. Можна виділити кілька видів вуглеводнів за відмінностями в зв'язку між атомами вуглецю. Це призводить до відмінностей у геометрії та гібридизації вуглецевих орбіталів.
Алкани
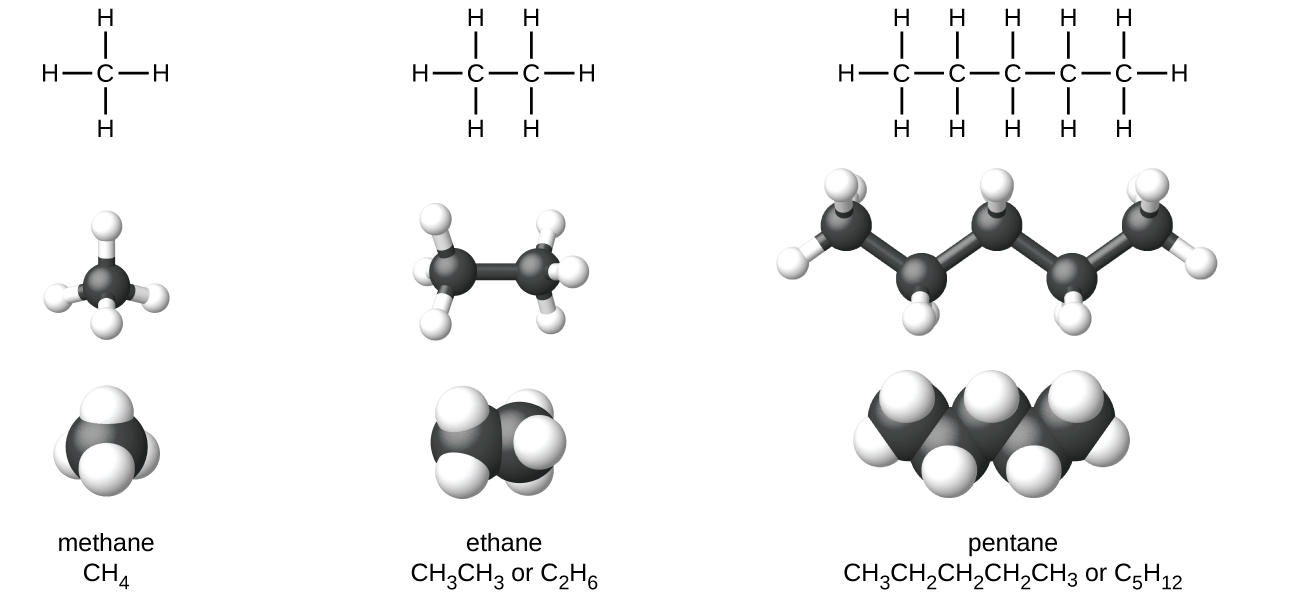
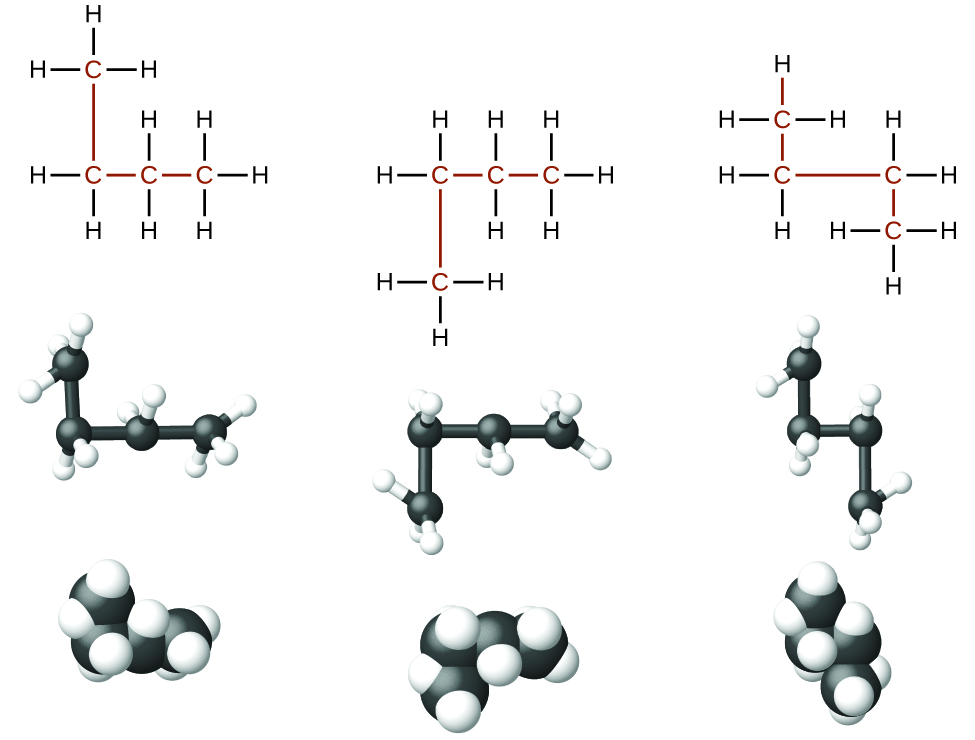
Алкани, або насичені вуглеводні, містять лише поодинокі ковалентні зв'язки між атомами вуглецю. Кожен з атомів вуглецю в алкане має sp 3 гібридні орбіталі і пов'язаний з чотирма іншими атомами, кожен з яких є або вуглецем, або воднем. Структури Льюїса та моделі метану, етану та пентану проілюстровані на малюнку\(\PageIndex{1}\). Вуглецеві ланцюги зазвичай малюються як прямі лінії в структурах Льюїса, але потрібно пам'ятати, що структури Льюїса не призначені для позначення геометрії молекул. Зверніть увагу, що атоми вуглецю в структурних моделах (моделі кульки-палиці та заповнення простору) молекули пентану не лежать у прямій лінії. Через гібридизації sp 3 кути зв'язку в вуглецевих ланцюгах близькі до 109,5°, надаючи таким ланцюгам в алкане зигзагоподібну форму.
Структури алканів та інших органічних молекул також можуть бути представлені менш детально конденсованими структурними формулами (або просто конденсованими формулами). Замість звичайного формату для хімічних формул, в якому кожен символ елемента з'являється лише один раз, записується конденсована формула, щоб запропонувати зв'язок у молекулі. Ці формули мають вигляд структури Льюїса, з якої більшість або всі символи зв'язку були видалені. Конденсовані структурні формули для етану і пентану показані внизу малюнка\(\PageIndex{1}\), а кілька додаткових прикладів наведено у вправах в кінці цієї глави.
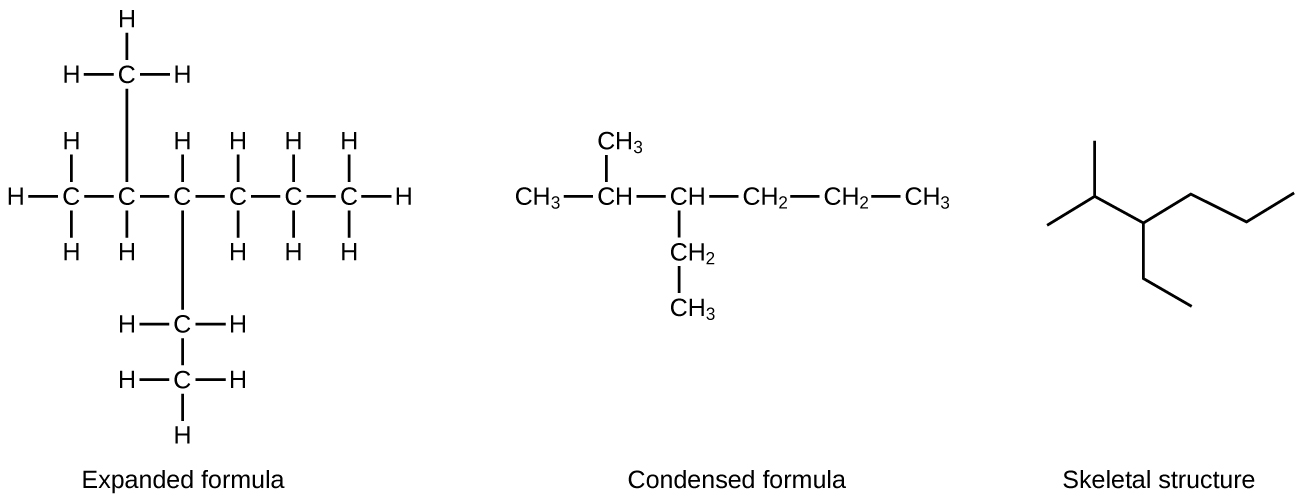
Поширеним методом, який використовують хіміки-органіки для спрощення малюнків більших молекул, є використання скелетної структури (також званої лінійно-кутовою структурою). У цьому типі структури атоми вуглецю не символізуються з C, а представлені кожним кінцем лінії або згином в лінії. Атоми водню не витягуються, якщо вони прикріплені до вуглецю. Інші атоми крім вуглецю і водню представлені їх елементарними символами. \(\PageIndex{2}\)На малюнку показано три різних способи намалювати одну і ту ж структуру.
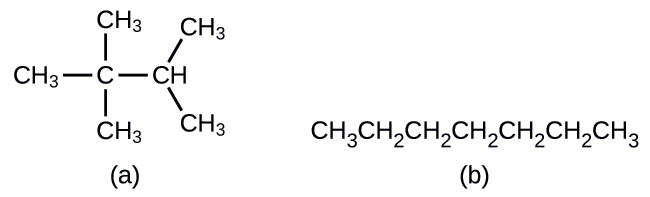
Малювання скелетних структур Намалюйте скелетні структури для цих двох молекул:
Рішення
Кожен атом вуглецю перетворюється в кінець лінії або місце, де лінії перетинаються. Всі атоми водню, прикріплені до атомів вуглецю, залишаються поза структурою (хоча нам все ще потрібно визнати, що вони є):
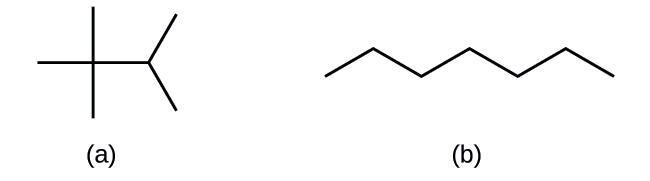
Намалюйте скелетні структури для цих двох молекул:

- Відповідь
-

У a показаний шестикутник з вершиною у верхній частині. Вершина праворуч має приєднаний відрізок лінії, який простягається вгору і вправо. У b показано зігзаг візерунок, в якому сегменти лінії піднімаються, падають, піднімаються, падають і піднімаються, рухаючись зліва направо.
Інтерпретація скелетних структур Визначте хімічну формулу молекули, представленої тут:
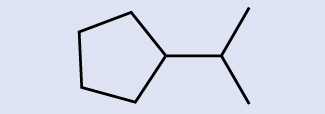
Рішення
Є вісім місць, де лінії перетинаються або закінчуються, що означає, що в молекулі є вісім атомів вуглецю. Оскільки ми знаємо, що атоми вуглецю, як правило, утворюють чотири зв'язки, кожен атом вуглецю матиме кількість атомів водню, необхідних для чотирьох зв'язків. Ця сполука містить 16 атомів водню для молекулярної формули C 8 H 16.
Розташування атомів водню:
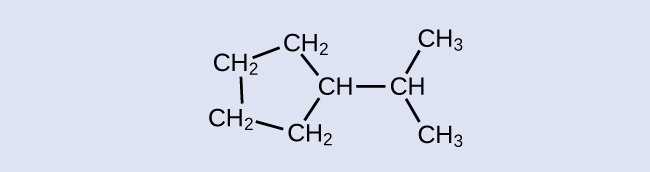
Визначте хімічну формулу молекули, представленої тут:
- Відповідь
-
З 9 Ч 20
Всі алкани складаються з атомів вуглецю та водню і мають подібні зв'язки, структури та формули; всі нециклічні алкани мають формулу C n H 2n +2. Кількість атомів вуглецю, присутніх в алкані, не має меж. Більша кількість атомів у молекулах призведе до сильніших міжмолекулярних атракціонів (сил дисперсії) і відповідно до різних фізичних властивостей молекул. Такі властивості, як температура плавлення і температура кипіння (таблиця\(\PageIndex{1}\)), зазвичай змінюються плавно і передбачувано в міру зміни кількості атомів вуглецю і водню в молекулах.
| Алкан | Молекулярна формула | Температура плавлення (° C) | Температура кипіння (° C) | Фаза при СТП 4 | Кількість структурних ізомерів |
|---|---|---|---|---|---|
| метан | СН 4 | —182,5 | —161,5 | газ | 1 |
| етану | С 2 Ч 6 | —183,3 | —88.6 | газ | 1 |
| пропан | С 3 Ч 8 | —187,7 | —42.1 | газ | 1 |
| бутан | З 4 Ч 10 | —138,3 | —0,5 | газ | 2 |
| пентан | З 5 Ч 12 | —129,7 | 36.1 | рідкий | 3 |
| гексан | С 6 Ч 14 | —95,3 | 68.7 | рідкий | 5 |
| гептан | С 7 Ч 16 | —90,6 | 98.4 | рідкий | 9 |
| октан | З 8 Ч 18 | —56.8 | 125.7 | рідкий | 18 |
| нонан | З 9 Ч 20 | —53,6 | 150.8 | рідкий | 35 |
| декан | С 10 Ч 22 | —29.7 | 174.0 | рідкий | 75 |
| тетрадекан | С 14 Ч 30 | 5.9 | 253.5 | твердий | 1858 |
| октадекан | С 18 Ч 38 | 28.2 | 316.1 | твердий | 60 523 |
Вуглеводні з однаковою формулою, включаючи алкани, можуть мати різну структуру. Наприклад, два алкани мають формулу C 4 H 10: Вони називаються n -бутан і 2-метилпропан (або ізобутан), і мають такі структури Льюїса:
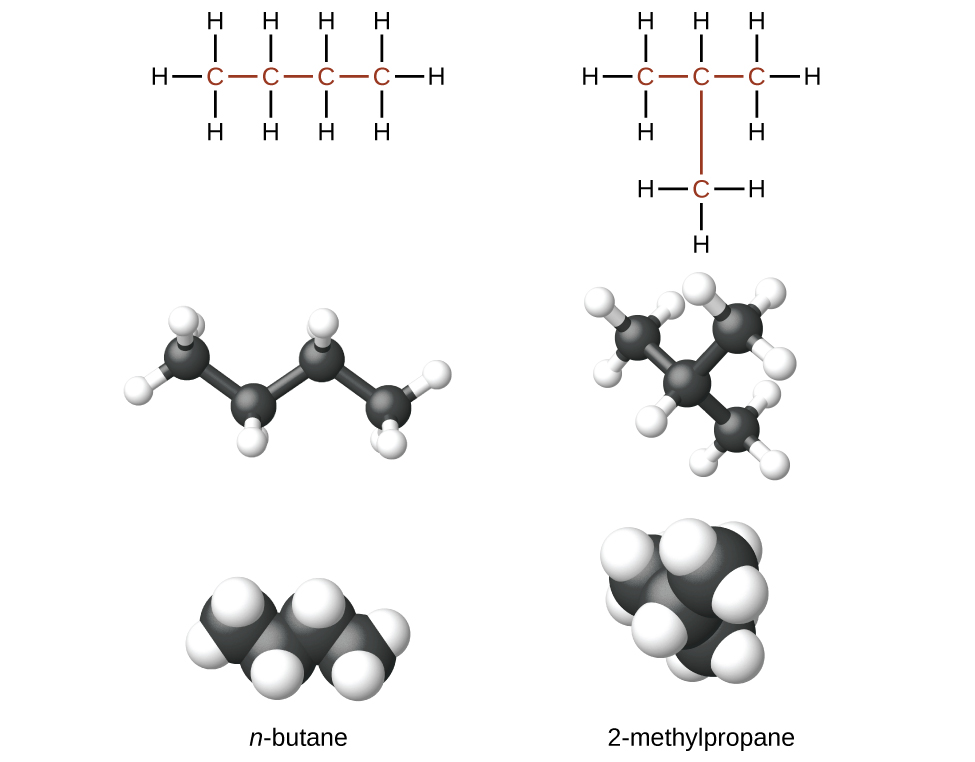
Сполуки n -бутан і 2-метилпропан є структурними ізомерами (також зазвичай використовується термін конституційні ізомери). Конституційні ізомери мають однакову молекулярну формулу, але різні просторові розташування атомів у їх молекулах. Молекула n -бутану містить нерозгалужений ланцюг, що означає, що жоден атом вуглецю не пов'язаний з більш ніж двома іншими атомами вуглецю. Ми використовуємо термін нормальний, або префікс n, для позначення ланцюга атомів вуглецю без розгалуження. З'єднання 2-метилпропан має розгалужену ланцюг (атом вуглецю в центрі структури Льюїса пов'язаний з трьома іншими атомами вуглецю)
Ідентифікувати ізомери з структур Льюїса не так просто, як здається. Структури Льюїса, які виглядають по-різному, можуть насправді представляти однакові ізомери. Наприклад, три структури на малюнку\(\PageIndex{3}\) всі представляють одну і ту ж молекулу, n -бутан, і, отже, не відрізняються ізомерами. Вони ідентичні тому, що кожен містить нерозгалужену ланцюжок з чотирьох атомів вуглецю.
Основи органічної номенклатури: іменування алканів
Міжнародний союз чистої та прикладної хімії (IUPAC) розробив систему номенклатури, яка починається з назв алканів і може бути скоригована звідти для обліку більш складних структур. Номенклатура для алканів заснована на двох правилах:
- Щоб назвати алкан, спочатку визначте найдовший ланцюг атомів вуглецю в його структурі. Двовуглецевий ланцюг називається етаном; тривуглецевий ланцюг, пропан; і чотиривуглецевий ланцюг - бутан. Довші ланцюги називаються наступним чином: пентан (п'ятивуглецевий ланцюг), гексан (6), гептан (7), октан (8), нонан (9) і декан (10). Ці приставки можна побачити в назвах алканів, описаних в табл\(\PageIndex{1}\).
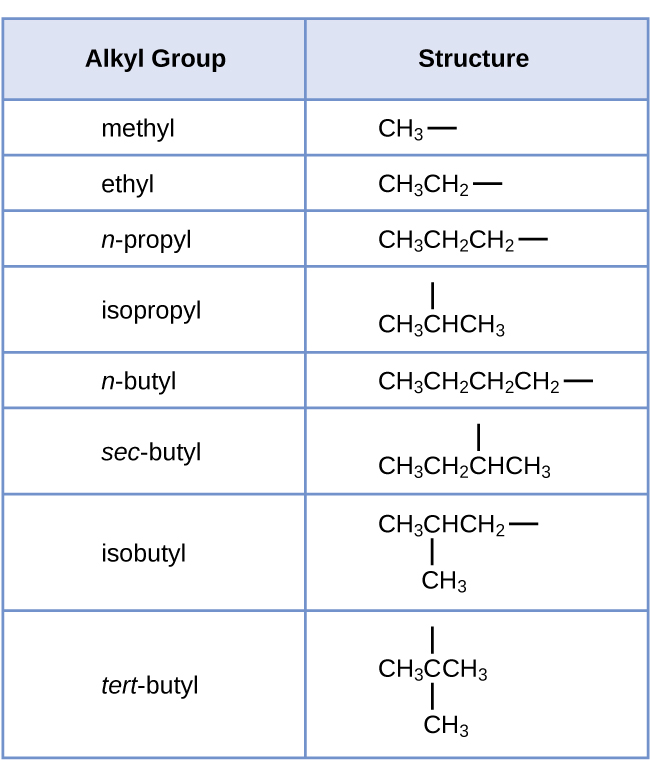
- Додайте префікси до назви найдовшого ланцюжка, щоб вказати позиції та назви замінників. Замісники - це гілки або функціональні групи, які замінюють атоми водню на ланцюжку. Положення замінника або гілки ідентифікується за номером атома вуглецю, з яким він пов'язаний в ланцюжку. Нумеруємо атоми вуглецю в ланцюжку, відраховуючи від кінця ланцюга найближчих замісників. Кілька замісників називаються індивідуально і розміщуються в алфавітному порядку на передній частині назви.
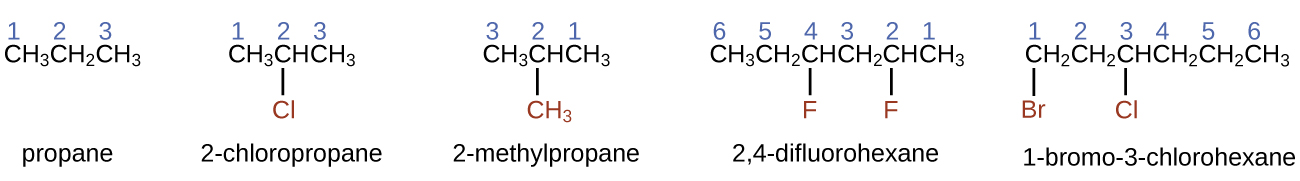
Коли присутній більше одного замінника, або на одному атомі вуглецю, або на різних атомах вуглецю, замісники перераховуються в алфавітному порядку. Оскільки нумерація атомів вуглецю починається в кінці, найближчому до замісника, найдовший ланцюг атомів вуглецю нумерується таким чином, щоб отримати найменшу кількість для замісників. Закінчення -o замінює -ide в кінці назви електронегативного замісника (в іонних сполуках негативно заряджений іон закінчується на -ide подібний хлорид; в органічних сполуках такі атоми розглядаються як замісники і використовується закінчення -o). Кількість однотипних замінників вказується приставками ді- (два), три - (три), тетра - (чотири) і так далі (наприклад, дифторо- вказує на два фторидних замінника).
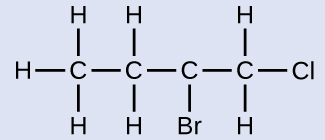
Назвіть молекулу, будова якої наведено тут:
Рішення
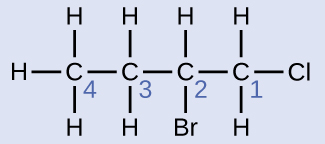
Чотиривуглецевий ланцюг нумерується з кінця атомом хлору. Це ставить замінники на позиції 1 і 2 (нумерація з іншого кінця поставила б замінники на позиції 3 і 4). Чотири атома вуглецю означають, що базовою назвою цієї сполуки буде бутан. Бром в позиції 2 буде описаний додаванням 2-бромо-; це прийде на початку назви, оскільки бромо- стоїть перед хлоро- алфавітно. Хлор у положенні 1 буде описаний додаванням 1-хлоро-, в результаті чого назва молекули - 2-бром-1-хлорбутан.
Назвіть наступну молекулу:
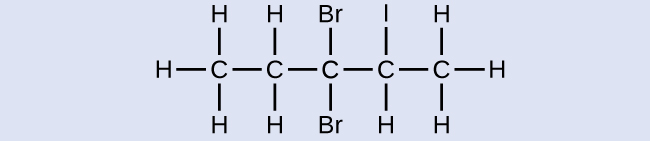
- Відповідь
-
3,3-дибром-2-йодопентан
Ми називаємо замісник, який містить на один менше водню, ніж відповідний алкан алкільною групою. Назва алкільної групи отримують шляхом скидання суфікса -ane алканового імені і додавання -іл:
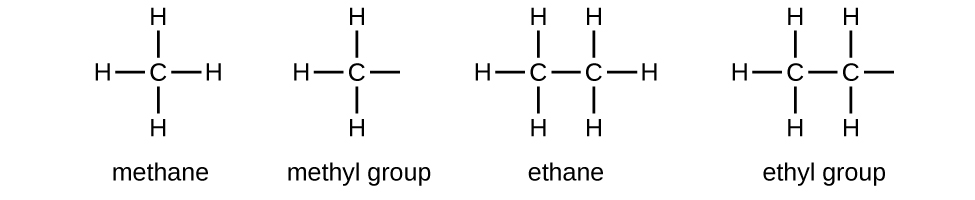
Відкриті зв'язки в метильній і етиловій групах вказують на те, що ці алкільні групи пов'язані з іншим атомом.
Назвіть молекулу, будова якої наведено тут:
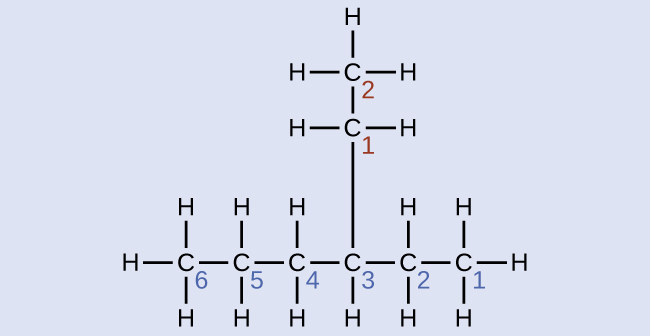
Рішення
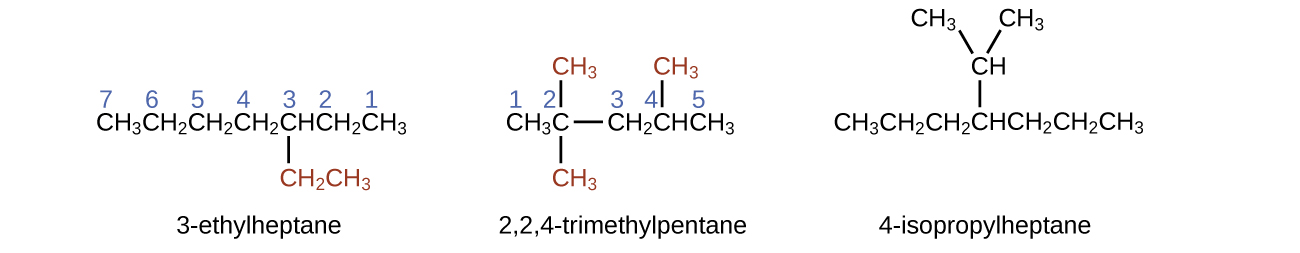
Найдовший вуглецевий ланцюг проходить горизонтально по всій сторінці і містить шість атомів вуглецю (це робить основу назви гексан, але нам також потрібно буде включити назву гілки). У цьому випадку ми хочемо пронумерувати справа наліво (як показано синіми цифрами), тому гілка підключена до вуглецю 3 (уявіть цифри зліва направо - це поставило б гілку на вуглець 4, порушуючи наші правила). Гілка, прикріплена до позиції 3 нашого ланцюга, містить два атоми вуглецю (пронумеровані червоним кольором) - тому ми беремо своє ім'я для двох вуглеводів eth- і приєднуємо -yl в кінці, щоб позначити, що ми описуємо гілку. Збираючи всі шматки воєдино, ця молекула являє собою 3-етилгексан.
Назвіть наступну молекулу:

- Відповідь
-
4-пропілоктан
Деякі вуглеводні можуть утворювати більше одного типу алкільної групи, коли атоми водню, які будуть видалені, мають різні «середовища» в молекулі. Цю різноманітність можливих алкільних груп можна визначити наступним чином: чотири атоми водню в молекулі метану еквівалентні; всі вони мають однакове середовище. Вони еквівалентні тому, що кожен пов'язаний з атомом вуглецю (тим самим атомом вуглецю), який пов'язаний з трьома атомами водню. (Може бути простіше побачити еквівалентність в м'ячі та палиці моделей на малюнку\(\PageIndex{3}\). Видалення будь-якого з чотирьох атомів водню з метану утворює метильну групу. Так само шість атомів водню в етані еквівалентні, і видалення будь-якого з цих атомів водню виробляє етилову групу. Кожен з шести атомів водню пов'язаний з атомом вуглецю, який пов'язаний з двома іншими атомами водню і атомом вуглецю. Однак як у пропані, так і в 2-метилпропані є атоми водню в двох різних середовищах, що відрізняються сусідніми атомами або групами атомів:
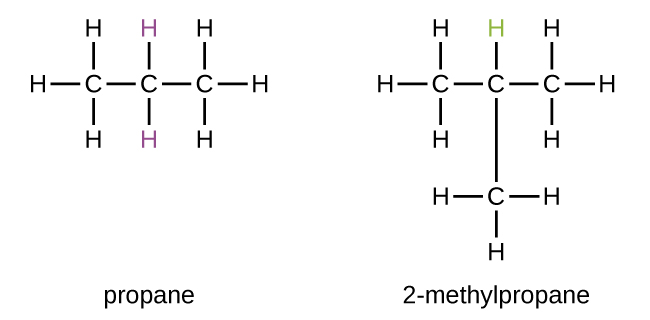
Зверніть увагу, що алкільні групи не існують як стабільні незалежні сутності. Вони завжди є частиною якоїсь більшої молекули. Розташування алкільної групи на вуглеводневому ланцюжку вказується так само, як і будь-який інший замінник:
Алкани є відносно стабільними молекулами, але тепло або світло активують реакції, які передбачають розрив одиночних зв'язків С—Н або С—С. Горіння є однією з таких реакцій:
\[\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(g) \nonumber \]
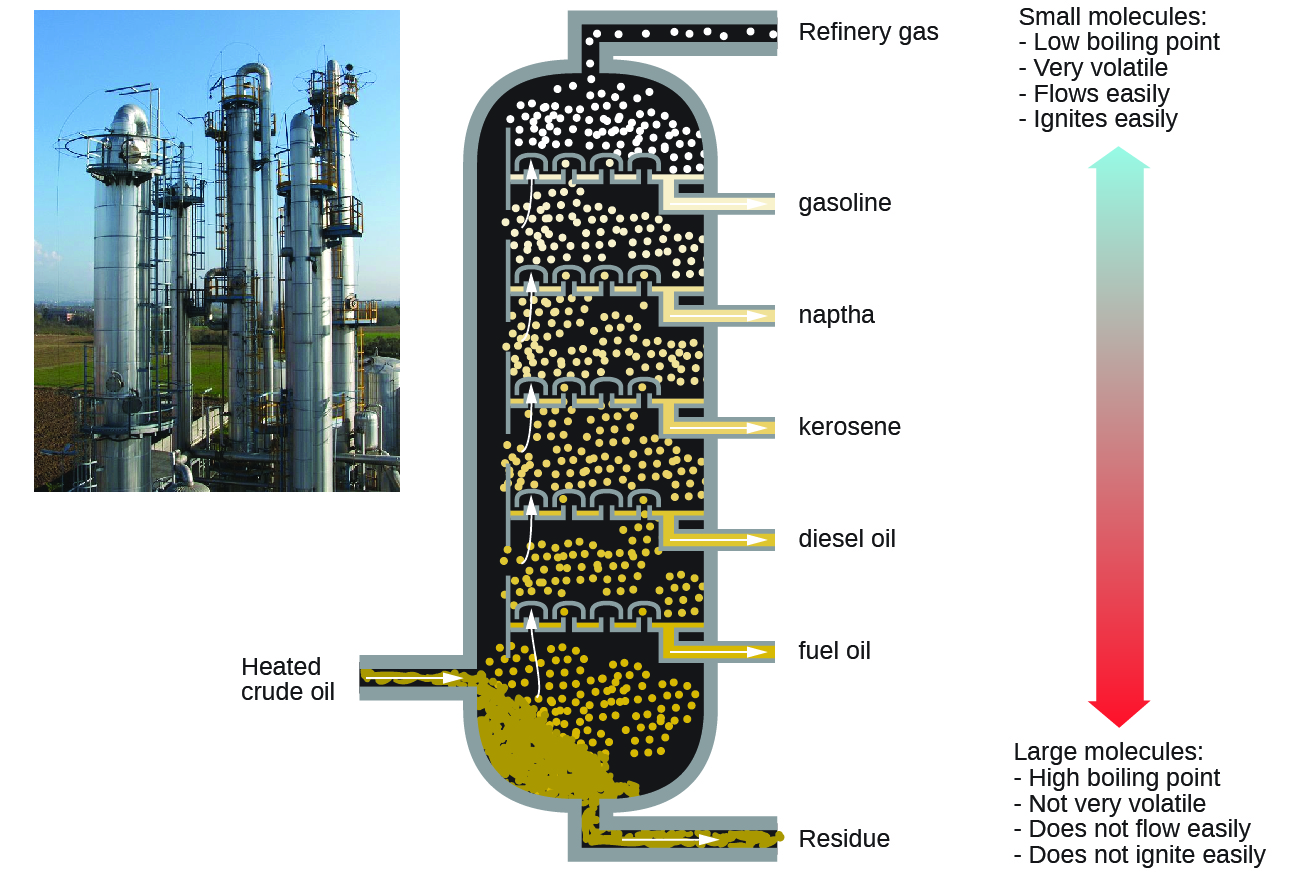
Алкани горять в присутності кисню, високоекзотермічна окислювально-відновна реакція, яка виробляє вуглекислий газ і воду. Як наслідок, алкани є відмінним паливом. Наприклад, метан, CH 4, є основним компонентом природного газу. Бутан, С 4 Н 10, використовується в кемпінгових печах і запальничках є алкан. Бензин являє собою рідку суміш алканів безперервного і розгалуженого ланцюга, кожен з яких містить від п'яти до дев'яти атомів вуглецю, плюс різні добавки для поліпшення його характеристик в якості палива. Гас, дизельне паливо і мазут - це перш за все суміші алканів з більш високими молекулярними масами. Основним джерелом цих рідких алканових палив є сира нафта, складна суміш, яка відокремлюється шляхом фракційної перегонки. Фракційна перегонка використовує відмінності в температурах кипіння компонентів суміші (рис.\(\PageIndex{5}\)). Ви можете згадати, що температура кипіння - це функція міжмолекулярних взаємодій, про яку йшла мова в розділі про розчини і колоїди.
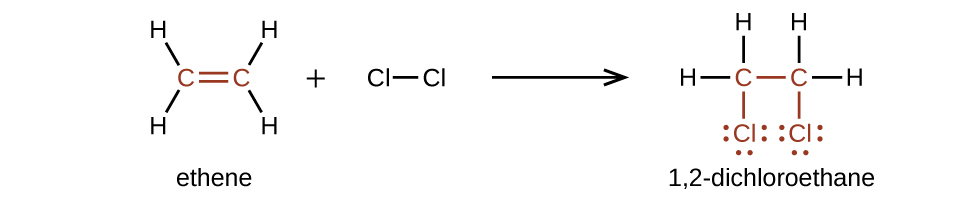
У реакції заміщення інша типова реакція алканів, один або кілька атомів водню алкана замінюються іншим атомом або групою атомів. Ніякі вуглецево-вуглецеві зв'язки в цих реакціях не порушуються, і гібридизація атомів вуглецю не змінюється. Наприклад, реакція між етаном і молекулярним хлором, зображена тут, є реакцією заміщення:
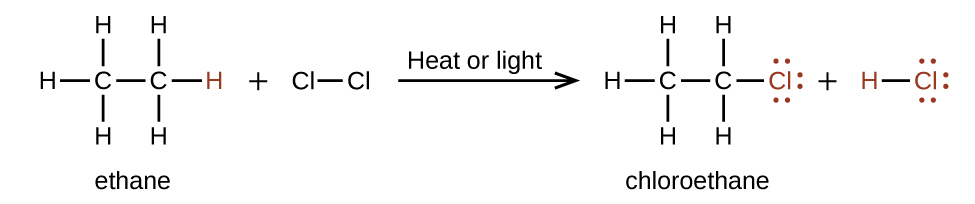
Частина C—Cl молекули хлоретану є прикладом функціональної групи, частини або фрагмента молекули, яка надає специфічну хімічну реакційну здатність. Типи функціональних груп, присутні в органічній молекулі, є основними детермінантами її хімічних властивостей і використовуються як засіб класифікації органічних сполук, як детально описано в інших розділах цієї глави.
Алкени
Органічні сполуки, що містять одну або кілька подвійних або потрійних зв'язків між атомами вуглецю, описуються як ненасичені. Ви, швидше за все, чули про ненасичені жири. Це складні органічні молекули з довгими ланцюгами атомів вуглецю, які містять хоча б одну подвійну зв'язок між атомами вуглецю. Ненасичені молекули вуглеводнів, які містять одну або кілька подвійних зв'язків, називаються алкенами. Атоми вуглецю, пов'язані подвійним зв'язком, пов'язані між собою двома зв'язками, однією σ зв'язком і однією π зв'язком. Подвійні та потрійні зв'язки породжують різну геометрію навколо атома вуглецю, який бере участь в них, що призводить до важливих відмінностей у молекулярній формі та властивостях. Різні геометрії відповідають за різні властивості ненасичених порівняно з насиченими жирами.
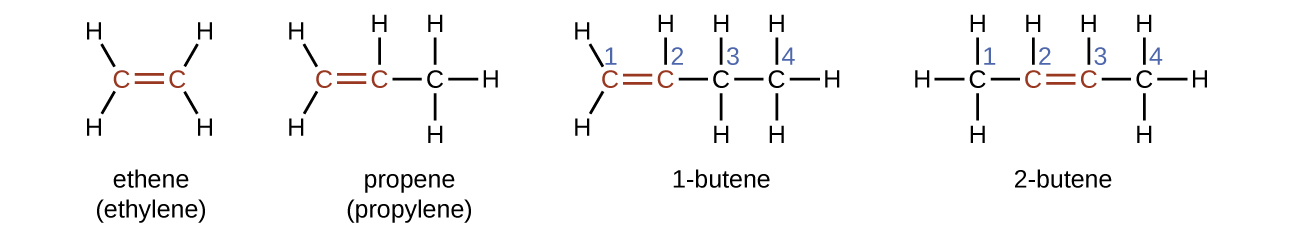
Етен, С 2 Н 4, є найпростішим алкеном. Кожен атом вуглецю в етені, який зазвичай називають етиленом, має тригональну плоску структуру. Другий член ряду - пропен (пропілен) (рис.\(\PageIndex{6}\)); в ряду слідують ізомери бутену. Чотири атома вуглецю в ланцюжку бутену дозволяють утворювати ізомери на основі положення подвійного зв'язку, а також нової форми ізомерії.
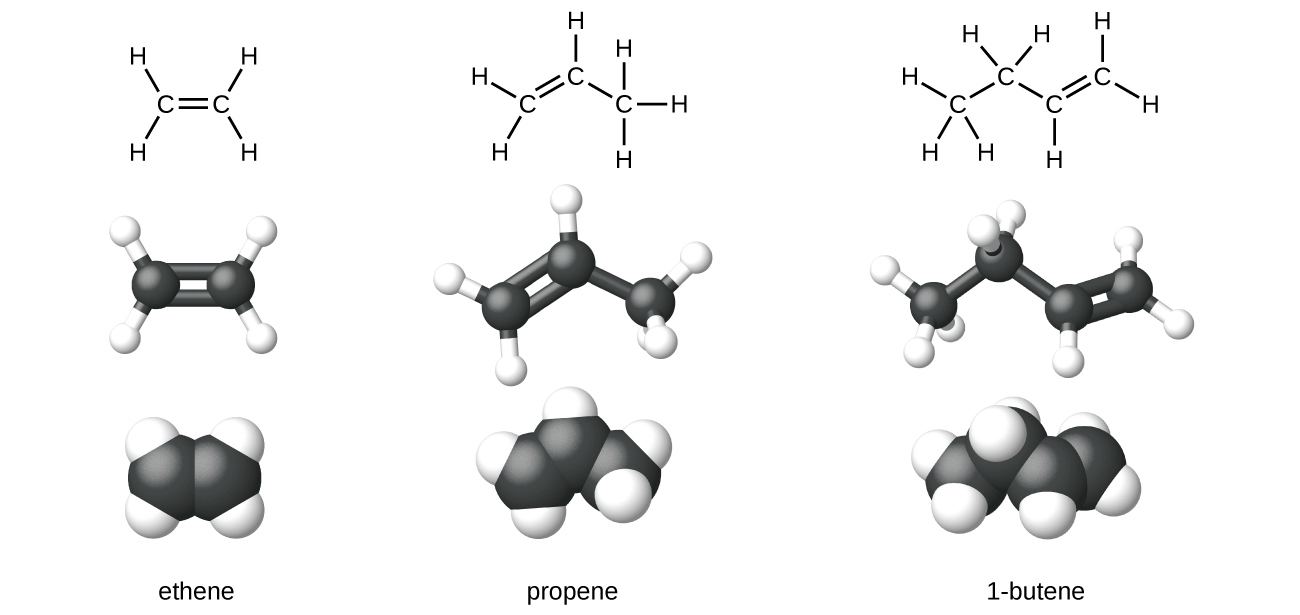
Етилен (загальна промислова назва етилену) є основною сировиною при виробництві поліетилену та інших важливих сполук. У 2010 році у всьому світі було вироблено понад 135 мільйонів тонн етилену для використання в полімерній, нафтохімічній та пластмасовій промисловості. Етилен виробляється промисловим шляхом в процесі, званому крекінгом, в якому довгі вуглеводневі ланцюги в нафтової суміші розбиваються на більш дрібні молекули.
Переробка пластмас
Полімери (від грецьких слів poly означає «багато» і мер означає «частини») - це великі молекули, що складаються з повторюваних одиниць, що називаються мономерами. Полімери можуть бути природними (крохмаль - це полімер залишків цукру, а білки - полімери амінокислот) або синтетичними [як поліетилен, полівінілхлорид (ПВХ) та полістирол]. Різноманітність структур полімерів перетворюється на широкий спектр властивостей і застосувань, які роблять їх невід'ємними частинами нашого повсякденного життя. Додавання функціональних груп до структури полімеру може призвести до значно різних властивостей (див. Дискусію про кевлар далі в цьому розділі).
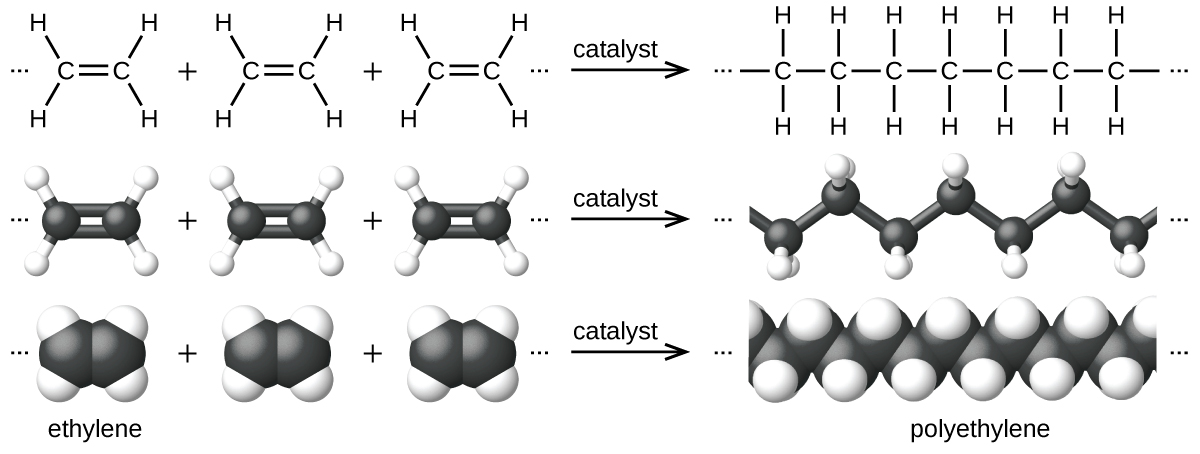
Приклад реакції полімеризації показаний на рис\(\PageIndex{7}\). Мономерний етилен (C 2 H 4) - це газ при кімнатній температурі, але при полімеризації, використовуючи каталізатор перехідного металу, він перетворюється на твердий матеріал, що складається з довгих ланцюгів —CH 2 - одиниць, що називаються поліетиленом. Поліетилен - товарний пластик, який використовується переважно для упаковки (пакетів і плівок).
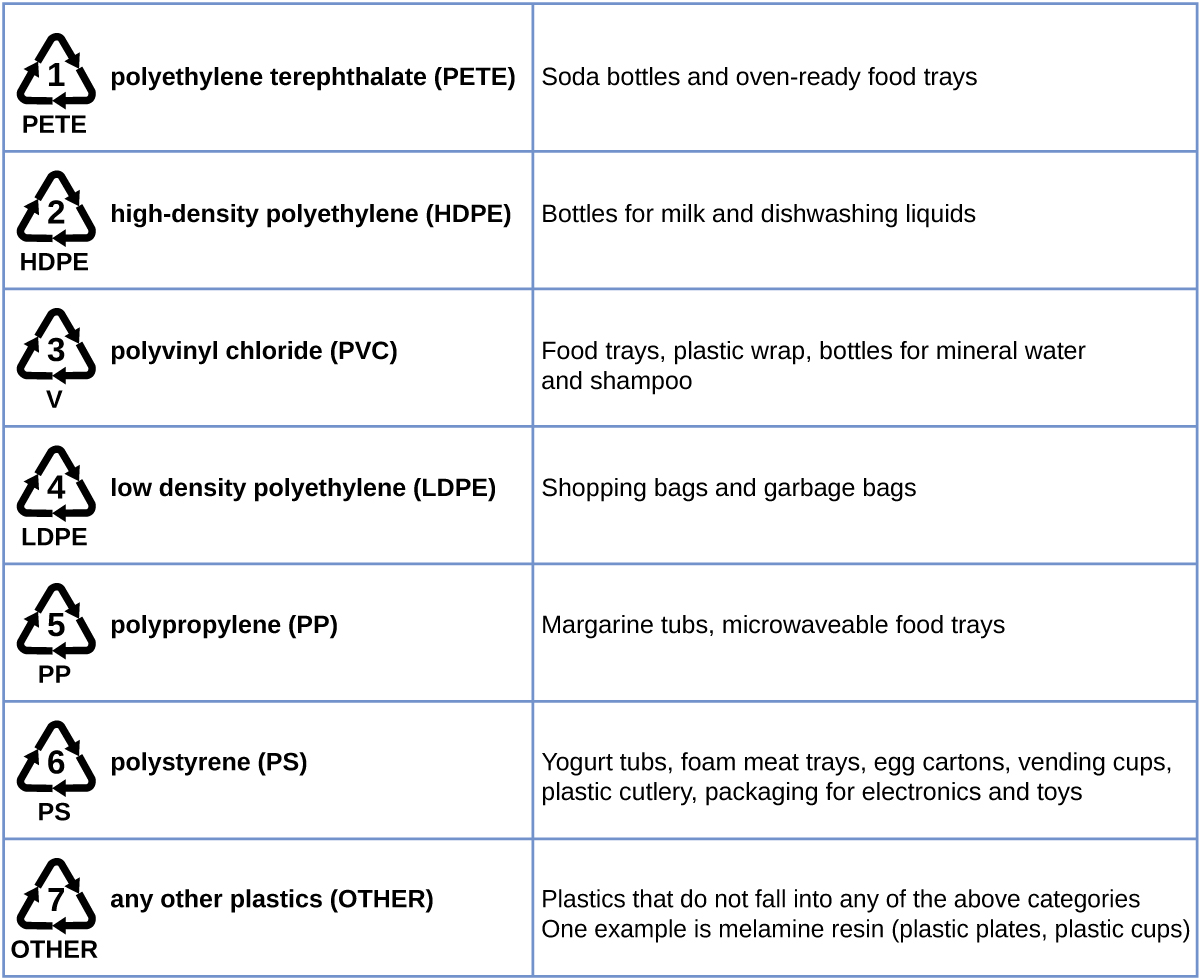
Поліетилен входить до складу однієї підмножини синтетичних полімерів, що класифікуються як пластмаси. Пластмаси - це синтетичні органічні тверді речовини, які можна формувати; вони, як правило, органічні полімери з високими молекулярними масами. Більшість мономерів, що входять у звичайні пластмаси (етилен, пропілен, вінілхлорид, стирол та етилентерефталат), походять з нафтохімічних речовин і не дуже біологічно розкладаються, що робить їх кандидатськими матеріалами для переробки. Переробка пластмас допомагає мінімізувати потребу у використанні більшої кількості нафтохімічних запасів, а також мінімізує екологічну шкоду, спричинену викиданням цих небіологічно розкладаються матеріалів.
Переробка пластмас - це процес відновлення відходів, брухту або використаних пластмас та переробки матеріалу на корисні продукти. Наприклад, поліетилентерефталат (пляшки з безалкогольними напоями) можна розплавити і використовувати для пластикових меблів, в килимах або для інших застосувань. Інші пластмаси, такі як поліетилен (мішки) та поліпропілен (чашки, пластикові контейнери для харчових продуктів), можуть бути перероблені або перероблені для повторного використання. У багатьох районах країни є програми переробки, які зосереджені на одному або декількох товарних пластмасах, яким присвоєно код переробки (рис.\(\PageIndex{8}\)). Ці операції діють з 1970-х років і зробили виробництво деяких пластмас одним з найбільш ефективних промислових операцій сьогодні.
Назва алкена походить від назви алкана з такою ж кількістю атомів вуглецю. Наявність подвійного зв'язку позначається заміною суфікса -ane на суфікс -ene. Розташування подвійного зв'язку ідентифікується шляхом іменування меншого з чисел атомів вуглецю, що беруть участь в подвійному зв'язку:
Ізомери алкенів
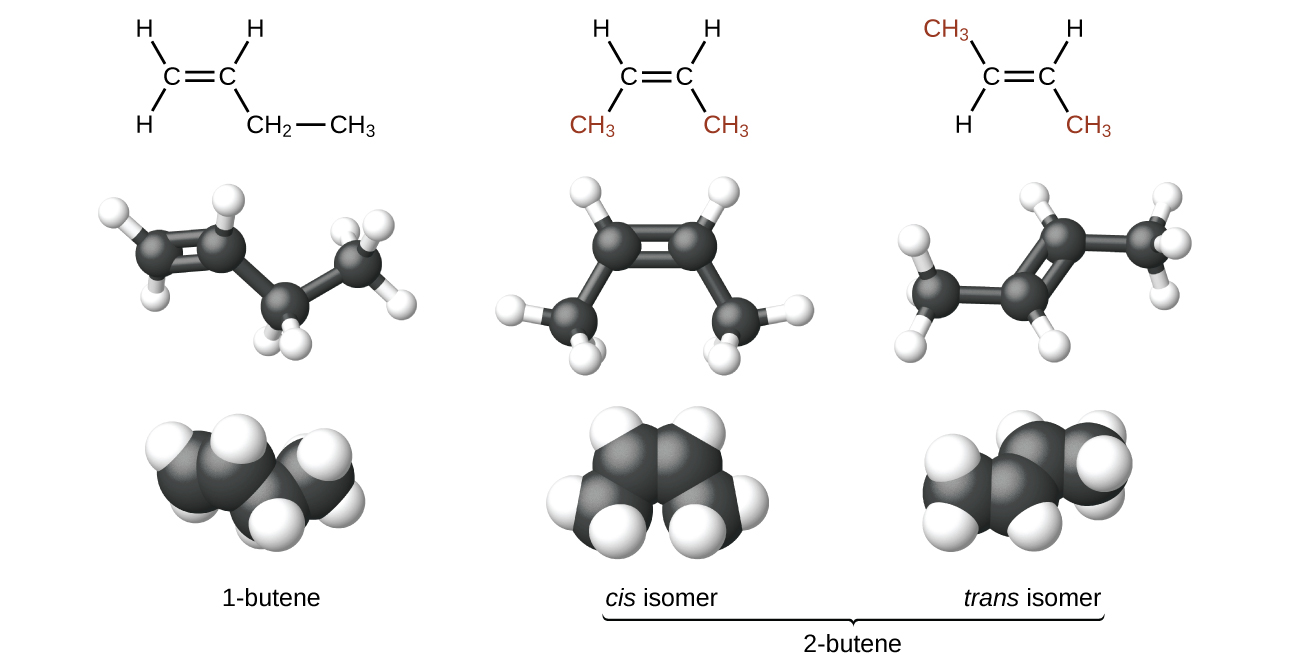
Молекули 1-бутену і 2-бутену є структурними ізомерами; розташування атомів в цих двох молекулах відрізняється. Як приклад відмінностей розташування, перший атом вуглецю в 1-бутені пов'язаний з двома атомами водню; перший атом вуглецю в 2-бутені пов'язаний з трьома атомами водню.
З'єднання 2-бутен і деякі інші алкени також утворюють другий тип ізомеру, який називається геометричним ізомером. У наборі геометричних ізомерів однакові типи атомів прикріплені один до одного в одному порядку, але геометрії двох молекул відрізняються. Геометричні ізомери алкенів відрізняються орієнтацією груп по обидва боки\(\mathrm{C=C}\) зв'язку.
Атоми вуглецю можуть вільно обертатися навколо одного зв'язку, але не навколо подвійного зв'язку; подвійний зв'язок жорсткий. Це дозволяє мати два ізомери 2-бутену, один з обома метильними групами на одній стороні подвійного зв'язку і один з метильними групами з протилежних сторін. Коли структури бутену малюються з кутами зв'язку 120° навколо sp 2 -гібридизованих атомів вуглецю, які беруть участь у подвійному зв'язку, ізомери очевидні. Ізомер 2-бутену, в якому дві метильні групи знаходяться на одній стороні, називається цис-ізомером; той, в якому дві метильні групи знаходяться з протилежних сторін, називається транс-ізомером (рис.\(\PageIndex{9}\)). Різні геометрії дають різні фізичні властивості, такі як температура кипіння, що може зробити поділ ізомерів можливим:
Алкени набагато більш реактивні, ніж алкани, оскільки\(\mathrm{C=C}\) фрагмент є реактивною функціональною групою. А π зв'язок, будучи слабшою зв'язком, порушується набагато легше, ніж зв'язок σ. Таким чином, алкени проходять характерну реакцію, при якій π зв'язок розривається і замінюється двома σ зв'язками. Ця реакція називається реакцією приєднання. Гібридизація атомів вуглецю в подвійному зв'язку в алкені змінюється від sp 2 до sp 3 під час реакції приєднання. Наприклад, галогени додають до подвійного зв'язку в алкені замість заміни водню, як це відбувається в алкане:
Надайте назви IUPAC для реагенту та продукту реакції галогенізації, показаних тут:
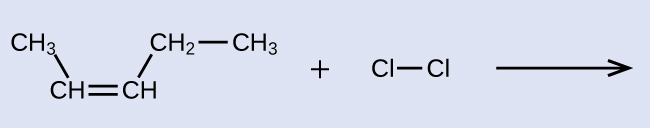
Рішення
Реагент - це п'ятивуглецевий ланцюг, який містить подвійний зв'язок вуглецево-вуглецевої, тому базовою назвою буде пентен. Ми починаємо відлік в кінці ланцюга, найближчого до подвійного зв'язку - в цьому випадку, зліва - подвійний зв'язок охоплює вуглеці 2 і 3, тому назва стає 2-пентеном. Оскільки існують дві вуглецеві групи, прикріплені до двох атомів вуглецю в подвійному зв'язку - і вони знаходяться на одній стороні подвійного зв'язку - ця молекула є цис-ізомером, що робить назву початкового алкену цис-2-пентена. Продукт реакції галогенізації матиме два атоми хлору, прикріплені до атомів вуглецю, які входили до складу подвійного зв'язку вуглець-вуглець:
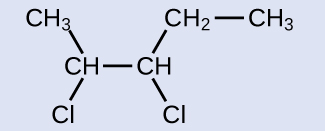
Ця молекула тепер є заміщеним алканом і буде названа як така. Основою імені буде пентан. Ми порахуємо з кінця, що цифри атомів вуглецю, де атоми хлору приєднані, як 2 і 3, роблячи назву продукту 2,3-дихлорпентан.
Надайте назви для реагенту та продукту реакції, показаної:
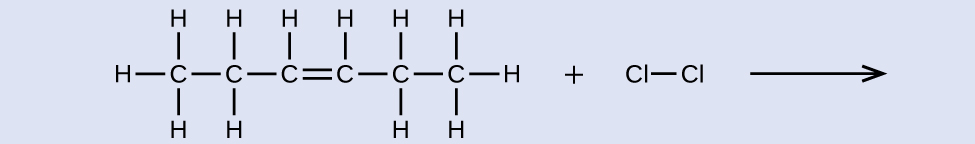
- Відповідь
-
реагент: цис-3-гексен, продукт: 3,4-дихлоргексан
Алкіни
Молекули вуглеводнів з однією або декількома потрійними зв'язками називаються алкіни; вони складають ще один ряд ненасичених вуглеводнів. Два атома вуглецю, з'єднані потрійним зв'язком, пов'язані між собою однією σ зв'язком і двома π зв'язками. Sp -гібридизовані вуглеці, що беруть участь у потрійному зв'язку, мають кути зв'язку 180°, надаючи цим типам зв'язків лінійну, стрижнеподібну форму.
Найпростішим членом алкінного ряду є етин, C 2 H 2, який зазвичай називають ацетиленом. Структура Льюїса для етину, лінійної молекули, становить:
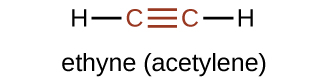
Номенклатура IUPAC для алкінів аналогічна номенклатурі для алкенів, за винятком того, що суфікс -yne використовується для позначення потрійного зв'язку в ланцюзі. Наприклад,\(\mathrm{CH_3CH_2C≡CH}\) називається 1-бутином.
Опишіть геометрію і гібридизацію атомів вуглецю в наступній молекулі:
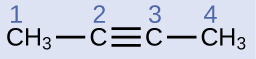
Рішення
Атоми вуглецю 1 і 4 мають чотири одиночних зв'язку і, таким чином, тетраедричні з sp 3 гібридизації. Атоми вуглецю 2 і 3 беруть участь у потрійному зв'язку, тому вони мають лінійну геометрію і будуть класифіковані як sp гібриди.
Визначте кути гібридизації та зв'язку на атомах вуглецю в молекулі показано:
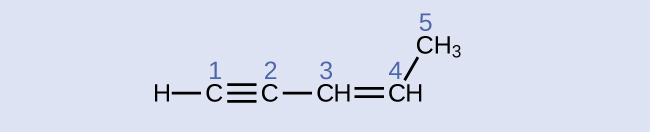
- Відповідь
-
вуглець 1: sp, 180°; вуглець 2: sp, 180°; вуглець 3: сп 2, 120°; вуглець 4: SP 2, 120°; вуглець 5: SP 3, 109.5°
Хімічно алкіни схожі на алкени. Оскільки\(\mathrm{C≡C}\) функціональна група має дві π зв'язки, алкіни, як правило, реагують ще легше, і реагують з удвічі більшою кількістю реагенту на додаток реакцій. Реакція ацетилену з бромом - типовий приклад:
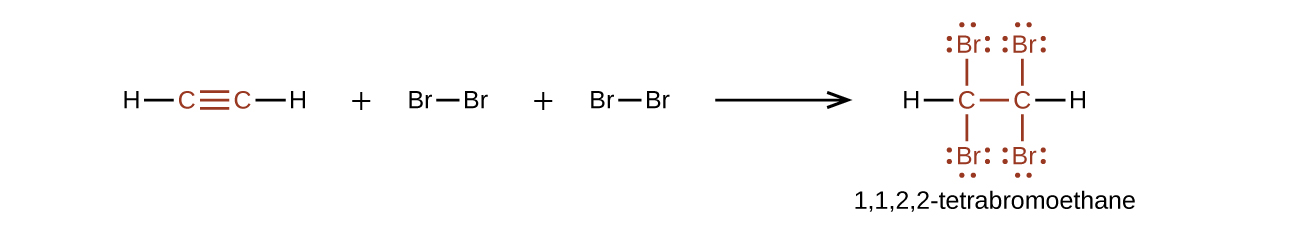
Ацетилен та інші алкіни також легко згоряють. Ацетиленовий факел використовує високу теплоту згоряння ацетилену.
ароматичні вуглеводні
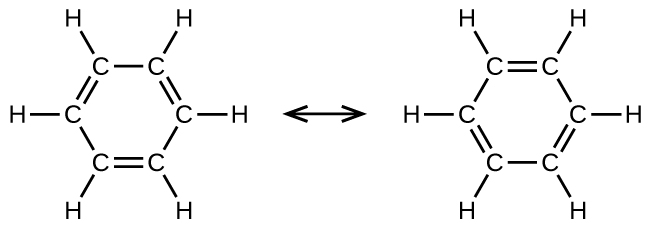
Бензол, С 6 Н 6, є найпростішим членом великого сімейства вуглеводнів, званих ароматичними вуглеводнями. Ці сполуки містять кільцеві структури та демонструють зв'язок, який повинен бути описаний за допомогою резонансної гібридної концепції теорії валентних зв'язків або концепції делокалізації молекулярної орбітальної теорії. (Щоб переглянути ці поняття, зверніться до попередніх розділів, присвячених хімічному зв'язуванню). Резонансними структурами для бензолу, С 6 Н 6, є:

Існує безліч похідних бензолу. Атоми водню можуть бути замінені багатьма різними замінниками. Ароматичні сполуки легше піддаються реакціям заміщення, ніж реакції приєднання; заміна одного з атомів водню іншим замісником залишить делокалізовані подвійні зв'язки недоторканими. Нижче наведено типові приклади заміщених похідних бензолу:
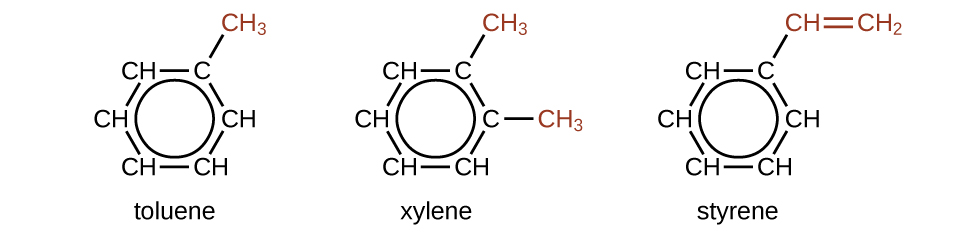
Толуол і ксилол є важливими розчинниками та сировиною в хімічній промисловості. Для виробництва полімерного полістиролу використовують стирол.
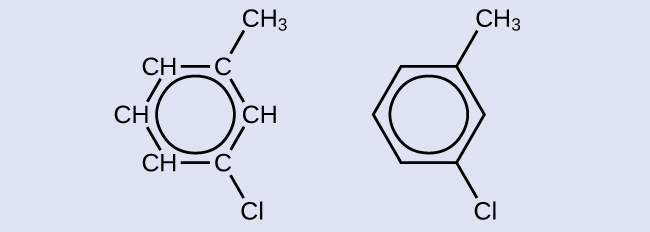
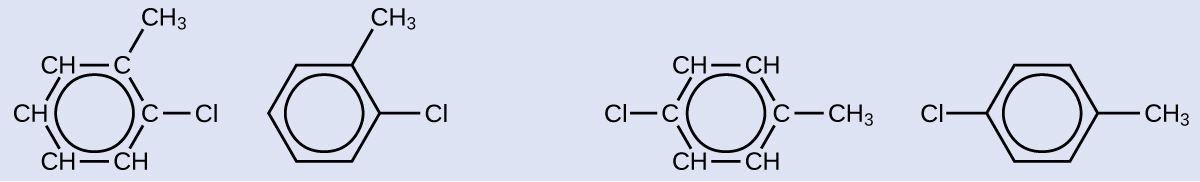
Тут показаний один можливий ізомер, створений реакцією заміщення, яка замінює атом водню, прикріплений до ароматичного кільця толуолу атомом хлору. Намалюйте два інших можливих ізомери, в яких атом хлору замінює інший атом водню, прикріплений до ароматичного кільця:
Рішення
Оскільки шестивуглецеве кільце з чергуються подвійними зв'язками необхідно для того, щоб молекула була класифікована як ароматична, відповідні ізомери можуть бути отримані тільки шляхом зміни положень хлорозамісника щодо метил-замінника:
Намалюйте три ізомери шестичленного ароматичного кільцевого з'єднання, заміненого двома бромами.
- Відповідь
-
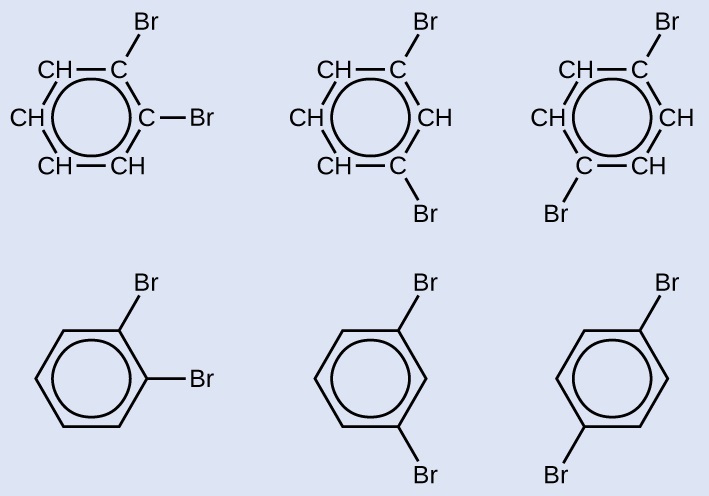
Показано три пари структурних формул. Перший має шість вуглецевих вуглеводневих кільце, в якому чотири атоми С пов'язані лише з одним атомом Н. У верхньому правому та правому куті кільця два атоми С, які не мають зв'язаних атомів H, мають один атом B r, пов'язаний кожен. Коло знаходиться в центрі кільця. Під цією конструкцією показана подібна структура, яка має шестикутник з колом всередині. З вершин шестикутника вгорі праворуч прикріплені одинарні B r атоми. Другий має шість вуглецевих вуглеводневих кільце, в якому чотири атоми С пов'язані лише з одним атомом Н. У верхньому правому та нижньому правому куті кільця два атоми С, які не мають зв'язаних атомів H, мають один атом B r, пов'язаний кожен. Коло знаходиться в центрі кільця. Під цією конструкцією показана подібна структура, яка має шестикутник з колом всередині. З вершин шестикутника вгорі праворуч і праворуч внизу прикріплені одиночні атоми B r. Третій має шість вуглецевих вуглеводневих кільце, в якому чотири атоми С пов'язані лише з одним атомом Н. У верхньому правому та нижньому лівому куті кільця два атоми С, які не мають зв'язаних атомів H, мають зв'язані атоми B r. Коло знаходиться в центрі кільця. Під цією конструкцією показана подібна структура, яка має шестикутник з колом всередині. З вершин шестикутника у верхньому правому і нижньому лівому куті приєднуються поодинокі атоми B r.
Резюме
Міцні, стабільні зв'язки між атомами вуглецю утворюють складні молекули, що містять ланцюги, гілки та кільця. Хімія цих сполук називається органічною хімією. Вуглеводні - органічні сполуки, що складаються тільки з вуглецю і водню Алкани - це насичені вуглеводні вуглеводи - тобто вуглеводні, які містять лише поодинокі зв'язки. Алкени містять одну або кілька вуглецево-вуглецевих подвійних зв'язків. Алкіни містять одну або кілька вуглецево-вуглецевих потрійних зв'язків. Ароматичні вуглеводні містять кільцеві структури з делокалізованими π електронними системами.
Виноски
- Це база даних Beilstein, тепер доступна через сайт Reaxys (www.elsevier.com/online-tools/reaxys).
- Пеплоу, Марк. «Органічний синтез: Робо-хімік», Природа 512 (2014): 20—2.
- Фізичні властивості для C 4 H 10 і більш важких молекул - це нормальний ізомер, n -бутан, n -пентан і т.д.
- STP вказує на температуру 0 °C і тиск в 1 атм.
Глосарій
- реакція додавання
- реакція, при якій подвійний вуглець-вуглецевий зв'язок утворює єдину вуглець-вуглецевий зв'язок шляхом додавання реагенту. Типова реакція для алкена.
- алкан
- молекула, що складається тільки з атомів вуглецю і водню, з'єднаних одиночними (σ) зв'язками
- алкен
- молекула, що складається з вуглецю і водню, що містить щонайменше одну подвійну зв'язок вуглецево-вуглецю
- алкільна група
- замісник, що складається з алкану, відсутнього одного атома водню, прикріпленого до більшої структури
- алкін
- молекула, що складається з вуглецю і водню, що містить щонайменше один вуглець-вуглецевий потрійний
- ароматичний вуглеводневий
- циклічна молекула, що складається з вуглецю і водню з делокалізованими змінними вуглецево-вуглецевими одно- і подвійними зв'язками, що призводить до підвищення
- функціональна група
- частина органічної молекули, яка надає молекулі специфічну хімічну реакційну здатність
- органічна сполука
- природне або синтетичне з'єднання, що містить вуглець
- насичений вуглеводневий
- молекула, що містить вуглець і водень, яка має лише поодинокі зв'язки між атомами вугле
- скелетна структура
- стенографічний метод малювання органічних молекул, в якому атоми вуглецю представлені кінцями ліній і вигинами між лініями, а атоми водню, прикріплені до атомів вуглецю, не показані (але розуміються присутніми під контекстом структури)
- замінник
- галузь або функціональна група, яка замінює атоми водню в більшому вуглеводневому ланцюзі
- реакція заміщення
- реакція, в якій один атом замінює інший в молекулі
