8.1: Теорія валентних зв'язків
- Page ID
- 22418
- Охарактеризуйте утворення ковалентних зв'язків в умовах атомно-орбітального перекриття
- Визначимо і наведемо приклади зв'язків σ і π
Як ми знаємо, наукова теорія є сильно підтримуваним поясненням спостережуваних природних законів або великих тіл експериментальних даних. Щоб теорія була прийнята, вона повинна пояснювати експериментальні дані та вміти прогнозувати поведінку. Наприклад, теорія VSEPR отримала широке визнання, оскільки пророкує тривимірні молекулярні форми, які узгоджуються з експериментальними даними, зібраними для тисяч різних молекул. Однак теорія VSEPR не дає пояснення хімічного зв'язку.
Існують успішні теорії, що описують електронну будову атомів. Ми можемо використовувати квантову механіку для прогнозування конкретних областей навколо атома, де, ймовірно, будуть розташовані електрони: сферична форма для s орбіталі, форма гантелі для орбітальної p тощо. Однак ці прогнози описують лише орбіталі навколо вільних атомів. Коли атоми зв'язуються з утворенням молекул, атомних орбіталів недостатньо для опису областей, де електрони будуть розташовуватися в молекулі. Більш повне розуміння електронних розподілів вимагає моделі, яка може враховувати електронну структуру молекул. Одна з популярних теорій стверджує, що ковалентний зв'язок утворюється, коли пара електронів ділиться двома атомами і одночасно притягується ядрами обох атомів. У наступних розділах ми обговоримо, як такі зв'язки описуються теорією валентних зв'язків і гібридизацією.
Теорія валентних зв'язків описує ковалентний зв'язок як перекриття напівзаповнених атомних орбіталів (кожна з яких містить один електрон), які дають пару електронів, поділених між двома зв'язаними атомами. Ми говоримо, що орбіталі на двох різних атомах перекриваються, коли частина однієї орбіти і частина другої орбіти займають одну і ту ж область простору. Відповідно до теорії валентних зв'язків, ковалентний зв'язок виникає при виконанні двох умов:
- орбітальний на одному атомі перекриває орбітальну на другий атом і
- поодинокі електрони в кожній орбіталі об'єднуються, утворюючи електронну пару.
Взаємне тяжіння між цією негативно зарядженою електронною парою та позитивно зарядженими ядрами двох атомів служить для фізичного зв'язку двох атомів за допомогою сили, яку ми визначаємо як ковалентний зв'язок. Міцність ковалентного зв'язку залежить від ступеня перекриття задіяних орбіталей. Орбіталі, які широко перекриваються, утворюють зв'язки, які сильніші за ті, які мають менше перекриття.
Енергія системи залежить від того, наскільки перекриваються орбіталі. \(\PageIndex{1}\)На малюнку показано, як змінюється сума енергій двох атомів водню (кольорова крива) у міру наближення один до одного. Коли атоми знаходяться далеко один від одного, немає перекриття, і за умовністю ми встановлюємо суму енергій на нуль. Коли атоми рухаються разом, їх орбіталі починають перекриватися. Кожен електрон починає відчувати тяжіння ядра в іншому атомі. Крім того, електрони починають відштовхуватися один одного, як і ядра. Поки атоми ще широко відокремлені, атракціони трохи сильніше відштовхувань, а енергія системи зменшується. (Починає формуватися зв'язок.) У міру того, як атоми рухаються ближче один до одного, перекриття збільшується, тому тяжіння ядер для електронів продовжує зростати (як і відбиття серед електронів і між ядрами). На деякій конкретній відстані між атомами, яке змінюється в залежності від задіяних атомів, енергія досягає свого найнижчого (найбільш стабільного) значення. Ця оптимальна відстань між двома зв'язаними ядрами - це відстань зв'язку між двома атомами. Зв'язок стабільний, оскільки в цей момент привабливі та відштовхуючі сили об'єднуються, щоб створити найнижчу можливу конфігурацію енергії. Якби відстань між ядрами зменшувалася далі, відбиття між ядрами та відбиття, оскільки електрони обмежені в тісній близькості один до одного, стали б сильнішими, ніж сили привабливості. Енергія системи тоді підніметься (роблячи систему дестабілізованою), як показано в крайньому лівому куті малюнка\(\PageIndex{1}\).
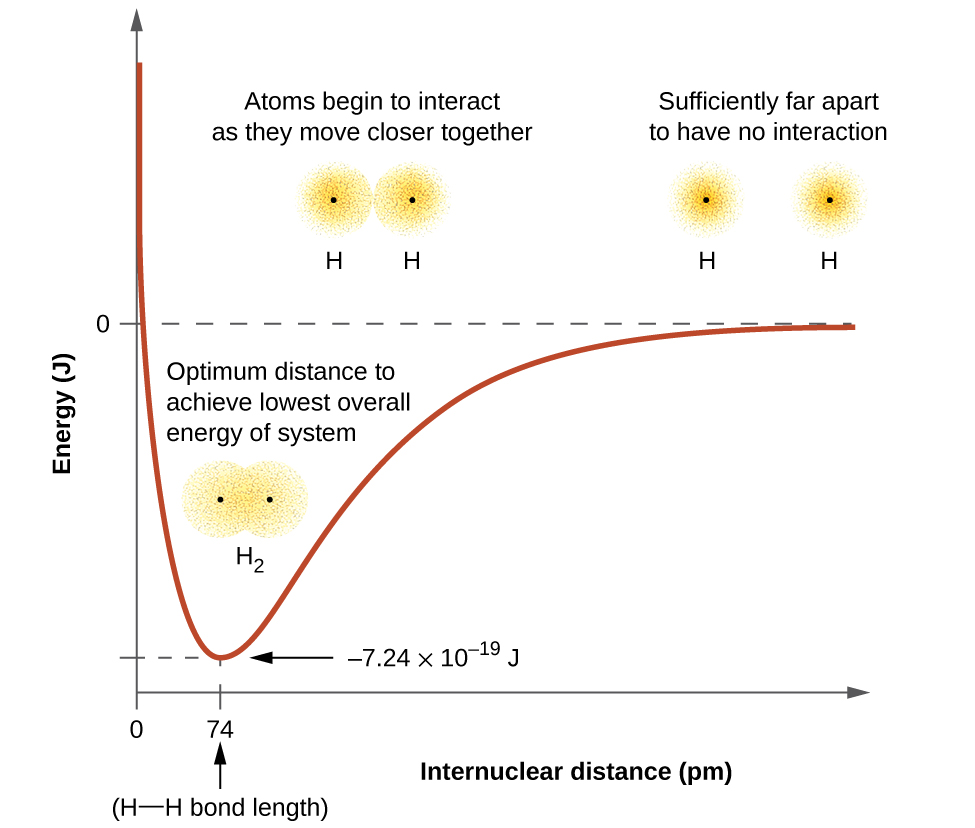
Енергія зв'язку - це різниця між енергетичним мінімумом (який виникає на відстані зв'язку) і енергією двох відокремлених атомів. Це кількість енергії, що виділяється при формуванні зв'язку. І навпаки, така ж кількість енергії потрібно для розриву зв'язку. Для\(H_2\) молекули, показаної на малюнку\(\PageIndex{1}\), на відстані зв'язку 74 вечора система\(7.24 \times 10^{−19}\, J\) нижча за енергією, ніж два відокремлених атома водню. Це може здатися невеликою кількістю. Однак з нашого попереднього опису термохімії ми знаємо, що енергії зв'язку часто обговорюються на моль основі. Наприклад, потрібно\(7.24 \times 10^{−19}\; J\) розірвати один H—H зв'язок, але потрібно\(4.36 \times 10^5\; J\) розірвати 1 моль H—H зв'язків. Порівняння деяких довжин зв'язків і енергій наведено в табл\(\PageIndex{1}\). Ми можемо знайти багато з цих зв'язків у різних молекулах, і ця таблиця містить середні значення. Наприклад, розрив першого зв'язку C—H в CH4 вимагає 439,3 кДж/моль, тоді як розрив першого зв'язку C—H в\(\ce{H–CH2C6H5}\) (загальний розчинник фарби) вимагає 375,5 кДж/моль.
| Бонд | Довжина (pm) | Енергія (кДж/моль) | Бонд | Довжина (pm) | Енергія (кДж/моль) | |
|---|---|---|---|---|---|---|
| Ч—Ч | 74 | 436 | С—О | 140.1 | 358 | |
| H—C | 106.8 | 413 | \(\mathrm{C=O}\) | 119,7 | 745 | |
| Ч—Н | 101.5 | 391 | \(\mathrm{C≡O}\) | 113,7 | 1072 | |
| Ч—О | 97.5 | 467 | H — Cl | 127.5 | 431 | |
| C—C | 150.6 | 347 | Н—Бр | 141.4 | 366 | |
| \(\mathrm{C=C}\) | 133.5 | 614 | H—I | 160.9 | 298 | |
| \(\mathrm{C≡C}\) | 120,8 | 839 | О—О | 148 | 146 | |
| С—Н | 142.1 | 305 | \(\mathrm{O=O}\) | 120,8 | 498 | |
| \(\mathrm{C=N}\) | 130.0 | 615 | F—F | 141.2 | 159 | |
| \(\mathrm{C≡N}\) | 116.1 | 891 | Cl—Cl | 198.8 | 243 |
Крім відстані між двома орбіталями, орієнтація орбіталів також впливає на їх перекриття (крім двох орбіталей s, які сферично симетричні). Більше перекриття можливо, коли орбіталі орієнтовані таким чином, що вони перекриваються по прямій лінії між двома ядрами. Малюнок\(\PageIndex{2}\) ілюструє це для двох орбіталів p від різних атомів; перекриття більше, коли орбіталі перекриваються кінець в кінець, а не під кутом.
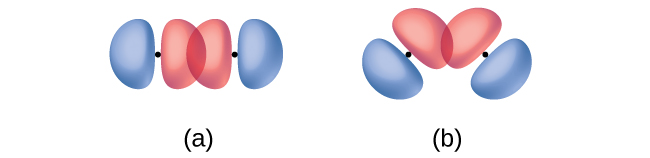
Перекриття двох s орбіталів (як у H 2), перекриття орбіти s та орбітальної p (як у HCl) та наскрізне перекриття двох орбіталів p (як у Cl 2) все виробляють сигма-зв'язки (σ зв'язки), як показано на малюнку \(\PageIndex{3}\). Зв'язок σ - це ковалентний зв'язок, в якій електронна щільність зосереджена в області вздовж міжядерної осі; тобто лінія між ядрами проходила б через центр області перекриття. Одиночні зв'язки в структурах Льюїса описуються як зв'язки σ в теорії валентних зв'язків.
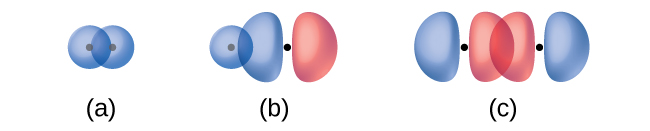
Пі зв'язок (π зв'язок) - це тип ковалентного зв'язку, який є результатом пліч-о-плічного перекриття двох орбіталів p, як показано на малюнку\(\PageIndex{4}\). У π зв'язку області орбітального перекриття лежать по протилежних сторонам міжядерної осі. Уздовж самої осі знаходиться вузол, тобто площину без ймовірності знаходження електрона.
 "стиль = "ширина: 325 пікселів; висота: 115 пікселів;» ширина = «325px» висота = «115px» SRC =»/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg «>
"стиль = "ширина: 325 пікселів; висота: 115 пікселів;» ширина = «325px» висота = «115px» SRC =»/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg «>
У той час як всі поодинокі зв'язки є σ зв'язками, множинні зв'язки складаються як з σ, так і π зв'язків. Як припускають структури Льюїса, О 2 містить подвійну зв'язок, а N 2 містить потрійний зв'язок. Подвійний зв'язок складається з однієї зв'язки σ і однієї π зв'язку, а потрійна зв'язок складається з однієї σ зв'язку і двох π зв'язків. Між будь-якими двома атомами перша утворена зв'язок завжди буде зв'язком σ, але в будь-якому одному місці може бути лише один зв'язок σ. У будь-якому кратному зв'язку буде одна зв'язок σ, а решта одна або дві зв'язки будуть π зв'язками. Ці зв'язки більш детально описані далі в цьому розділі.
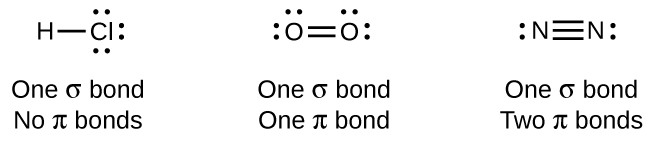
Як видно з таблиці\(\PageIndex{1}\), середній вуглецево-вуглецевий одиночний зв'язок становить 347 кДж/моль, тоді як у подвійному зв'язку вуглець-вуглецевий зв'язок π збільшує міцність зв'язку на 267 кДж/моль. Додавання додаткової π зв'язку викликає подальше збільшення 225 кДж/моль. Подібну закономірність ми можемо побачити, коли порівнюємо інші зв'язки σ і π. Таким чином, кожна окрема π зв'язок, як правило, слабкіше відповідної σ зв'язку між тими ж двома атомами. У зв'язку σ спостерігається більший ступінь орбітального перекриття, ніж в π зв'язку.
Бутадієн, С 4 Н 6, використовується для виготовлення синтетичного каучуку. Визначте кількість σ і π зв'язків, що містяться в цій молекулі.
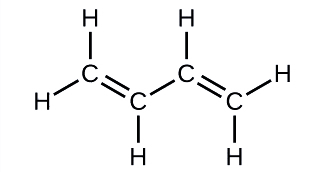
Рішення
Існує шість σ зв'язків C—H та один σ зв'язок C—C, загалом сім з одиночних зв'язків. Існують дві подвійні зв'язки, кожна з яких має π зв'язок на додаток до σ зв'язку. Це дає загалом дев'ять σ та дві π зв'язки загалом.
Визначте кожну ілюстрацію як зображення σ або π зв'язку:
- бічне перекриття 4 р і 2 р орбітальної
- наскрізне перекриття 4 р і 4 р орбітальної
- наскрізне перекриття 4 р і 2 р орбітальної
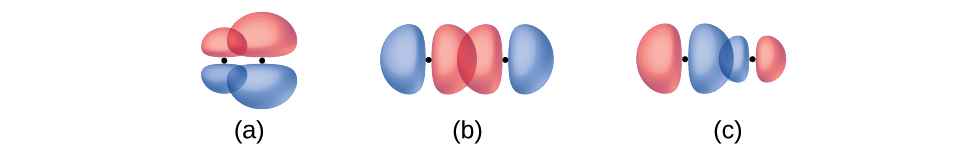
- Відповідь
-
(а) - це зв'язок π з вузлом вздовж осі, що з'єднує ядра, тоді як (b) і (c) - це зв'язки σ, які перекриваються вздовж осі.
Резюме
Теорія валентних зв'язків описує зв'язок як наслідок перекриття двох окремих атомних орбіталей на різних атомах, що створює область з однією парою електронів, розділених між двома атомами. Коли орбіталі перекриваються вздовж осі, що містить ядра, вони утворюють зв'язок σ. Коли вони перекриваються таким чином, що створює вузол уздовж цієї осі, вони утворюють π зв'язок.
Глосарій
- перекриття
- співіснування орбіталів з двох різних атомів, що розділяють одну і ту ж область простору, що призводить до утворення ковалентного зв'язку
- вузла
- площина, що розділяє різні частки орбіталей, де ймовірність знаходження електрона дорівнює нулю
- пі зв'язок (π зв'язок)
- ковалентний зв'язок, утворений пліч-о-плічним перекриттям атомних орбіталів; електронна щільність виявлена на протилежних боках міжядерної осі
- сигма-зв'язок (σ зв'язок)
- ковалентний зв'язок, утворений перекриттям атомних орбіталей вздовж міжядерної осі
- теорія валентних зв'язків
- опис зв'язку, що включає атомні орбіталі, що перекриваються з утворенням σ або π зв'язків, всередині яких діляться пари електронів
