16.5: Застосування рівняння Нернста
- Page ID
- 19183
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Атмосферний кисень є сильним окислювачем, але за відсутності відповідного каталізатора ця реакція зазвичай занадто повільна, щоб її можна було спостерігати.
- Pe є корисним показником доступності електронів, особливо в природних водах та біологічних системах, в яких зазвичай присутні кілька окислювально-відновних систем.
- Продукти розчинності часто можна виміряти шляхом побудови комірки, в якій один з електродів включає в себе помірно розчинну сіль, а рівняння чистого комірки відповідає реакції розчинності.
- Потенціометричні титрування широко використовуються для вимірювання концентрацій видів, які легко окислюються або відновлюються.
- Вимірювання рН здійснюється електродом, що складається з тонкої мембрани зі скла, в якій іони Na + обмінюються з H +.
- Мембранні (Доннан) потенціали виникають, коли проходження іона через напівпроникну мембрану вибірково полегшується або гальмується.
- Нервова провідність відбувається не потоком заряду через нерв, а хвилею деполяризації, що виникає в результаті узгодженої дії активних каналів, які керують проходженням іонів (в основному K + і Na +) через мембрану, що охоплює нерв.
Зазвичай ми думаємо, що окислювальний потенціал контролюється концентраціями окислених та відновлених форм окислювально-відновної пари, як це дано рівнянням Нернста. За певних обставин стає більш корисним думати про Е як про незалежну змінну, яка може бути використана для управління значенням Q в рівнянні Нернста. Зазвичай це відбувається, коли присутні дві окислювально-відновні системи, одна з яких є набагато більш концентрованою або кінетично активною, ніж інша. Найважливішим прикладом цього є те, як атмосферний кисень регулює склад багатьох окислювально-відновних систем, пов'язаних з біологічною активністю.
Кисень і водне середовище
Наявність кисню в атмосфері має глибокий вплив на окислювально-відновні властивості водного середовища - тобто на природні води, що піддаються прямо чи опосередковано атмосфері, і, крім того, на організми, які живуть в аеробному середовищі. Це, звичайно, пов'язано з тим, що він є виключно сильний окислювач і, таким чином, низько розташована раковина для електронів від більшості елементів і всіх органічних сполук. Ті частини навколишнього середовища, які захищені від атмосферного кисню, однаково важливі, оскільки тільки тут електрони досить доступні для створення «відновних» умов, необхідних для процесів, що варіюються від фотосинтезу до фіксації азоту.
Оцінити окислювально-відновний потенціал природної води, яка знаходиться в рівновазі з атмосферою при рН 7 і 298 К. Яка частка розведеного розчину Fe 2 + буде в окисленому вигляді Fe 3 + в такій воді?
Рішення
Відповідні E° s є
- 1,23 v для О 2 (г) + 4Н + 4 е — → 2Н 2 О і
- 0,77 В для пари Fe 3 + /Fe 2 +.
(а) Потенціал (щодо SHE, звичайно) задається рівнянням Нернста
який працює до Е = 0,82 вольта. Як прогнозує принцип Ле Шательє, більш високий рН (нижчий [H +] порівняно з тим, що при «стандартному» рН нулю) знижує тенденцію прийому електронів кисню.
(б) Рівняння Нернста для зменшення Fe 3 + дорівнює E = .77-0,059 log Q, в якому Q - відношення [Fe 2 +]/[Fe 3+]. З E, встановленим парою O 2/H 2 O, це стає
0.82 = 0.77 — 0,059 Журнал Q
що дає Q = 10 -0,85 або [Fe 2 +]/[Fe 3 +] = 0,1/1, тому частка заліза в окисленому вигляді становить 1/1,14 = 0,88.
Якщо ми можемо мати рН, чому б не pE?
Як ви пам'ятаєте з вашого дослідження кислотно-лужної хімії, рН розчину (визначається як —log {H +}) є мірою наявності (технічно, активності) протонів у розчині. Як пояснюється більш детально тут, протони, як правило, «падають» (у вільній енергії) від заповнених донорських рівнів (кислот) до нижчих акцепторних рівнів (підстав.) Через відношення
\[[H^+] \approx K_a \dfrac{C_a}{C_b}\]
які можна переписати як
\[\dfrac{C_a}{C_b} \approx \dfrac{[H^+]}{K_a}\]
в якому рН розглядається як самостійна змінна, яка контролює співвідношення сполучених форм будь-яких кислотно-лужних пар в розчині:
\[\log \left(\dfrac{C_a}{C_b}\right) \approx pH – pK_a\]
Таким же чином ми можемо визначити pE як негативний журнал активності електронів у розчині:
\[pE = –\log{e^–}\]
цих частинок (але не до їх «концентрацій»), коли ми розглядаємо їх доступність донорам і акцепторам. Ми не будемо вдаватися в подробиці того, як насправді розраховується pE (це, звичайно, пов'язано зі звичайним стандартним електродним потенціалом). Щоб отримати уявлення про його значення, розглянемо наступну діаграму, яка показує значення pE° деяких окислювально-відновних систем, які мають величезне значення у водному середовищі.Екологічно важливі окислювально-відновні системи
- Ці значення pE відносяться до типових умов навколишнього середовища з рН = 7 і парціальним тиском кисню 0,21 атм. Шкала нижче показує вільну енергію моля електронів щодо їх рівня в H 2 O.
- Дві сполучені форми будь-якої окислювально-відновної пари присутні в рівних концентраціях, коли pE знаходиться на рівні, на якому показана пара. При pE вище або нижче цього рівня переважатиме відновлена або окислена форма.
- Цукрова глюкоза, що позначається загальною формулою вуглеводів {CH 2 O}, є джерелом хімічної енергії для більшості організмів. Відзначимо, що він термодинамічно стабільний (і, таким чином, здатний утворюватися шляхом фотосинтезу) тільки в сильно відновлювальних умовах.
- Організми отримують свою метаболічну вільну енергію, коли електрони падають з глюкози до нижнього акцептора праворуч.
- Доставка електронів з глюкози до O 2 (8) є джерелом метаболічної вільної енергії для всіх аеробних організмів, що дає 125 кДж на моль перенесених електронів.

Ще кілька моментів про цю змову варто відзначити:
- Анаеробні організми повинні робити з електрон-акцепторами вище кисню. Бідні бактерії, які залежать від відновлення іонів водню (2), мають це найгірше, отримуючи лише крихітну кількість метаболічної енергії, щоб виробляти крихітну затяжку водневого газу.
- Реакція (3) не набагато ефективніше, але вона є життєво важливою першою ланкою в процесі природної фіксації азоту, що здійснюється в захищеному електронним середовищі організмів, що мешкають в кореневих вузликах бобових культур.
- Наслідки (4) легко очевидні, якщо ви коли-небудь помічали тухлий яєчний запах деяких погано аерованих брудних ґрунтів.
- Реакція (6) відома як бродіння; вона відбувається в анаробних грунтах боліт і боліт (звідси прізвисько «болотний газ» для метану) і в нутрощах тварин від термітів до корів, а іноді і до нашого збентеження, в нас самих. Зверніть увагу, що глюкоза відіграє подвійну роль донора електронів і акцептора тут; це реакція диспропорції.
- Нарешті, якщо ви коли-небудь мали багато спільного з пелюшками для дітей, ви, ймовірно, помітили запах аміаку, який утворюється, оскільки анаеробні бактерії зсередини доставляють електрони до нітратних іонів (7). Важливо мати на увазі, що розглянуті вище реакції опосередковані живими організмами; без необхідних ферментів для їх каталізації їх швидкість по суті дорівнює нулю.
Більш детальну діаграму див. в розділі Падіння через дихальний ланцюг.
Застосування аналітичної хімії
Дуже велика частина хімії займається, прямо або опосередковано, визначенням концентрацій іонів в розчині. Будь-який метод, який може виконати такі вимірювання, використовуючи відносно прості фізичні методи, обов'язково буде широко експлуатуватися. Потенціали клітин досить легко виміряти, і хоча рівняння Нернста пов'язує їх з іонною активністю, а не з концентраціями, різниця між ними стає незначною в розчині, де загальна іонна концентрація менше приблизно 10 —3 М.
Концентрації іонів в рівновазі з малорозчинною сіллю досить низькі, що їх безпосереднє визначення може бути досить складним. Набагато простішою і поширеною процедурою є створення клітини, в якій одна з реакцій електрода включає нерозчинну сіль, і чиста реакція клітин якої відповідає розчиненню солі. Наприклад, щоб визначити K sp для хлориду срібла, ми могли б використовувати осередок
\[Ag_{(s)} | Ag^+(?\; M) || Ag^+,Cl^– | AgCl_{(s)} | Ag_{(s)}\]
чиє чисте рівняння відповідає розчиненню хлориду срібла:
|
катод:
|
AgCl (s) + е — → Ag (s) + Сл — (aq) | Е° = +0,222 в |
|
анод:
|
Аг (и) → Ag + (aq) + е — | Е° = - (+0.799) v |
|
нетто:
|
AgCl (и) → Аг + Сл — | Е° = -0.577 v |
Стандартний потенціал для чистої реакції відноситься до гіпотетичного рішення, в якому діяльність двох іонів є єдністю. Потенціал клітини, який ми насправді спостерігаємо, відповідає E у рівнянні Нернста, яке потім вирішується для Q, що дає K sp безпосередньо.
Потенціометричні титрування
У багатьох ситуаціях точне визначення концентрації іонів шляхом безпосереднього вимірювання потенціалу клітини неможливо через наявність інших іонів і відсутність інформації про коефіцієнти активності. У таких випадках часто можна визначити іон побічно шляхом титрування якимось іншим іоном. Наприклад, початкову концентрацію такого іона, як Fe 2 +, можна знайти шляхом титрування сильним окислювачем, таким як Ce 4 +. Титрування проводиться в одній стороні клітини, інша половина якої є еталонним електродом:
Pt (s) | Fe 2 +, Fe 3 + || опорний електрод
Спочатку ліва клітина містить тільки Fe 2 +. У міру додавання титранту іон заліза окислюється до Fe 3 + в реакції, яка є практично повною:
\[Fe^{2+} + Ce^{4+} → Fe^{3+} + Ce^{3+}\]
Потенціал клітини слідує, коли Fe 2 + додається з невеликим кроком. Після додавання першої краплі титранту іонів церіону, потенціал лівої клітини контролюється співвідношенням окисленого та відновленого заліза відповідно до рівняння Нернста
\[E = 0.68 - 0.059 \; \log \dfrac{]Fe^{3+}]}{[Fe^{2+}]}\]
що призводить до підвищення потенціалу, оскільки більше заліза окислюється.
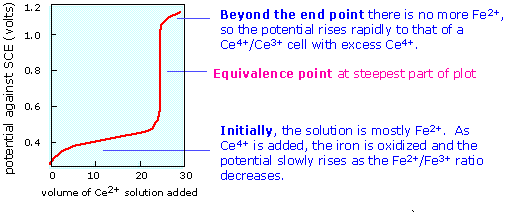
Коли точка еквівалентності буде досягнута, Fe 2 + буде повністю споживатися (велика константа рівноваги гарантує, що це буде так), і потенціал потім буде контролюватися співвідношенням концентрації Ce 3 +/Ce 4 +. Ідея полягає в тому, що обидва види окислювально-відновної пари повинні бути присутніми в розумних концентраціях, врівноважувати електрод (тобто контролювати його потенціал відповідно до рівняння Нернста). Якщо розробити фактичні потенціали клітин для різних концентрацій усіх цих видів, отримана крива титрування виглядає так само, як звична крива кислотно-лужного титрування. Кінцева точка знаходить не шляхом вимірювання певної напруги осередку, а шляхом знаходження того, який обсяг титранту дає найкрутіша частина кривої.
Вимірювання рН
Оскільки рН насправді визначається з точки зору активності іонів водню, а не його концентрації, водневий електрод дозволяє безпосередньо вимірювати {H +} і, отже, —log {H +}, що є рН. Все, що вам потрібно - це виміряти напругу осередку
Н 2 (г, 1 атм) | Пт | Н + (? М) || опорний електрод
Теоретично це досить просто, але коли він був вперше використаний в епоху доелектроніки, він вимагав деякого досить грізного вигляду апарату (наприклад, установка вібраційного очерету L & N з 1920-х років, показана тут) і використання вибухонебезпечного газу водню. Хоча ця схема (в якій еталонний електрод може бути стандартним водневим електродом) з того часу використовувався для високоточних визначень, було б недоцільно для рутинних вимірювань рН тих видів, які широко проводяться, особливо поза дослідницькою лабораторією.
Скляний електрод для вимірювання рН
У 1914 році було виявлено, що тонка скляна мембрана, що містить розчин HCl, може виробляти потенціал, який змінюється в залежності від активності іонів водню {H +} приблизно так само, як і у водневого електрода. Скляні електроди виготовляються у величезній кількості як для лабораторних, так і для польових вимірювань. Вони містять вбудований опорний електрод Ag-AgCl, що контактує з розчином HCl, укладеним мембраною.
Потенціал скляного електрода задається формою рівняння Нернста, дуже схожого на звичайний водневий електрод, але, звичайно, без H 2:
Е мембрана = A + (RT/F) ln ({H +} + B)
в якому А і В - константи, які залежать від конкретної скляної мембрани.
Причина, по якій скляна мембрана буде вести себе таким чином, не була зрозуміла приблизно до 1970 року. Тепер виявляється, що іони водню у зовнішньому розчині дифузують крізь скло і виштовхують відповідну кількість іонів Na +, які зазвичай присутні в більшості окулярів. Ці іони натрію дифузно на будь-яку сторону мембрани мають меншу концентрацію, де вони залишаються здебільшого обмеженими поверхнею скла, яке має пористу, студнеобразную природу. Саме надлишковий заряд, вироблений цими позитивними іонами, породжує pH-залежний потенціал. Перший комерційний рН-метр був розроблений Арнольдом Бекманом (1900-2004), коли він був професором хімії в CalTech. Він не зміг зацікавити жодну з приладобудівних компаній в її маркетингу, тому заснував власну компанію і в кінцевому підсумку став мультимільйонером філантропом.
|
Арнольд Бекман
|
Рання рН-метр Бекмана
|
Типовий сучасний рН-метр
|
Іоноселективні електроди
Функція мембрани в скляному електроді полягає в тому, щоб дозволити іонам водню проходити і, таким чином, змінювати свій потенціал, запобігаючи іншим катіонам робити те ж саме (ця селективність ніколи не є ідеальною; більшість скляних електродів реагуватимуть на помірні концентрації іонів натрію та на високі концентрації деяких інших.) Таким чином, скляний електрод є однією з форм іоноселективного електрода. Приблизно з 1970 року були розроблені різні інші мембрани, які показують подібну селективність до деяких інших іонів. Вони широко використовуються в промисловому, біохімічному та екологічному застосуванні.
Мембранні потенціали і нервова провідність
Ви можете згадати явища осмосу та осмотичного тиску, які спостерігаються, коли два розчини, що мають різну концентрацію розчинених речовин, розділені тонкою плівкою або мембраною, пористість якої дозволяє дифузно малим іонам і молекулам, але яка стримує більші частинки. Якщо один розчин містить пару протилежно заряджених іонних видів, розміри яких дуже різні, менші іони можуть проходити через напівпроникну мембрану, тоді як більші утримуються. Це призведе до дисбалансу заряду між двома розчинами, при цьому оригінальний розчин має знак заряду більшого іона. Зрештою електромонтажні роботи, необхідні для подальшого поділу зарядів, стають занадто великими, щоб мати місце будь-яка подальша дифузія мережі, і система осідає в рівноважний стан, в якому підтримується постійна різниця потенціалів (зазвичай навколо вольта або менше). Цю різницю потенціалів зазвичай називають мембранним потенціалом або потенціалом Доннана після англійського хіміка, який вперше описав це явище близько 1930 року.
|
Походження мембранного потенціалу Якщо менші іони здатні дифузувати через мембрану, але більші іони не можуть, між двома розчинами буде розвиватися різниця потенціалів. Цей мембранний потенціал можна спостерігати, вводячи пару платинових електродів. |
|
На малюнку показана проста система, що містить калієву сіль білка з одного боку мембрани, а хлорид калію - з іншого. Аніон протеїнату, будучи занадто великим для дифузії через мембрану, породжує різницю потенціалів. Значення цієї різниці потенціалів може бути виражено співвідношенням, яке по суті є таким же, як і рівняння Нернста, хоча його виведення відрізняється. Мембранний потенціал може бути виражений через співвідношення активності K + або Cl — іонів:
Мембрана, що оточує більшість живих клітин, містить ділянки або «канали», по яких іони K + вибірково транспортуються так, що концентрація К + всередині клітини в 10-30 разів перевищує концентрацію внутрішньоклітинної рідини. Беручи коефіцієнт активності приблизно 20, вищевказане рівняння прогнозує, що різниця потенціалів θ всередині - θ зовні буде
що узгоджується зі спостережуваними значеннями. Транспортування іона типу К + з області низької концентрації в більш концентровану міжклітинну рідину вимагає джерела вільної енергії, яка постачається АТФ під ферментативним контролем. Метаболічні процеси, що регулюють цю дію, часто називають «іонними насосами».
Нервова провідність
Передача сигналів по нервовій системі відбувається не рухом носія заряду через нерв, а хвилями диференціальних концентрацій іонів, які рухаються по довжині нерва. Ці градієнти концентрації зменшуються іонними каналами на основі білка та активованими АТФ (і енерговитратними) іонними насосами, специфічними для іонів K + та Ca 2 +.
Ми іноді думаємо про наші нерви як про проводку тіла, але «електрику», яку вони передають, - це не потік електронів, а стрімко рухається хвиля деполяризації, що включає транспорт іонів через нервову мембрану. Нормальна різниця потенціалів між внутрішньою та зовнішньою частинами нервових клітин становить близько —70 мВ, як оцінювалося вище. Передача нервового імпульсу ініціюється зменшенням цієї різниці потенціалів приблизно до —20 мВ. Це має ефект тимчасового відкриття каналу Na +; приплив цих іонів викликає руйнування мембранного потенціалу сусідньої ділянки нерва, приводячи до ефекту, який передається по довжині нерва. У міру проходження цього імпульсу насоси К + і Na + відновлюють нерв до стану спокою.
Резюме
Переконайтеся, що ви добре розумієте наступні основні ідеї, які були представлені вище. Особливо важливо, щоб ви знали точні значення всіх виділених термінів в контексті даної теми.
- Атмосферний кисень є сильним окислювачем, але за відсутності відповідного каталізатора ця реакція зазвичай занадто повільна, щоб її можна було спостерігати. У організмів, що володіють відповідними ферментами, реакція досить швидка, щоб контролювати доступність електронів до інших окислювально-відновних систем.
- Pe є корисним показником доступності електронів, особливо в природних водах та біологічних системах, в яких зазвичай присутні кілька окислювально-відновних систем. Хоча електрони мають тенденцію «падати» (у вільній енергії) від джерел до раковин, результат дуже сильно залежить від швидкості різних реакцій. Це досить сильно відрізняється від протонно-обмінних (кислотно-лужних) реакцій, які протікають рівномірно швидко.
- Продукти розчинності часто можна виміряти шляхом побудови комірки, в якій один з електродів включає в себе помірно розчинну сіль, а рівняння чистого комірки відповідає реакції розчинності.
- Потенціометричні титрування широко використовуються для вимірювання концентрацій видів, які легко окислюються або відновлюються. Реакція повинна бути швидкою і мати дуже велику постійну рівноваги. Точка еквівалентності визначається швидкою зміною потенціалу, яка виникає, коли контроль потенціалу клітини переходить від окислювально-відновної системи аналіту до титранта.
- Вимірювання рН здійснюється електродом, що складається з тонкої мембрани зі скла, в якій іони Na + обмінюються з H +.
- Мембранні (Доннан) потенціали виникають, коли проходження іона через напівпроникну мембрану вибірково полегшується або гальмується. Класичним прикладом є розчин білка натрію, в якому аніон білка занадто великий, щоб пройти через мембрану. У організмів подібну дію надають іонно-специфічні канали або «насоси».
- Нервова провідність відбувається не потоком заряду через нерв, а хвилею деполяризації, що виникає в результаті узгодженої дії активних каналів, які керують проходженням іонів (в основному K + і Na +) через мембрану, що охоплює нерв.
