8.9: Дистиляція
- Page ID
- 19301
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Намалюйте типову діаграму температури кипіння для бінарного рідкого розчину і використовуйте це, щоб показати, як працює проста одноетапна дистиляція.
- Поясніть роль правила важеля в фракційній перегонці
- Опишіть призначення і функції фракціонуючої колони
- Намалюйте діаграми температури кипіння для азеотропів з високим і низьким кипінням
- Опишіть роль дистиляції в переробці сирої нафти, і поясніть, в дуже загальному вигляді, як подальша обробка використовується для збільшення виходу бензинового моторного палива.
Дистиляція - це процес, при якому суміш рідин, що мають різний тиск пари, розділяється на її компоненти. Спочатку можна подумати, що це було б досить просто: якщо у вас є розчин, що складається з рідини А, яка кипить при 50° C, і рідини B з температурою кипіння 90° C, все, що було б необхідно, - це нагріти суміш до певної температури між цими двома значеннями; це зварило б весь А (чиї пари потім можна згустити назад в чисту рідину (А), залишаючи чисту рідину B в горщику. Але це не враховує той факт, що ці рідини матимуть значний тиск пари при всіх температурах, а не тільки при температурі кипіння.
Тиск пари проти фазових діаграм складу
Щоб повністю зрозуміти дистиляцію, розглянемо ідеальну бінарну рідку суміш\(\ce{A}\) і\(\ce{B}\). Якщо моль фракція\(A\) в суміші є\(\chi_A\), то за визначенням моль фракції,\(B\) що з
\[\chi_B = 1 – \chi_A\]
Оскільки дистиляція залежить від різного тиску пари розділюваних компонентів, давайте спочатку розглянемо тиск пари проти ділянки складу (рис.\(\PageIndex{1}\)) для гіпотетичної суміші при деякій довільній температурі, при якій можуть існувати як рідка, так і газова фази, залежно від загального тиску.
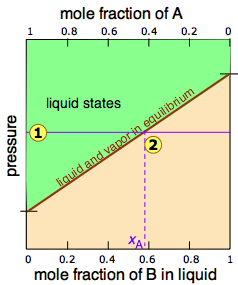
На малюнку\(\PageIndex{2}\) всі стани системи (тобто комбінації тиску і складу), в яких розчин існує виключно у вигляді рідини, затінені зеленим кольором. Оскільки рідини більш стійкі при більш високих тисках, ці стани займають верхню частину діаграми. При будь-якому заданому загальному тиску пари, такому як при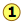 , склад пари в рівновазі з рідиною (позначається\(x_A\)) відповідає перехопленню з діагональною лінією рівноваги при
, склад пари в рівновазі з рідиною (позначається\(x_A\)) відповідає перехопленню з діагональною лінією рівноваги при . Діагональна лінія - це всього лише вираз лінійності між тиском пари і складом відповідно до закону Рауля.
. Діагональна лінія - це всього лише вираз лінійності між тиском пари і складом відповідно до закону Рауля.
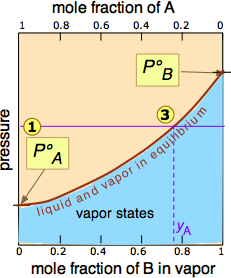
 напірної лінії
напірної лінії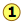 з кривою рівноваги визначає мольні частки\(\ce{A}\) і\(\ce{B}\) присутні в парі. (Зауважимо, що мольні фракції газів, з якими ми тут маємо справу, умовно представлені у, отже, y A і y B). Кривизна лінії рівноваги виникає через необхідність поєднання закону Рауля з законом Дальтона парціальних тисків, який застосовується до газоподібних сумішей.
з кривою рівноваги визначає мольні частки\(\ce{A}\) і\(\ce{B}\) присутні в парі. (Зауважимо, що мольні фракції газів, з якими ми тут маємо справу, умовно представлені у, отже, y A і y B). Кривизна лінії рівноваги виникає через необхідність поєднання закону Рауля з законом Дальтона парціальних тисків, який застосовується до газоподібних сумішей.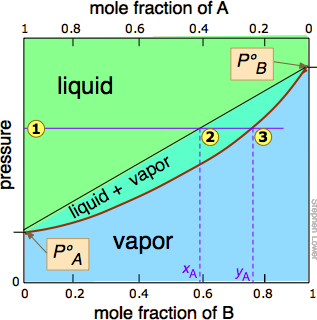
Дві лінії рівноваги рідина-пара (одна вигнута, інша пряма) тепер охоплюють область, в якій рідина і пара можуть співіснувати; поза цією областю суміш буде повністю складатися з рідини або пари. При цьому особливому тиску перехоплення
перехоплення з верхньою межею двофазної області дає мольні частки А і В в рідкій фазі, в той час як перехоплення
з верхньою межею двофазної області дає мольні частки А і В в рідкій фазі, в той час як перехоплення з нижньою межею дає мольні частки двох складових в парі.
з нижньою межею дає мольні частки двох складових в парі.
Знайдіть хвилинку, щоб вивчити малюнок\(\PageIndex{5}\) і підтвердити це
- оскільки обидва перехоплення відбуваються на рівноважних лініях, вони описують склади рідини і пари, які можуть одночасно існувати;
- склади пари і рідини неоднакові;
- в парі мольна частка\(\ce{B}\) (більш летюча складова розчину) більше, ніж в рідині;
- в рідині мольна фракція\(\ce{A}\) (менш летюча складова) менше, ніж у пари.
Пари, що знаходяться в рівновазі з розчином двох і більше рідин, завжди багатші на більш летючий компонент.
Температури проти фазових діаграм складу (діаграми температури кипіння)
Правило, наведене вище, говорить про те, що якщо ми нагріємо суміш достатньо, щоб довести її загальний тиск пари в двофазну область, ми матимемо засіб поділу суміші на дві порції, які будуть збагачені відповідно більш летючими і менш летючими компонентами. Це принцип, на якому заснована дистиляція. Але яка температура потрібна для досягнення цього? Знову ж таки, ми позбавимо вас математичних деталей, але можна побудувати графік, подібний до малюнка,\(\PageIndex{4}\) за винятком того, що вертикальна вісь представляє температуру, а не тиск. Такий вид сюжету називається діаграмою температури кипіння.
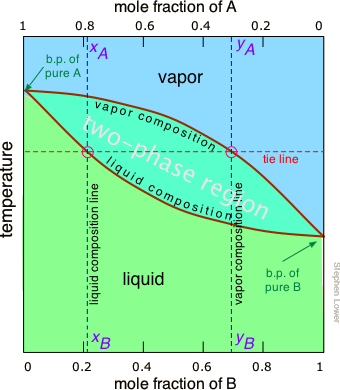
Важливі властивості діаграм температури кипіння
Деякі важливі речі, щоб зрозуміти про малюнок\(\PageIndex{6}\):
- Форма двофазної області двоопукла, на відміну від напівопуклої форми графіка тиску-композиція.
- Ухил двофазної області протилежний тому, що ми бачили на попередньому ділянці, а ділянки, відповідні однофазним областям, зворотні. Це просто відображає той факт, що рідини, що мають більш високий тиск пари, киплять при більш низьких температурах, і навпаки.
- Горизонтальна лінія, яка визначає температуру, називається лінією прив'язки. Його перехоплення двома кривими рівноваги визначають склад рідини і пари в рівновазі з сумішшю при заданій температурі.
- Лінія складу пари також відома як лінія точки роси - температура, при якій конденсація починається при охолодженні.
- Лінію рідкого складу також називають лінією точки бульбашок - температурою, при якій починається кипіння при нагріванні.
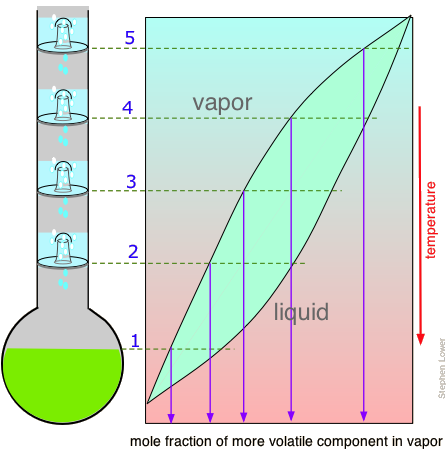
Лінія стяжки, показана на малюнку\(\PageIndex{6}\), призначена для однієї конкретної температури. Але коли ми нагріваємо рідину до температури кипіння, склад зміниться, оскільки більш летючий компонент (\(\ce{B}\)в цих прикладах) вибірково видаляється у вигляді пари. Решта рідина буде збагачена менш летючим компонентом, а температура її кипіння, отже, підвищиться. Щоб більш детально розібратися в цьому процесі, розглянемо ситуацію в декількох точках при перегонці рівномолярного розчину\(\ce{A}\) і\(\ce{B}\).
 |
 |
 |
|
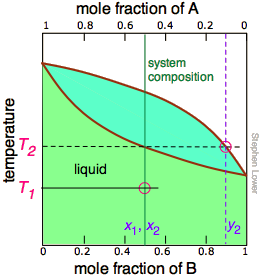
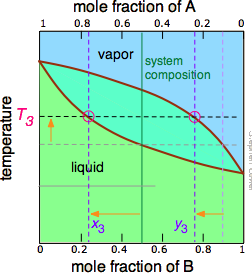
Малюнок\(\PageIndex{5A}\): Починаємо з рідини при Т 1, нижче її температури кипіння. При підвищенні температури до Т 2 починається кипіння і перший пар (а значить і перша крапля конденсату) матиме склад y 2. |
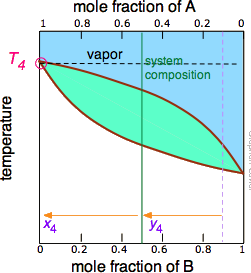
Малюнок\(\PageIndex{5B}\): У міру википання більш летючого компонента В склад рідини і пар/конденсату зміщуються вліво (помаранчеві стрілки). | Малюнок\(\PageIndex{5C}\): При Т 4 останній слід рідини зникає. Система тепер повністю пара, склад y 4. |
Зверніть увагу, що вертикальна лінія композиції зеленої системи залишається в тому ж місці на трьох ділянках, оскільки «система» визначається як складається як з рідини в «горщику», так і в приймальному контейнері, який був конденсований з пари. Основні ідеї, які ви повинні відняти від цього, полягають у тому, що
- перегонка ніколи не зможе повністю відокремити дві летючі рідини;
- склад пари і, отже, конденсованого дистиляту постійно змінюється в міру утворення кожної краплі, починаючи з y 2 і закінчуючи на y 4 в даному прикладі;
- якщо рідина повністю википіла, склад дистиляту буде таким же, як у вихідного розчину.
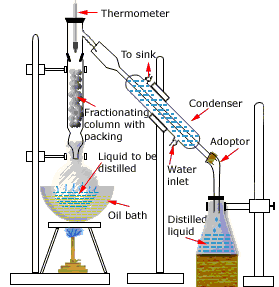
Лабораторна установка дистиляції
Апарат, який використовується для простої лабораторної періодичної перегонки, показаний тут. Мета термометра - стежити за ходом перегонки; як грубе правило, перегонку слід припинити, коли температура піднімається приблизно на півдорозі між точками кипіння двох чистих рідин, які повинні бути принаймні 20-30° C один від одного (якщо вони ближче, то фракційна перегонка, описана нижче, стає необхідною).

Фракційна дистиляція
Хоча дистиляція ніколи не може досягти повного відділення летких рідин, вона в принципі може бути проведена таким чином, що будь-який бажаний ступінь поділу може бути досягнутий, якщо розчин поводиться ідеально, і хтось готовий піти на біду. Загальна процедура полягає в перегонці лише частки рідини, чим менше, тим краще. Конденсат, збагачений тепер більш летючим компонентом, потім збирають і переганяють (знову ж таки, лише дрібну фракцію), отримуючи таким чином конденсат ще більше збагачений більш летючим компонентом. Якщо ми повторюємо цю послідовність багато разів, ми зможемо в кінцевому підсумку отримати майже чисті, якщо хвилинні, зразки двох компонентів.
Але оскільки це навряд чи було б практично, є кращий спосіб. Для того щоб розібратися в ньому, потрібно знати про правило важеля, яке передбачає простий спосіб визначення відносних величин (не тільки складів) двох фаз, що знаходяться в рівновазі. Правило важеля легко походить від законів Раулта та Далтона, але ми просто проілюструємо його графічно (рис.\(\PageIndex{7}\)). На сюжеті показана діаграма температури кипіння простої бінарної суміші складу . При температурі, відповідній лінії стяжки, склад рідини відповідає
. При температурі, відповідній лінії стяжки, склад рідини відповідає і складу пари
і складу пари .
.
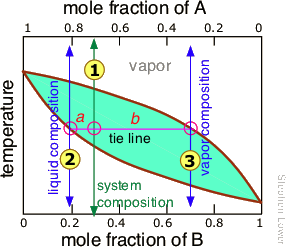
Отже, тепер для правила важеля: відносні кількості рідини і пари, які ми визначили вище, задаються довжинами відрізків краватки, маркованих a і b. Таким чином, в даному конкретному прикладі, в якому b приблизно в чотири рази довше, ніж a, можна сказати, що мольне співвідношення пари (складу) до рідини (складу
) дорівнює 4.
Етапи фракційної дистиляції
Непрактично проводити майже нескінченну кількість етапів дистиляції для отримання майже нескінченно малих кількостей двох чистих рідин, які ми хочемо розділити. Тому замість того, щоб збирати кожну краплю конденсату і повторно переганяти його, ми будемо дистилювати половину суміші на кожному етапі. Припустимо, ви хочете відокремити рідку суміш, що складається з 20 моль-% В і 80 моль-% А, причому A є більш летючою.
 Коли ми нагріваємо суміш, загальний склад якої позначається
Коли ми нагріваємо суміш, загальний склад якої позначається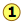 , перша пара утворюється при T 0 і має склад y 0, знайдений шляхом розширення горизонтальної пунктирної лінії, поки вона не відповідає кривій пари. Цей пар чітко збагачений B; якщо він конденсується, отримана рідина матиме мольну фракцію x B, що наближається до частки А в вихідній рідині. Але це тільки перша крапля, ми не хочемо зупинятися на досягнутому!
, перша пара утворюється при T 0 і має склад y 0, знайдений шляхом розширення горизонтальної пунктирної лінії, поки вона не відповідає кривій пари. Цей пар чітко збагачений B; якщо він конденсується, отримана рідина матиме мольну фракцію x B, що наближається до частки А в вихідній рідині. Але це тільки перша крапля, ми не хочемо зупинятися на досягнутому!
 У міру того як рідина продовжує кипіти, температура кипіння підвищується. Коли він досягне T 1, ми відкип'ятимо половину рідини. У цей момент «системний» склад (рідина плюс пар) все той же (
У міру того як рідина продовжує кипіти, температура кипіння підвищується. Коли він досягне T 1, ми відкип'ятимо половину рідини. У цей момент «системний» склад (рідина плюс пар) все той же ( ), але тепер порівну ділиться між рідиною, яку ми називаємо «залишком» R 1, і конденсованим паром, дистилятом D 1.
), але тепер порівну ділиться між рідиною, яку ми називаємо «залишком» R 1, і конденсованим паром, дистилятом D 1.
Звідки ми знаємо, що він розділений порівну? Ми підібрали T 1 так, щоб лінія стяжки була зосереджена на концентрації системи, тому за правилом важеля R 1 і D 1 містять рівні числа родимок.
 Тепер беремо згущену рідину Д 1, що має склад
Тепер беремо згущену рідину Д 1, що має склад , і переганяємо половину її, отримуючи дистилят складу Д 2.
, і переганяємо половину її, отримуючи дистилят складу Д 2.
 .. а потім провести ще одну перегонку, на цей раз використовуючи D 3 як нашу вихідну сировину.
.. а потім провести ще одну перегонку, на цей раз використовуючи D 3 як нашу вихідну сировину.
 Наше чотириступеневе фракціонування збагатило більш летючі розчинені речовини від 20 до трохи більше 80 моль-відсотків у D 4. Менш летючий компонент А найбільше концентрується в R 1. R 2 через R 4 викидаються (але не вниз мийку, будь ласка!)
Наше чотириступеневе фракціонування збагатило більш летючі розчинені речовини від 20 до трохи більше 80 моль-відсотків у D 4. Менш летючий компонент А найбільше концентрується в R 1. R 2 через R 4 викидаються (але не вниз мийку, будь ласка!)
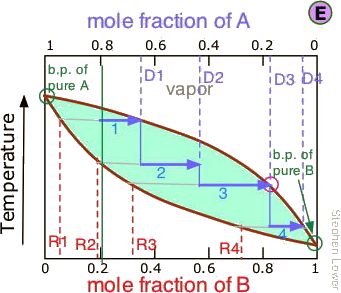
Цього може бути достатньо для деяких цілей, але ми можемо захотіти зробити набагато краще, використовуючи, можливо, 1000 етапів замість всього 4. Що може бути більш стомлюючим?
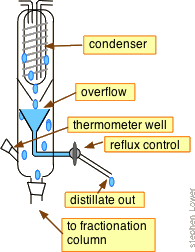
Фракціонування з рефлюксом
Не хвилюйтеся! Багаторазові послідовні перегонки можна проводити «віртуально», вставивши між колбою кипіння і конденсатором фракціонірующую колону.
Ці колони виготовляються з поглибленнями або заповнюються матеріалами, що забезпечують велику площу поверхні, що проходить через вертикальний температурний градієнт (більш висока температура біля дна, нижча температура вгорі). Ідея полягає в тому, що гарячі пари конденсуються на різних рівнях в колоні, і отримана рідина стікає вниз (рефлюксів) до нижчого рівня, де вона випаровується, що приблизно відповідає повторній перегонці.

Стовпці Vigreux, що мають кілька відступів, широко використовуються (вгорі праворуч). Прості колони можна зробити, заповнивши скляну трубку намистинами, короткими скляними трубками або навіть кухонними подушечками кухонного типу з нержавіючої сталі. Більш складні мають прядильні сталеві стрічки.
Ефективність поділу: теоретичні пластини
Експлуатацію фракціоніруючих колон найкраще зрозуміти по посиланню на колонку з бульбашками. Показаний тут складається з чотирьох секцій, або «пластин», через які гарячі пари піднімаються і бульбаються вгору через басейни конденсату, який збирається на кожній пластині. Інтимний контакт між парою і рідиною сприяє врівноваженню і повторній дистиляції при послідовно більш високих температурах на кожній вищій пластині в колоні. На відміну від випадку поетапної фракційної дистиляції, про яку ми говорили вище, жоден проміжний залишок не викидається; вони просто капають назад у горщик, де їх шлях фракціонування починається знову, завжди призводить до подальшої концентрації менш летючого компонента в рідині, що залишилася. У той же час пар, що виходить з верхньої плити (5), забезпечує безперервний потік збагаченого летючими речовинами конденсату, хоча і в зменшуваних кількостях, оскільки він виснажується в киплячому котлі.
Якщо повна рівновага досягається між рідиною і парою на кожному етапі, то ми можемо описати систему, проілюстровану вище, як забезпечує «п'ять теоретичних пластин» поділу (пам'ятайте, що горщик являє собою першу теоретичну тарілку.) Рівновага на кожному етапі вимагає сталого стану, при якому кількість пари, що рухається вгору на кожному етапі, дорівнює кількості рідини, що стікає вниз — іншими словами, колона повинна працювати в загальному флегмі, без чистого видалення дистиляту. Таким чином, будь-який реальний процес дистиляції буде експлуатуватися при коефіцієнті рефлюксу, що забезпечує оптимальне розділення за розумний період часу.
Деякі з більш просунутих пристроїв лабораторного типу (наприклад, деякі колони з прядильною сталевою стрічкою), як кажуть, пропонують до близько 200 теоретичних пластин розділової потужності.
Азеотропи: межі дистиляції
Діаграми температури кипіння, представлені в наведеному вище розділі, стосуються рішень, які поводяться досить ідеальним чином - тобто до рішень, які не відхиляються занадто далеко від закону Рауля. Як ми пояснювали вище, суміші рідин, міжмолекулярні взаємодії яких широко відрізняються, не поводяться ідеально, і може бути неможливо розділити звичайною дистиляцією. Причина цього полягає в тому, що при певних умовах склади рідини і пари, що знаходяться в рівновазі з нею, стають ідентичними, виключаючи будь-яке подальше поділ. Ці точки перетину відображаються як «перегини» на діаграмах температури кипіння.
Високо- і низькокиплячі азеотропи
Таким чином, на цій діаграмі температури кипіння для суміші, що демонструє позитивне відхилення від закону Рауля, послідовні фракції сумішей відповідають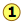 або або
або або наближають перегонку до азеотропного складу, зазначеному пунктирною вертикальною лінією. Як тільки ця точка буде досягнута, подальша дистиляція просто дає більше того ж «висококиплячого» азеотропу.
наближають перегонку до азеотропного складу, зазначеному пунктирною вертикальною лінією. Як тільки ця точка буде досягнута, подальша дистиляція просто дає більше того ж «висококиплячого» азеотропу.
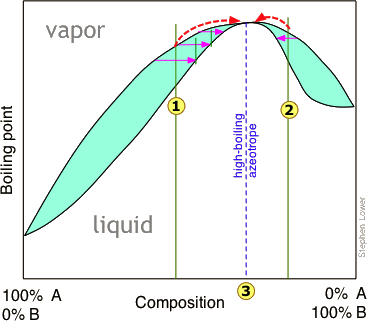
Перегонка суміші, що має негативне відхилення від закону Рауля, призводить до подібного тупику, в цьому випадку дає «низькокиплячий» азеотроп. Високо- і низькокиплячі азеотропи прийнято називати сумішами постійного кипіння, і вони зустрічаються частіше, ніж думає більшість людей.
«Розбиття» азеотропа
Існує чотири загальних способи боротьби з азеотропами. Перші два з них відомі в сукупності як азеотропна дистиляція.
- Додавання третьої речовини, яка змінює міжмолекулярні атракціони, є найпоширенішим трюком. Недолік полягає в тому, що для видалення цього іншого речовини зазвичай потрібна інша процедура.
- Перегонка під тиском використовує той факт, що діаграми точки кипіння (T, X) є двовимірними зрізами діаграми (T, X, P), в якій тиск є третьою змінною. Це означає, що азеотропний склад залежить від тиску, тому перегонка при деякому тиску, відмінному від 1 атм, може дозволити «стрибати» азеотропу.
- Використання молекулярного сита — пористого матеріалу, який вибірково поглинає одну з рідин, найчастіше воду, коли остання присутня в низькій концентрації.
- Здавайтеся. Часто буває, що азеотропний склад досить корисний, що зазвичай не варто турбувати отримання більш чистого продукту. Це пояснює концентрації багатьох комерційних хімічних речовин, таких як мінеральні кислоти.
| суміш | азеотроп |
|---|---|
| Етанол | 98%, високий, 78.1° C |
| Соляна кислота | 20.2% високий, 108.6 °C |
| плавикова кислота | 35.6%, 111.3°C |
| Азотна кислота | 68%, 120.5°C |
| Сірчана кислота | 98.3%, 338 °C |
Дистиляція етанолу
Етанол є однією з основних промислових хімікатів і, звичайно, є найважливішим компонентом напоїв, які були частиною цивілізації протягом усієї записаної історії. Більшість етанолу отримують шляхом бродіння крохмалю, присутнього в харчовому зерні, або цукрів, утворених ферментативною деградацією целюлози. Оскільки етанол токсичний для організмів, ферменти яких опосередковують процес бродіння, концентрація етанолу в ферментованої суміші зазвичай обмежується приблизно 15%. Потім рідку фазу суміші відокремлюють і переганяють.
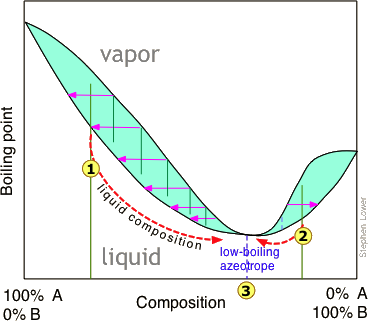
 Малюнок\(\PageIndex{8}\): При нормальній температурі кипіння етанолу становить 78,4° C, але його утворення низькокиплячого азеотропу з водою обмежує максимальну концентрацію, яку можна отримати звичайним перегонка до 95,6 об'єму-% (89,5 моль-%). Ця концентрація є достатньою для багатьох застосувань, для яких продукт зазвичай продається як "95% етану о л».
Малюнок\(\PageIndex{8}\): При нормальній температурі кипіння етанолу становить 78,4° C, але його утворення низькокиплячого азеотропу з водою обмежує максимальну концентрацію, яку можна отримати звичайним перегонка до 95,6 об'єму-% (89,5 моль-%). Ця концентрація є достатньою для багатьох застосувань, для яких продукт зазвичай продається як "95% етану о л».
Для застосувань, що вимагають безводного етанолу («абсолютний етанол «), найбільш поширеним методом є використання молекулярних сит на основі цеоліту для поглинання води, що залишилася. Додавання бензолу може порушити азеотроп, і це був найпоширеніший спосіб виробництва в попередні роки. Для певних критичних застосувань, де потрібен найчистіший етанол, він синтезується безпосередньо з етилену.
Спеціальні методи дистиляції
Тут коротко обговоримо два методи дистиляції, з якими студенти, ймовірно, зіткнуться в більш просунутих органічних лабораторних курсах.
Вакуумна дистиляція: Багато органічних речовин стають нестабільними при високих температурах, схильні до розкладання, полімеризації або реагування з іншими речовинами при температурі близько 200° C або вище. Рідина закипить, коли тиск її пари стане рівним тиску газу над нею, що зазвичай є тиском атмосфери. Якщо цей тиск знизити, кип'ятіння може відбуватися при більш низькій температурі. (Навіть чиста вода буде кипіти при кімнатній температурі під частковим вакуумом.) «Вакуумна дистиляція», звичайно, є неправильним; більш точним терміном буде «дистиляція зі зниженим тиском». Вакуумна дистиляція дуже часто проводиться в лабораторії і буде знайома студентам, які проходять більш просунуті органічні лабораторні курси. Він також іноді використовується у великих промислових масштабах.


Установка вакуумної дистиляції аналогічна тому, що застосовується при звичайній перегонці, з кількома доповненнями:
- Вакуумна лінія підключається до зігнутого адаптера над приймальною колбою.
- Щоб уникнути нерівномірного закипання і перегріву («натикання») кипляча колба зазвичай забезпечена дрібним капіляром («ебулліатором»), через який витік повітря утворює бульбашки, що зародять киплячу рідину.
- Вакуум зазвичай подається механічним насосом, рідше водяним аспіратором або лінією «домашній вакуум».
- Колбу для кипіння бажано нагрівати водяно- або паровою лазнею, що забезпечує більш ефективну передачу тепла колбі і дозволяє уникнути локалізованого перегріву. До приблизно 1960 року відкрите полум'я зазвичай використовувалося в студентських лабораторіях, що призвело до випадкових пожеж, які оживили другій половині дня, але погіршували лабораторні оцінки студента.
- Дистиляційна головка типу Клейзен (внизу) забезпечує зручний засіб доступу до колби для кипіння для введення капіляра витоку повітря або введення додаткової рідини через сепараторну воронку. Ця голова Клейзен-Вігрё включає колону фракціонування.
Парова дистиляція: Строго кажучи, ця тема не належить до цієї одиниці, оскільки парова дистиляція використовується для відділення незмішуваних рідин, а не розчинів. Але оскільки незмішувані рідкі суміші не обробляються на початкових курсах, ми представляємо тут короткий опис парової дистиляції на користь студентів, які можуть зіткнутися з нею на органічному лабораторному курсі. Суміш незмішуваних рідин буде кипіти, коли їх комбінований тиск пари досягне атмосферного. Цей комбінований тиск пари є лише сумою тиску пари кожної рідини окремо і не залежить від величин кожної присутньої фази.
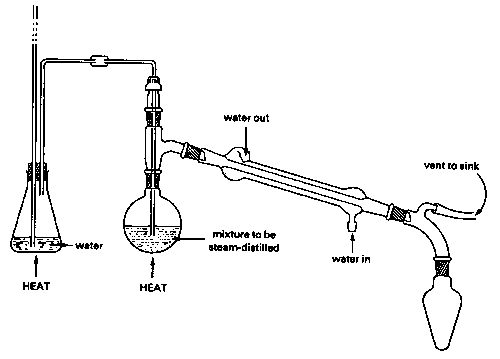
Оскільки вода закипає при 100° С, суміш води і рідини, що не змішується («масло»), навіть та, яка має високу температуру кипіння, гарантовано кипить нижче 100°, тому цей метод особливо цінний для відділення висококиплячих рідин від сумішей, що містять нелеткі домішки. Звичайно, водно-масляна суміш у приймальній колбі повинна сама бути відокремлена, але це, як правило, легко досягається за допомогою сепараторної воронки, оскільки їх щільність зазвичай різна.
Однак є підступ: чим нижче тиск пари масла, тим більша кількість води, яка спільно переганяється з ним. Це і є причиною використання пари: він забезпечує джерело води, здатне постійно відновлювати те, що втрачається з киплячої колби. Парова дистиляція з водно-масляної суміші без введення додаткової пари теж спрацює, і фактично використовується для якихось спеціальних цілей, але вихід продукту буде дуже обмежений. Парова дистиляція широко застосовується в таких галузях, як нафтопереробка (де її часто називають «парозачистка») і в ароматизаційно-парфумерної промисловості для виділення ефірних масел
Термін ефірне масло відноситься до ароматів («есенцій») цих [переважно простих] органічних рідин, які природним чином відбуваються в рослині, з яких вони виділяються паровою дистиляцією або екстракцією розчинником. Парова дистиляція була винайдена в 13 столітті Ібн аль-Байтером, одним з найбільших вчених і лікарів ісламського золотого століття в Андалусії.
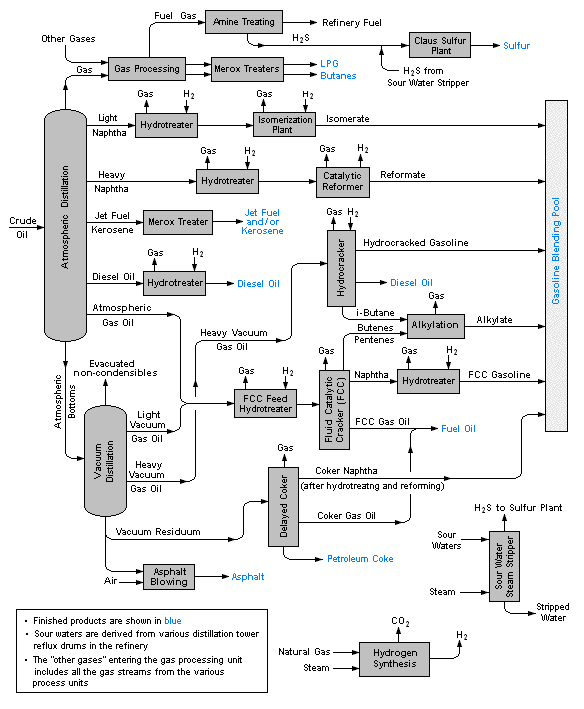
Дистиляція промислового масштабу та фракціонування нафти
Дистиляція є однією з основних «одиничних операцій» хімічної переробної промисловості, особливо тих, що пов'язані з переробкою нафти та біопалива, розділенням рідкого повітря та пивоварінням. Лабораторні дистиляції, як правило, періодичні операції і використовують відносно прості фракціонуючі колони для отримання чистого продукту. Навпаки, промислові дистиляції найчастіше призначені для отримання сумішей, що мають бажаний діапазон кипіння, а не чистих продуктів.
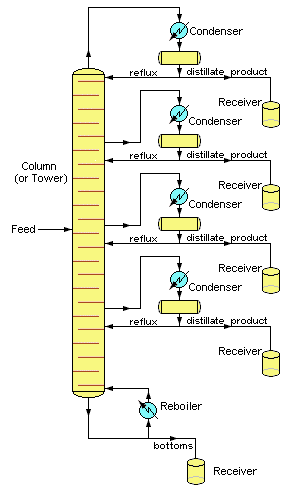
Промислові операції зазвичай використовують колони фракціонування бульбашок (рідко зустрічається в лабораторіях), хоча іноді використовуються упаковані колони. Мабуть, найбільш відмінною рисою великомасштабних промислових дистиляцій є те, що вони зазвичай працюють на безперервній основі, в якій попередньо розігріта сира суміш попередньо нагрівається в печі і подається в колону фракціонування в якійсь проміжній точці. Ребойлерний агрегат підтримує температуру дна на постійному значенні. Компоненти з вищим кипінням потім рухаються вниз до рівня, при якому вони випаровуються, тоді як більш легкий (низькокиплячий) матеріал рухається вгору, щоб конденсуватися у відповідній точці.
Нафта - це складна суміш багатьох типів органічних молекул, переважно вуглеводнів, які утворилися внаслідок впливу тепла та тиску на рослинні матеріали (переважно водорості), які росли в регіонах, де тектонічні рухи Землі поховали протягом мільйонів років. Ця суміш рідини і газів мігрує вгору через пористу породу, поки вона не затримана непроникним шаром осадової породи. Молекулярний склад сирої нафти (рідка фракція нафти) дуже мінливий, хоча її загальний елементний склад, як правило, відображає типові рослини.
| елемент | вуглецю | водню | азот | кисню | сірка | метали |
|---|---|---|---|---|---|---|
| кількість | 83-87% | 10-14% | 0,1-2% | 0,1-1,5% | 0,5-6% |
Основними молекулярними складовими сирої нафти є
- алкани: Також відомі як парафіни, це насичені молекули лінійного або розгалуженого ланцюга, що мають загальну формулу C n H 2 n +2, в якій n в основному знаходиться між 5 і 40.
- ненасичені аліфатичні: лінійні або розгалужені ланцюгові молекули, що містять одну або кілька подвійних або потрійних зв'язків (алкени або алкіни).
- Циклоалкани: Також відомі як нафтени, це насичені вуглеводні C n H 2 n, що містять одну або кілька кільцевих структур.
- Ароматичні вуглеводні:Вони містять одне або кілька плавлених бензольних кілець C n H n, часто з вуглеводневими бічними ланцюгами.
Слово бензин передує його використанню в якості моторного палива; вперше його використовували як місцеве ліки для позбавлення людей від головних вошей, а також для видалення жирних плям і плям з одягу. Першим основним кроком переробки є фракціонування сирої нафти в різні діапазони кипіння.
| діапазон кипіння | ім'я дробу | подальша обробка |
|---|---|---|
| бутан і пропан | переробки газу | |
| 30 - 210° | прямогонний бензин | змішування в автомобільний бензин |
| 100 - 200° | нафта | реформування в бензинові компоненти |
| 150 - 250° | гас | змішування реактивного палива |
| 160 - 400° | легкі газойли | змішування дистилятного палива в дизельне або мазут |
| 315 - 540° | важкий газойль | каталітичний крекінг: великі молекули розпадаються на менші і переробляються |
| > 450° | асфальти, днища | може бути дистильована у вакуумі на більшу кількість фракцій |
Подальша обробка та змішування
Близько 16% сирої нафти направляється в нафтохімічну промисловість, де вона використовується для виробництва етилену та іншої сировини для пластмас і подібних продуктів. Оскільки частка прямогонного бензину недостатня для задоволення попиту, деякі з більш легких фракцій піддаються реформінгу, а важчі - розтріскуються і переробляються в потік бензину. Ці процеси вимагають великої кількості переробки та змішування, в яку повинна бути вбудована значна гнучкість для задоволення сезонних потреб (більше летючих бензинів та нагрівання мазуту взимку, більше загальних обсягів бензину влітку).