8.8: Ідеальні проти реальних рішень
- Page ID
- 19276
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Опишіть фізичні причини того, що бінарний рідкий розчин може проявляти неідеальну поведінку
Популярна лікерна горілка складається в основному з етанолу (етилового спирту) і води приблизно в рівних порціях. Етанол і вода мають значний тиск пари, тому обидва компоненти сприяють загальному тиску газової фази над рідиною в закритому контейнері двох рідин. Можна очікувати, що тиск пари розчину етанолу та води буде прямо пропорційним сумам значень, передбачених законом Рауля для двох рідин окремо, але загалом цього не відбувається. Причину цього можна зрозуміти, якщо згадати, що закон Рауля відображає єдиний ефект: меншу частку випаровуються молекул (і, таким чином, їх знижена тенденція виходу), коли рідина розбавляється інакше «інертним» (нелетким) речовиною.
Ідеальні рішення
Є деякі рішення, компоненти яких досить уважно відповідають закону Раульта. Прикладом такого розчину є один, що складається з гексану С 6 Н 14 і гептану С 7 Н 16. Загальний тиск пари цього розчину змінюється прямолінійним способом із складом мольної фракції суміші.
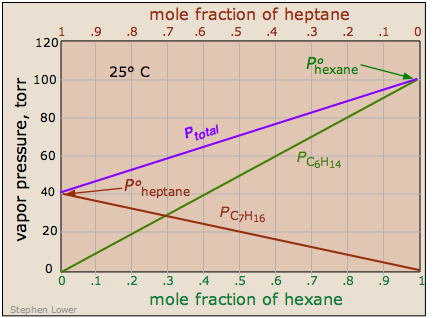
Зверніть увагу, що лусочки кротової фракції у верхній і нижній частині йдуть в протилежних напрямках, так як за визначенням,
\[\chi_{hexane} = 1 – \chi_{heptane}\]
Якщо це рішення поводиться ідеально, то сума ділянок закону Рауля для двох чистих сполук:
\[P_{total} = P_{ heptane } + P_{ hexane }\]
Ідеальним рішенням є той, чий тиск пари відповідає закону Рауля у всьому діапазоні композицій. Досвід показав рішення, що приблизна ідеальна поведінка складається з молекул, що мають дуже схожі структури. Таким чином, гексан і гептан є лінійними вуглеводнями, які відрізняються лише однією групою —CH 2. Це дає пряму підказку до основної причини неідеальної поведінки в розчині летких рідин. В ідеальному рішенні взаємодії є, але всі вони енергетично ідентичні. Таким чином, в ідеальному розчині молекул A і B, A—A і B—B атракціони збігаються з атракціонами A—B. Це відбувається тільки тоді, коли два компоненти хімічно і конструктивно дуже схожі.
Ідеальні рішення проти ідеальних газів
Ідеальне рішення принципово відрізняється від визначення ідеального газу, визначеного як гіпотетична речовина, що слідує закону ідеального газу. Кінетична молекулярна теорія, яка пояснює ідеальну поведінку газу, передбачає, що молекули не займають місця і що міжмолекулярні атракціони повністю відсутні.
Визначення ідеального газу явно непридатне до рідин, обсяги яких безпосередньо відображають обсяги їх складових молекул. І звичайно, сама здатність молекул утворювати конденсовану фазу обумовлена силами притягання між молекулами. Тому найбільше, що ми можемо сказати про ідеальне рішення, полягає в тому, що атракціони між усіма його молекулами ідентичні - тобто молекули типу А так само сильно притягуються до інших молекул А, як і молекули B-типу. Ідеальні рішення абсолютно демократичні: немає фаворитів.
Реальні рішення
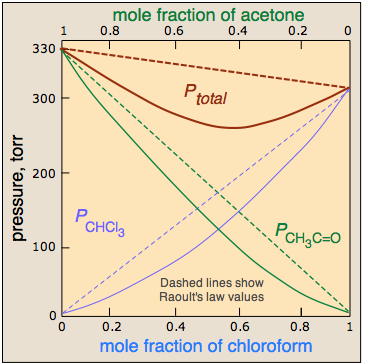
Реальні рішення більше схожі на реальні суспільства, в яких одні члени «більш рівні, ніж інші». Припустимо, наприклад, що на відміну від молекул сильніше притягуються один до одного, ніж схожі на молекули. Це призведе до того, що пари A—B, які опиняються поруч один з одним, будуть енергетично більш стабільними, ніж пари A—A та B-B. При складах, в яких присутня значна кількість обох видів молекул, їх схильність до виходу з розчину - і, отже, тиск пари розчину, буде падати нижче того, що було б, якби взаємодії між усіма молекулами були однаковими. Це породжує негативне відхилення від закону Рауля. Наочним прикладом є система хлороформ-ацетон, проілюстрована вище.
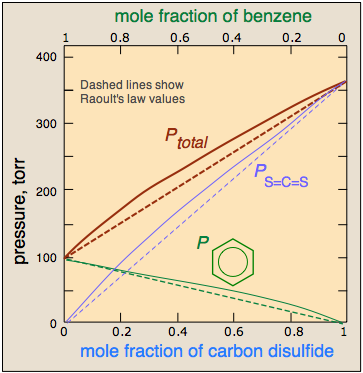
І навпаки, якщо подібні молекули кожного виду більше притягуються один до одного, ніж до несхожих, то молекули, які виявляються близькими до свого роду, будуть стабілізовані. При складах, що наближаються до 50 моль-відсотків, молекули A і B поблизу один одного будуть легше виходити з розчину, що, отже, буде демонструвати більш високий тиск пари, ніж це було б інакше. Не слід дивувати молекули, такі різні, як бензол, і\(CS_2\) повинні сильніше взаємодіяти зі своїми подібними, звідси і позитивне відхилення, проілюстроване тут.
Нагадаємо, що всі гази наближаються до ідеальної поведінки, оскільки їх тиск наближається до нуля. Точно так само, як кротова частка будь-якого компонента наближається до єдності, поведінка рішення наближається до ідеальності. Це простий наслідок того, що на цих межах кожна молекула оточена переважно своїм виглядом, і нечисленні взаємодії А-В матимуть незначний ефект. Таким чином, закон Рауля є обмежуючим законом:
\[P_i = \lim_{x_i \rightarrow 0} P^o \chi_i\]
він дає парціальний тиск речовини, що знаходиться в рівновазі з розчином, все тісніше, коли мольна частка цієї речовини наближається до одиниці.
