8.7: Колігативні властивості та ентропія
- Page ID
- 19288
Всі чотири ефекти розчину (знижений тиск пари, депресія температури замерзання, підвищення температури кипіння, осмотичний тиск) виникають внаслідок «розведення» розчинника доданою розчинною речовиною. Через таку спільність їх відносять до колігативних властивостей (лат. з лігаром, підключений до.) Ключова роль концентрації розчинника прихована значно спрощеними виразами, що використовуються для обчислення величини цих ефектів, в яких з'являється лише концентрація розчиненої речовини. Деталі того, як проводити ці розрахунки та багато важливих застосувань колігативних властивостей, розглядаються в інших місцях. Наша мета тут - запропонувати більш повне пояснення того, чому відбуваються ці явища.
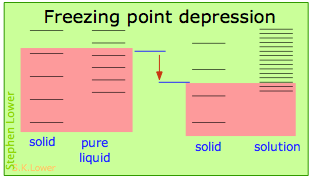
В основному, все це є результатом впливу розведення розчинника на його ентропію, а отже, збільшення щільності енергетичних станів системи в розчині в порівнянні з такою в чистій рідині. Рівновага між двома фазами (рідина-газ для кипіння і тверда рідина для заморожування) виникає, коли енергетичні стани в кожній фазі можуть бути заселені з однаковою щільністю. Температури, при яких це відбувається, зображуються затіненням.
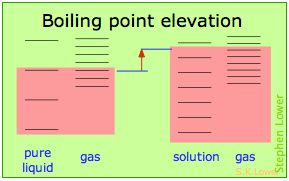
- Розведення розчинника додає рідини нові енергетичні стани, але не впливає на парову фазу. Це підвищує температуру, необхідну для того, щоб зробити рівну кількість мікростанів доступними в двох фазах.
- Розведення розчинника додає рідини нові енергетичні стани, але не впливає на тверду фазу. Це знижує температуру, необхідну для того, щоб зробити рівну кількість станів доступними в двох фазах.
Вплив тиску на ентропію: Осмотичний тиск
Коли рідина піддається гідростатичному тиску - наприклад, інертним, що не розчиняється газом, який займає паровий простір над поверхнею, тиск пари рідини підвищується. Тиск діє на стиснення рідини дуже незначно, ефективно звужуючи потенційну енергетичну яму, в якій проживають окремі молекули, і тим самим збільшуючи їх схильність до виходу з рідкої фази. (Оскільки рідини не дуже стисливі, ефект досить малий; застосований тиск 100 атм підніме тиск пари води при 25° C лише приблизно на 2 торр.) З точки зору ентропії можна сказати, що прикладається тиск зменшує розміри «коробки», всередині якої основні поступальні рухи молекул обмежені всередині рідини, тим самим знижуючи щільність енергетичних станів в рідкій фазі.
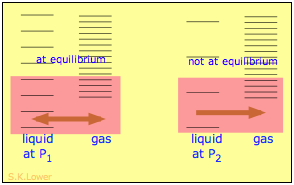
Застосування гідростатичного тиску до рідини збільшує відстань її мікростанів, так що кількість енергетично доступних станів в газі, хоча і незмінних, є відносно більшою - тим самим збільшуючи тенденцію молекул до виходу в парову фазу. Що стосується вільної енергії, то більш високий тиск підвищує вільну енергію рідини, але не впливає на енергію газової фази.
Цим явищем можна пояснити осмотичний тиск. Осмотичний тиск, слід нагадати студентам, це не те, що рухає осмосом, а скоріше гідростатичний тиск, який необхідно застосовувати до більш концентрованого розчину (більш розбавленого розчинника), щоб зупинити осмотичний потік розчинника в розчин. Ефект цього тиску\(\Pi\) полягає в тому, щоб трохи збільшити відстань між енергетичними станами розчинника на стороні мембрани високого тиску (розбавлений розчинник), щоб відповідати чистим розчинником, відновлюючи осмотичну рівновагу.
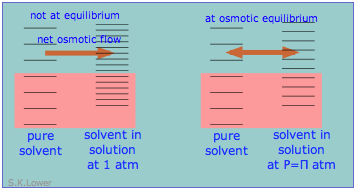
Осмотичний тиск не рухає осмосом, а є, скоріше, гідростатичним тиском, який необхідно застосовувати до більш концентрованого розчину (більш розбавленого розчинника), щоб зупинити осмотичний потік розчинника в розчин.
