6.4: Кінетична молекулярна теорія (огляд)
- Page ID
- 19153
Переконайтеся, що ви добре розумієте наступні основні ідеї, які представлені нижче. Особливо важливо, щоб ви знали основні припущення кінетико-молекулярної теорії. Їх можна розділити на ті, які відносяться до природи самих молекул, і ті, що описують характер їх рухів:
- Молекули - мізерно малий обсяг, відсутність інермолекулярних атракціонів (думайте про них як про дуже твердих, «нелипких» предметах.)
- Їх рухи - Повністю випадкові в напрямку, тільки по прямих лініях (це наслідок їх відсутності атракціонів), середні швидкості, пропорційні абсолютній температурі..
- Думка про те, що випадкові рухи окремих молекул можуть призвести до невипадкового (спрямованого) руху газу в цілому, є одним з найважливіших понять хімії, прикладом якого є принцип дифузії.
- У більшості курсів ви будете знати і мати можливість використовувати (або зловживати!) Закон Грема.
Такі властивості, як температура, тиск та об'єм, разом з іншими залежними від них (щільність, теплопровідність тощо) відомі як макроскопічні властивості речовини; це властивості, які можна спостерігати в об'ємній речовині, без посилання на її основну структуру або молекулярну природа. До кінця 19 століття атомна теорія матерії була досить добре прийнята, що вчені почали пов'язувати ці макроскопічні властивості з поведінкою окремих молекул, які описуються мікроскопічними властивостями речовини. Результатом цих зусиль стала кінетична молекулярна теорія газів. Ця теорія застосовується суворо лише до гіпотетичної речовини, відомої як ідеальний газ; однак ми побачимо, що за багатьох умов вона досить точно описує поведінку реальних газів при звичайних температурах і тисках і служить відправною точкою для боротьби з більш складними стани матерії.
Основні ідеї кінетико-молекулярної теорії
«Кінетико-молекулярна теорія газів» може звучати досить нав'язливо, але вона заснована на низці легко зрозумілих припущень, які разом узяті складають модель, яка значно спрощує наше розуміння газоподібного стану речовини. П'ять основних принципів кінетико-молекулярної теорії такі:
- Газ складається з молекул, які розділені середніми відстанями, які набагато більше розмірів самих молекул. Обсяг, зайнятий молекулами газу, мізерно малий в порівнянні з обсягом самого газу.
- Молекули ідеального газу не надають ніяких притягальних сил ні один на одного, ні на стінки ємності.
- Молекули знаходяться в постійному випадковому русі, і як матеріальні тіла вони підкоряються законам руху Ньютона. Це означає, що молекули рухаються прямими лініями (див. демонстраційну ілюстрацію зліва), поки вони не зіткнуться один з одним або зі стінками контейнера.
- Зіткнення ідеально еластичні; при зіткненні двох молекул вони змінюють свої напрямки і кінетичні енергії, але загальна кінетична енергія зберігається. Зіткнення не є «липкими».
- Середня кінетична енергія молекул газу прямо пропорційна абсолютній температурі. Зверніть увагу, що термін «середній» тут дуже важливий; швидкості та кінетичні енергії окремих молекул будуть охоплювати широкий діапазон значень, а деякі навіть матимуть нульову швидкість в даний момент. Це означає, що всі молекулярні рухи припинилися б, якби температура була знижена до абсолютного нуля.
Згідно з цією моделлю велика частина обсягу, зайнятого газом, - це порожній простір; це головна особливість, яка відрізняє гази від конденсованих станів речовини (рідин і твердих тіл), в яких постійно контактують сусідні молекули. Молекули газу знаходяться в швидкому і безперервному русі; при звичайних температурах і тисках їх швидкості становлять близько 0,1-1 км/с, і кожна молекула переживає приблизно 10 10 зіткнень з іншими молекулами щосекунди.
Газові закони пояснили
Якщо гази насправді складаються з широко відокремлених частинок, то спостережувані властивості газів повинні бути зрозумілі з точки зору простої механіки, яка керує рухами окремих молекул. Кінетична молекулярна теорія дозволяє легко зрозуміти, чому газ повинен чинити тиск на стінки контейнера. Будь-яка поверхня, що контактує з газом, постійно бомбардується молекулами.
При кожному зіткненні молекула, що рухається з імпульсом mv, вражає поверхню. Оскільки зіткнення пружні, молекула відскакує назад з тією ж швидкістю в зворотному напрямку. Ця зміна швидкості Δ V еквівалентна a n accelerati o n a; відповідно до другого закону Ньютона, сила f = ma, таким чином, діє на поверхню площі А, що чинить тиск P = f/a.
Кінетична інтерпретація температури
Відповідно до кінетичної молекулярної теорії середня кінетична енергія ідеального газу прямо пропорційна абсолютній температурі. Кінетична енергія - це енергія, яку тіло має в силу свого руху:
\[ K.E. = \dfrac{mv^2}{2}\]
З підвищенням температури газу середня швидкість молекул буде збільшуватися; подвоєння температури збільшить цю швидкість в чотири рази. Зіткнення зі стінками контейнера передадуть більше імпульсу, а значить, і більшої кінетичної енергії, стінам. Якщо стінки прохолодніші, ніж газ, вони стануть теплішими, повертаючи газу менше кінетичної енергії і змушуючи його охолоджуватися до досягнення теплової рівноваги. Оскільки температура залежить від середньої кінетичної енергії, поняття температури застосовується лише до статистично значущої вибірки молекул. Далі ми будемо говорити про молекулярні швидкості та кінетичні енергії.
- Кінетичне пояснення закону Бойла: закон Бойла легко пояснюється кінетичною молекулярною теорією. Тиск газу залежить від кількості разів на секунду, коли молекули вражають поверхню контейнера. Якщо ми стискаємо газ до меншого об'єму, така ж кількість молекул зараз діє проти меншої площі поверхні, тому кількість ударів на одиницю площі, і, отже, тиск, тепер більше.
- Кінетичне пояснення закону Чарльза: Кінетична молекулярна теорія стверджує, що підвищення температури підвищує середню кінетичну енергію молекул. Якщо молекули рухаються швидше, але тиск залишається колишнім, то молекули повинні триматися далі один від одного, так що збільшення швидкості зіткнення молекул з поверхнею ємності компенсувалося відповідним збільшенням площі цієї поверхні в міру розширення газу.
- Кінетичне пояснення закону Авогадро: Якщо збільшити кількість молекул газу в закритій ємності, більша їх кількість буде стикатися зі стінками за одиницю часу. Якщо тиск залишиться постійним, обсяг повинен збільшуватися пропорційно, щоб молекули вдарили по стінках рідше, і по більшій площі поверхні.
- Кінетичне пояснення закону Дальтона: «Кожен газ - це вакуум для будь-якого іншого газу». Саме так Далтон заявив те, що ми зараз знаємо як його закон парціального тиску. Це просто означає, що кожен газ, присутній в суміші газів, діє незалежно від інших. Це має сенс через один з фундаментальних принципів теорії КМТ, що молекули газу мають незначні обсяги. Отже, газ А в суміші А і В діє так, ніби газу В там взагалі не було. Кожен вносить свій власний тиск до загального тиску всередині ємності, пропорційно частці молекул, які він представляє.
Деякі важливі практичні застосування КМТ
Молекули газу знаходяться в стані вічного руху, в якому швидкість (тобто швидкість і напрямок) кожної молекули абсолютно випадкова і не залежить від швидкості інших молекул. Це фундаментальне припущення кінетико-молекулярної моделі допомагає нам зрозуміти широкий спектр поширених явищ.
Дифузія: випадковий рух з напрямком
Дифузія відноситься до транспорту речовини через градієнт концентрації; правило полягає в тому, що речовини рухаються (або мають тенденцію рухатися) з областей більш високої концентрації до областей меншої концентрації. Дифузія чаю з чайного пакетика у воду, або парфуми від людини, є поширеними прикладами; ми не очікували б побачити будь-який процес відбувається в зворотному напрямку!
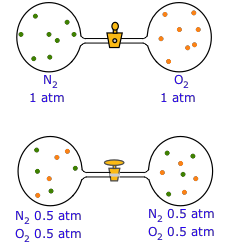
Коли запірний кран відкритий, випадкові рухи змушують кожен газ дифузіроваться в іншу ємність. Після завершення дифузії (знизу) окремі молекули обох видів продовжують проходити між колбами в обидві сторони.
Спочатку може здатися дивним, що випадкові рухи молекул можуть призвести до цілком передбачуваного дрейфу їх остаточного розподілу. Ключем до цього очевидного парадоксу є відмінність між індивідом і населенням. Хоча нічого не можна сказати про долю окремої молекули, поведінка великої колекції («популяції») молекул підпорядковується законам статистики. Це точно аналогічно тому, як страхові актуарні таблиці можуть точно передбачити середнє довголіття людей в даному віці, але не дають ніякої інформації про долю жодної окремої людини.
Випіт і закон Грема
Якщо в стінці судини, що містить газ, зробити крихітний отвір, то швидкість, з якою молекули газу витікають з ємності, буде пропорційна кількості молекул, які стикаються з одиницею площі стінки в секунду, а значить, з середньоквадратичним - середньою швидкістю молекул газу. Цей процес, коли він проводиться в ідеалізованих умовах, відомий як випіт.
Близько 1830 року англійський хімік Томас Грем (1805-1869) виявив, що відносні швидкості, при яких два різних гази при однаковій температурі і тиску будуть стікати через однакові отвори обернено пропорційні квадратному кореню його молярної маси.
\[v \propto \dfrac{1}{\sqrt{M}}\]
Закон Грема, як відомо це відношення, є простим наслідком співвідношення квадрат-корінь між швидкістю тіла та його кінетичною енергією.
Відповідно до кінетичної молекулярної теорії, молекули двох газів при однаковій температурі матимуть однакову середню кінетичну енергію. Якщо v 1 і v 2 - середні швидкості двох видів молекул, то при будь-якій заданій температурі KE 1 = KE 2 і
\[\dfrac{m_1v_1^2}{2} = \dfrac{m_2v_2^2}{2}\]
або, з точки зору молярних мас\(M\),
\[ \color{red} { \dfrac{v_1}{v_2} = \sqrt{\dfrac{M_2}{M_1}}}\]
Таким чином, середня швидкість більш легких молекул повинна бути більшою, ніж у більш важких молекул, і співвідношення цих швидкостей буде задаватися зворотним співвідношенням квадратних коренів молекулярних мас. Хоча закон Грема застосовується саме тоді, коли газ дифундує у вакуум, закон дає корисні оцінки відносних швидкостей дифузії в більш практичних умовах, і він дає уявлення про широкий спектр явищ, які залежать від відносних середніх швидкостей молекул різних мас.
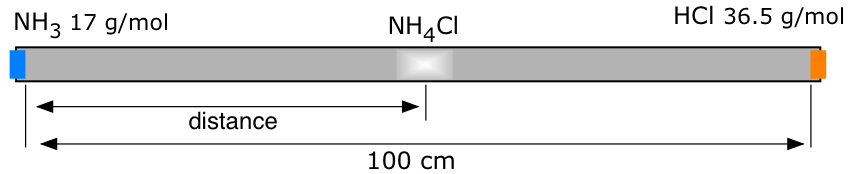
Скляна трубка, показана вище, має бавовняні пробки, вставлені з обох кінців. Пробку зліва змочують декількома краплями водного нашатирного спирту, з якого повільно витече\(NH_3\) газ. Пробка справа аналогічно змочується міцним розчином соляної кислоти, з якої\(HCl\) виходить газоподібна. Гази розсіюються в протилежних напрямках всередині трубки; в точці, де вони зустрічаються, вони об'єднуються, утворюючи твердий хлорид амонію, який спочатку з'являється у вигляді білого туману, а потім починає покривати внутрішню частину трубки.
Реакція така
\[NH_{3(g)} + HCl_{(g)} \rightarrow NH_4Cl_{(s)}\]
- У якій частині трубки (зліва, справа, центр) вперше буде спостерігатися NH 4 Cl?
- Якщо відстань між двома кінцями трубки становить 100 см, скільки см від лівого кінця трубки утвориться перший NH 4 Cl?
Рішення
а) Більш легкі молекули аміаку будуть розсіюватися швидше, тому точка, де зустрічаються два гази, буде десь у правій половині трубки.
б) Співвідношення швидкостей дифузії аміаку (v 1) і хлористого водню (v 2) можна оцінити за законом Грема:
\[ \dfrac{v_1}{v_2} = \sqrt{\dfrac{36.5}{17}} = 1.46\]
Тому ми можемо призначити відносні швидкості двох газів як\(v_1 = 1.46\) і\(v_2 = 1\). Зрозуміло, що місце зустрічі буде прямо пропорційно v 1. Вона буде, по суті, пропорційна співвідношенню v 1/(v 1 + v 2) *:
\[ \dfrac{v_1}{v_1+v_2} \times 100\; cm = \dfrac{1.46}{1.46 + 1.00} \times 100\, cm = 59 \;cm \]
*Щоб побачити, як це співвідношення було виведено, розглянемо, що буде відбуватися в трьох особливих випадках, коли v 1 = 0, v 2 = 0, і v 1 = v 2, для яких відстані (від лівого кінця) будуть 0, 50 і 100 см, відповідно. Повинно бути зрозуміло, що більш просте співвідношення v 1/v 2 призведе до абсурдних результатів.
Зверніть увагу, що вищевказаний розрахунок - це лише кошторис. Закон Грема суворо діє лише за особливих умов, найважливішим з яких є відсутність інших газів. На відміну від того, що написано в деяких підручниках і часто викладається, закон Грема не точно прогнозує відносні швидкості виходу різних компонентів газоподібної суміші у зовнішнє повітря, а також не дає швидкості, з якою два гази будуть розсіюватися через інший газ, такий як повітря. Див. Зловживання законами Грема Стівен Дж. Хоукс, Дж. Chem. Освіта 1993 70 (10) 836-837
Збагачення урану
Одним із застосувань цього принципу, яке спочатку запропонував сам Грем, але не було реалізовано на практичній основі лише через століття, є поділ ізотопів. Найважливішим прикладом є збагачення урану при виробництві ядерного палива поділу.

Завод газоподібної дифузії К-25 був одним з основних джерел збагаченого урану під час Другої світової війни. Вона була завершена в 1945 році і зайняла 12 000 робітників. Через секретність Манхеттенського проекту жінки, які експлуатували систему, не знали про призначення заводу; їх навчили просто спостерігати за датчиками та повертати циферблати для того, що їм сказали, було «урядовим проектом».
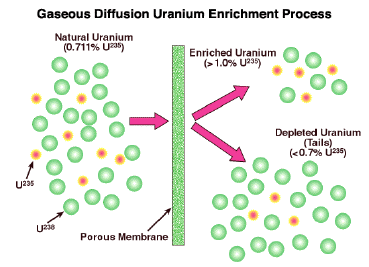
Уран складається здебільшого з U 238, з лише 0,7% ділиться ізотопу U 235. Уран, звичайно, метал, але він реагує з фтором, утворюючи газоподібний гексафторид, UF 6. У дуже успішному процесі газоподібної дифузії UF 6 багаторазово дифузіруется через пористу стінку. Кожен раз, легше ізотоп проходить через трохи швидше, ніж важче один, дає суміш, яка трохи багатша в U 235. Процес повинен бути понад тисячу разів, щоб досягти бажаного ступеня збагачення. Розробка великомасштабної дифузійної установки була ключовою частиною розробки США першої атомної бомби в 1945 році. Цей процес зараз застарілий, змінившись іншими методами.
Коливання щільності: чому небо блакитне?
Дифузія гарантує, що молекули будуть швидко розподілятися по всьому об'єму, зайнятому газом, ретельно рівномірним чином. Шанси практично нульові, що достатньо більше молекул можуть на мить опинитися біля однієї сторони контейнера, ніж інша, щоб призвести до помітної тимчасової щільності або різниці тиску. Це результат простої статистики. Але статистичні прогнози дійсні лише тоді, коли вибіркова популяція велика.

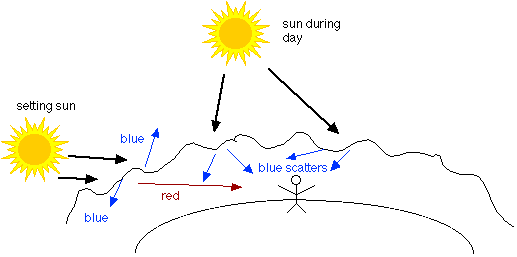
Розглянемо, що буде, якщо розглядати вкрай малі обсяги простору: кубики, які приблизно по 10 -7 см з кожного боку, наприклад. Така клітина буде містити лише кілька молекул, і в будь-який момент ми очікуємо знайти деякі, що містять більше або менше, ніж інші, хоча з часом вони будуть в середньому до того ж значення. Ефект такої статистичної поведінки полягає в тому, щоб викликати випадкові коливання щільності газу на відстанях, порівнянних з розмірами видимих світлових хвиль. Коли світло проходить через середовище, щільність якого неоднорідна, частина світла розсіюється. Вид розсіювання через випадкові коливання щільності називається розсіюванням Релея, і він має властивість впливати (розсіювати) більш короткі довжини хвиль ефективніше, ніж більші довжини хвиль. Чисте небо виглядає синім кольором, оскільки синій (коротша довжина хвилі) компонент сонячного світла розсіюється більше. Довші довжини хвиль залишаються на шляху сонячного світла, доступні, щоб радувати нас на сході або заході сонця.
[джерело]
Те, що ми обговорювали, - це форма того, що відомо як флуктуаційні явища. Як показує анімація, випадкові коливання тиску газу з обох сторін не завжди повністю скасовуються, коли щільність молекул (тобто тиску) досить мала.

Лампи розжарювання
Цікавим додатком, що включає кілька аспектів кінетичної молекулярної поведінки газів, є використання газу, як правило, аргону, для продовження терміну служби ламп розжарювання. Як лампочки використовується, атоми вольфраму випаровуються з нитки розжарювання і конденсуються на внутрішній стінці кулера колби, почорнівши її і зменшуючи світловіддачу. Оскільки нитка розжарювання стає тоншою в певних місцях, підвищений електричний опір призводить до більш високого локального розсіювання потужності, більш швидкого випаровування, і врешті-решт нитка розривається.
Тиск всередині лампової лампи повинен бути досить низьким, щоб середній вільний шлях молекул газу був досить довгим; інакше тепло проводилося б від нитки розжарювання занадто швидко, і лампочка розплавиться. (Теплопровідність залежить від міжмолекулярних зіткнень, а довший середній вільний шлях означає меншу частоту зіткнення). Повний вакуум мінімізував би теплопровідність, але це призведе до такого довгого середнього вільного шляху, що атоми вольфраму швидко мігрують до стінок, що призводить до дуже короткого терміну служби нитки та великого почорніння колби.
Близько 1910 року компанія General Electric найняла Ірвінга Ленгмюра в якості одного з перших хіміків, які були працевлаштовані в якості промислового вченого в Північній Америці. Ленгмюр швидко побачив, що почорніння цибулини є наслідком довгого середнього вільного шляху випарованих атомів вольфраму, і він показав, що додавання невеликої кількості аргону зменшить середній вільний шлях, збільшуючи ймовірність того, що рухається назовні атом вольфраму зіткнеться з атомом аргону. Певна частка з них врешті-решт знайде свій шлях назад до нитки, частково відновивши її.
Криптон був би кращим вибором газу, ніж аргон, оскільки його більша маса була б більш ефективною при зміні напрямку досить важкого атома вольфраму. На жаль, криптон, будучи більш рідкісним газом, коштує приблизно в 50 разів дорожче аргону, тому використовується тільки в «преміальних» лампочках. Зовсім недавно розроблена лампа галогенного циклу - цікавий хімічний метод продовження терміну служби вольфрамової лампи розжарювання.
в'язкість газів
Гази, як і всі рідини, виявляють опір потоку, властивість, відоме як в'язкість. Основною причиною в'язкості є випадковий характер термоіндукованого молекулярного руху. Для того щоб змусити рідину через трубу або трубку, на тепловий рух необхідно накладати додаткове невипадкове поступальне рух.
Однак є невелика проблема. Молекули, що протікають поблизу центру труби, стикаються в основному з молекулами, що рухаються в одному напрямку приблизно з однаковою швидкістю, але ті, що трапляється опинитися біля стіни, будуть відчувати часті зіткнення зі стіною. Оскільки молекули в стінці труби не рухаються у напрямку потоку, вони, як правило, поглинають більше кінетичної енергії, ніж повертаються, в результаті чого молекули газу, найближчі до стінки труби, втрачають частину свого прямого імпульсу. Їх випадковий тепловий рух врешті-решт забере їх глибше в потік, де вони зіткнуться з іншими текучими молекулами і сповільнять їх. Це породжує опір потоку, відомий як в'язкість; це причина, чому довгі газотранспортні трубопроводи повинні мати насосні станції кожні 100 км або близько того.
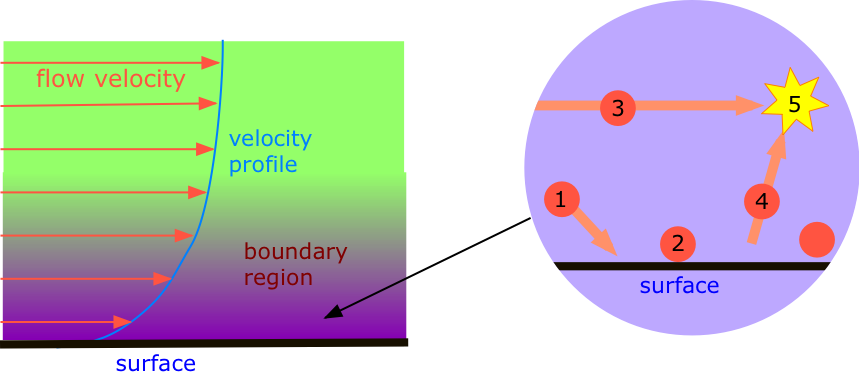
Як відомо, такі рідини, як сироп або мед, виявляють меншу в'язкість при більш високих температурах, оскільки підвищена теплова енергія зменшує вплив міжмолекулярних атракціонів, тим самим дозволяючи молекулам легше ковзати один навколо одного. Гази, однак, поводяться як раз навпаки; в'язкість газу виникає внаслідок перенесення імпульсу, викликаного зіткненням, від швидко рухаються молекул до повільних, які були звільнені з прикордонного шару. Чим вище температура, тим швидше молекули рухаються і стикаються один з одним, тим вище в'язкість.
Розподіл молекул газу в гравітаційному полі
Всім відомо, що тиск повітря знижується з висотою. Цей ефект легко зрозуміти якісно через кінетичну молекулярну теорію. Випадковий тепловий рух має тенденцію рухатися молекули газу у всіх напрямках однаково. Однак при наявності гравітаційного поля руху в напрямку вниз трохи сприятливі. Це призводить до того, що концентрація, і, отже, тиск газу буде більшим на нижчих висотах і зменшуватися без обмеження на більш високих висотах.
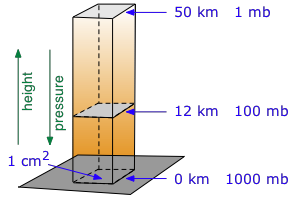
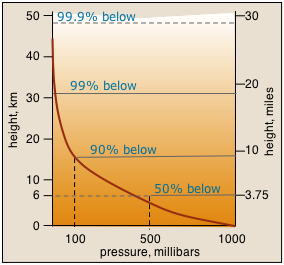
Тиск на будь-якій висоті у вертикальному стовпі рідини обумовлено вагою рідини над нею. Це призводить до того, що тиск зменшується експоненціально з висотою.
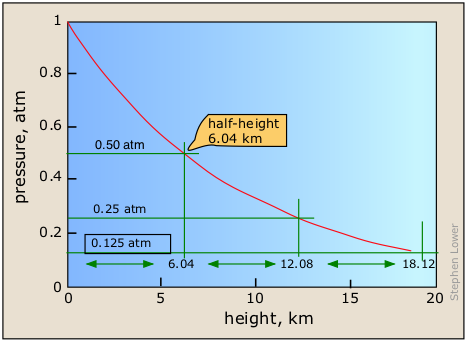
Точна функціональна залежність між тиском і висотою відома як закон барометричного розподілу. Він легко виводиться за допомогою обчислення першого року. Для повітря при 25°C тиск P h на будь-якій висоті задається
\[P_h = P_o e^{–.011h}\]
в якому\(P_o\) знаходиться тиск на рівні моря.
Це форма дуже поширеного закону експоненціального розпаду, з яким ми зіткнемося в декількох різних контекстах в цьому курсі. Закон експоненціального розпаду (або зростання) описує будь-яку величину, швидкість зміни якої прямо пропорційна її поточній вартості, наприклад, сума грошей на накопичувальному рахунку за складними відсотками або щільність стовпа газу на будь-якій висоті. Найголовніша особливість будь-якої величини, описаної цим законом, полягає в тому, що дробова швидкість зміни розглянутої величини (в даному випадку Δ Р/П або в численні, DP/p) є постійною. Це означає, що збільшення висоти, необхідного для зниження тиску вдвічі, також є постійною, приблизно на 6 км у випадку Землі.
Оскільки важчі молекули будуть сильніше впливати на гравітацію, їх концентрації будуть швидше падати з підвищенням. З цієї причини парціальний тиск різних компонентів атмосфери буде, як правило, змінюватися в залежності від висоти. На різницю тиску впливає і температура; при більш високих температурах відбувається більше теплового руху, а отже, і менш швидке падіння тиску з висотою. Завдяки атмосферній конвекції та турбулентності ці ефекти не спостерігаються в нижній частині атмосфери, але в самих верхніх частинях атмосфери важчі молекули мають тенденцію дрейфувати вниз.
Іоносфера та радіозв'язок
При дуже низьких тисках середні вільні шляхи досить великі, що зіткнення між молекулами стають досить нечастими. За цих умов високореактивні форми, такі як іони, атоми та молекулярні фрагменти, які зазвичай руйнуються при кожному зіткненні, можуть зберігатися протягом помітних періодів часу.
Найважливіший приклад цього відбувається у верхній частині атмосфери Землі, на висоті 200 км, при тиску близько 10 -7 атм. Тут середній вільний шлях буде в 10 7 разів більше його значення при 1 атм, або близько 1 м У цій частині атмосфери, відомій як термосфера, в хімії переважають такі види, як O, O 2 + і HO, які утворюються під дією інтенсивного сонячного ультрафіолету світло на нормальні атмосферні гази біля вершини стратосфери. Високі концентрації електрично заряджених видів у цих регіонах (іноді їх також називають іоносферою) відображають радіохвилі і відповідають за всесвітню передачу радіосигналів середньої частоти.
Щільність іонів в нижній частині іоносфери (близько 80 км висоти) настільки велика, що випромінювання радіостанцій широкомовного діапазону поглинається в цій області до того, як ці хвилі зможуть досягти відбивних висотних шарів. Однак тиск у цій області (відомий як D-шар) досить великий, що іони рекомбінуються незабаром після місцевого заходу сонця, викликаючи зникнення D-шару і дозволяючи хвилям відбиватися від верхньої (F-шару) частини іоносфери. Це є причиною того, що віддалені радіостанції можна почути тільки вночі.
