2.2: Енергія, тепло та температура
- Page ID
- 19224
- Поясніть різницю між кінетичною та потенційною енергією.
- Визначте хімічну енергію та теплову енергію.
- Визначте тепло і роботу, а також опишіть важливе обмеження в їх взаємоперетворенні.
- Опишіть фізичне значення температури.
- Поясніть значення температурної шкали і опишіть, як визначається та чи інша шкала.
- Перетворіть температуру, виражену за Фаренгейтом або Цельсієм, в іншу шкалу.
- Опишіть температурну шкалу Кельвіна і її особливе значення.
- Визначте теплоємність і питому теплоємність, і поясніть, як їх можна виміряти.
Всі хімічні зміни супроводжуються поглинанням або виділенням тепла. Інтимний зв'язок між матерією та енергією був джерелом дива та спекуляцій з найпримітивніших часів; невипадково вогонь вважався одним із чотирьох основних елементів (поряд із землею, повітрям та водою) ще в п'ятому столітті до н.е. Цей блок буде охоплювати тільки самі основні аспекти предмета, достатньо, щоб ви почали; є набагато більш повний набір уроків з хімічної енергетики в іншому місці.
Що таке енергія?
Енергія є одним з найбільш фундаментальних і універсальних концепцій фізичної науки, але той, який надзвичайно важко визначити таким чином, що є значущим для більшості людей. Це, мабуть, відображає той факт, що енергія - це не «річ», яка існує сама по собі, а скоріше є атрибутом матерії (а також електромагнітного випромінювання), яка може проявлятися різними способами. Його можна спостерігати і вимірювати лише побічно через його вплив на матерію, яка набуває, втрачає або володіє нею. Енергія може приймати різні форми: механічну, хімічну, електричну, радіаційну (світлову) і теплову. Ви також знаєте, що енергія зберігається; вона може передаватися від одного об'єкта або місця до іншого, але вона ніколи не може просто зникнути.
У 17 столітті великий математик Готфрід Лейбніц (1646-1716) запропонував розмежувати vis viva («жива енергія») і vis mortua («мертва енергія»), яка згодом стала називатися кінетичною енергією та потенційною енергією. За винятком променистої енергії, яка передається через електромагнітне поле, більшість практичних форм енергії, з якими ми стикаємося, бувають двох видів: кінетична та потенційна.
- Кінетична енергія пов'язана з рухом об'єкта; тіло з масою, м, і рухається зі швидкістю v, володіє кінетичною енергією\( \frac{1}{2} mv^2\). Ця «v-квадратна» частина важлива; якщо ви подвоїте швидкість, ви споживаєте в чотири рази більше палива (глюкоза для бігуна, бензин або електроенергія для вашого автомобіля.
- Потенційна енергія - це енергія, яку тіло має в силу свого розташування в силовому полі — гравітаційному, електричному або магнітному полі. Наприклад, якщо об'єкт масою m піднімається від підлоги на висоту h, його потенційна енергія збільшується на mgh, де g - константа пропорційності, відома як прискорення сили тяжіння. Аналогічно потенційна енергія частинки, що має електричний заряд q, залежить від її розташування в електростатичному полі.
Кінетична і потенційна енергія вільно взаємоконвертуються
Візьміть книгу і тримайте її над стільницею; ви тільки що збільшили її потенційну енергію в силовому полі земної гравітації. Тепер дайте йому опуститися. Його новопридбана потенційна енергія починає знову з'являтися як кінетична енергія, оскільки вона прискорюється вниз зі швидкістю, що збільшується на 9,8 м/сек щосекунди (9,8 м сек —2 або 32 футів сек —2). У той момент, коли він вражає поверхню, потенційна енергія, яку ви надали книзі, тепер повністю перетворена в кінетичну енергію.
А що відбувається з тією кінетичною енергією після того, як книга перестає рухатися? Він все ще існує, але ви більше не можете побачити його ефекту; тепер він розсіюється як теплова кінетична енергія («тепло») на молекули книги, стільницю, і, врешті-решт, в навколишнє середовище, включаючи повітря.
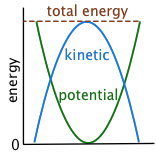
Чим більше ви думаєте про це, тим більше прикладів кінетико-потенційного перетворення ви знайдете в повсякденному житті. Однак у багатьох інших випадках енергія об'єкта неодноразово чергується між потенційними та кінетичними формами. Залишившись в спокої, процес триває нескінченно довго, поки тертя не розсіювало енергію в навколишнє середовище.
Кладовище енергії: Теплова енергія
Енергія зберігається: її не можна ні створити, ні зруйнувати. Але вона може і з часом завжди зникне з нашого погляду і в мікроскопічний світ окремих молекулярних частинок. Всі молекули знаходяться в безперервному стані руху, і тому вони володіють кінетичною енергією. Але на відміну від руху масивного тіла, такого як бейсбол або автомобіль, який рухається по певній траєкторії, рухи окремих атомів або молекул є випадковими і хаотичними, назавжди змінюються за величиною і напрямком, коли вони стикаються один з одним або (як у випадку з газом) зі стінками контейнер.
Сума всієї цієї рандомізованої кінетичної енергії мікроскопічного масштабу всередині тіла отримала особливу назву - теплова енергія. Хоча ми не можемо безпосередньо бачити теплову енергію в дії, ми, безумовно, можемо її відчути; як ми побачимо далі, вона безпосередньо корелює з температурою об'єкта.
Підключення хімії
Атоми та молекули є основними дійовими особами теплової енергії, але вони також мають інші види енергії, яка відіграє важливу роль у хімії.
Енергія облігацій
H 2 + є достатньо енергетично стабільним, щоб існувати як ідентифікована сутність, і, таким чином, відповідає визначенню молекули. Але він також надзвичайно реактивний, тому не сидить дуже довго. Це можна спостерігати лише тоді, коли високовольтний електричний розряд пропускається через газ водню; синє світіння, яке можна побачити, представляє його загибель, коли воно захоплює електрони і повертається до набагато більш стабільної молекули диводню H 2.
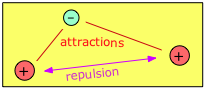
Розглянемо, наприклад, найпростішу можливу молекулу. Це молекула-іон водню, Н 2 +, в якій один електрон одночасно притягує два протони. Ці протони, маючи однакові заряди, відштовхують один одного, але це долається електронно-протонними атракціонами, що призводить до чистого зниження потенційної енергії при з'єднанні електрона з двома протонами. Це зниження потенційної енергії достатньо для того, щоб H 2 + існував як дискретна молекула, яку ми можемо представити як [H—H] +, щоб явно зобразити хімічний зв'язок, який з'єднує два атоми.
Міцність хімічного зв'язку збільшується в міру того, як потенційна енергія, пов'язана з її утворенням, стає більш негативною.
Хімічні зв'язки також мають деяку кінетичну енергію, яка пов'язана з «рухом» електрона, коли він поширюється в розширений простір, який він займає в тому, що ми називаємо «зв'язком». Це квантовий ефект, який не має класичного аналога. Кінетична енергія має лише половину величини потенційної енергії і працює проти неї; загальна енергія зв'язку - це сума двох енергій.
Хімічна енергія
Хімічні зв'язки в молекулах глюкози зберігають енергію, яка живить наш організм.
Молекули - це транспортні засоби як для зберігання, так і транспортування енергії, і засоби перетворення її з однієї форми в іншу, коли утворення, розрив або перестановка хімічних зв'язків всередині них супроводжується поглинанням або вивільненням енергії, найчастіше у вигляді тепло.
Хімічна енергія відноситься до потенційної та кінетичної енергії, пов'язаної з хімічними зв'язками в молекулі. Розглянемо, що відбувається, коли водень і кисень об'єднуються, утворюючи воду. Реагенти Н 2 і О 2 містять більше енергії зв'язку, ніж Н 2 О, тому при їх об'єднанні надлишок енергії звільняється у вигляді теплової енергії, або «тепла».
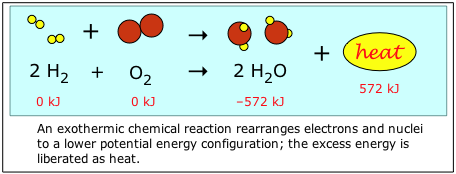
За умовністю енергетичний вміст хімічних елементів в їх природному стані (H 2 і O 2 в даному прикладі) визначають як «нуль». Це значно полегшує обчислення, і дає більшості сполук негативні «енергії освіти». (див. нижче)
Хімічна енергія проявляється різними способами:
- хімічна → термічна → кінетична хімічна → термічна → кінетична+про
- хімічна → електрична → кінетична (нервова функція, рух м'язів)
- хімічна → електрична
Енергетичні шкали завжди довільні
Спочатку ви можете подумати, що книга, що сидить на столі, має нульову кінетичну енергію, оскільки вона не рухається. Правда, правда, сама земля рухається; вона обертається на своїй осі, вона обертається навколо Сонця, а саме сонце віддаляється від інших зірок у загальному розширенні Всесвіту. Оскільки ці рухи, як правило, нас не цікавлять, ми вільні прийняти довільну шкалу, в якій швидкість книги вимірюється по відношенню до таблиці; на цій так званій лабораторній системі координат кінетичну енергію книги можна вважати нульовою.
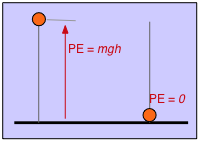
Те ж саме робимо з потенційною енергією. Якщо визначити висоту стільниці як нуль потенційної енергії, то об'єкт, що має масу,\(m\) підвішену на висоті h над стільницею, матиме потенційну енергію mgh. Тепер нехай об'єкт впаде; коли він прискорюється в гравітаційному полі землі, його потенційна енергія змінюється в кінетичну енергію. За мить до того, як він вдарить по стільниці, це перетворення завершено, а кінетична енергія\(\frac{1}{2}mv^2\) ідентична оригінальній mgh. Коли об'єкт приходить в спокій, його кінетична енергія з'являється у вигляді тепла (як у самому об'єкті, так і в стільниці), коли кінетична енергія стає рандомізованою як теплова енергія.
Енергетичні одиниці
Енергія вимірюється з точки зору її здатності виконувати роботу або передавати тепло. Механічна робота проводиться, коли сила f зміщує об'єкт на відстань d:
\[W = f\cdot d\]
Основною одиницею енергії є джоуль. Один джоуль - це обсяг виконаної роботи, коли сила 1 ньютон діє на відстані 1 м; таким чином 1 J = 1 N-м. Один ньютон - величина сили, необхідна для розгону 1 - кг маси на 1 метр в секунду за одну секунду - 1 м сек —2, тому основні розміри джоуля складають кг м 2 с —2. Інші дві одиниці енергії, які широко використовуються, - це калорія та BTU (британська теплова одиниця). Вони визначаються з точки зору нагрівального впливу на воду. На даний момент ми обмежимо свою увагу джоулем і калорійністю.
Тепло і робота вимірюються в одиницях енергії, але вони не є самою енергією. Як ми пояснимо нижче, вони стосуються процесів, за допомогою яких енергія передається або від чогось - блоку металу, двигуна або чашки води.
Тепло
Коли тепліше тіло контактує з більш холодним тілом, теплова енергія надходить від теплої до охолоджувача, поки їх дві температури не будуть однаковими. Більш тепле тіло втрачає кількість теплової енергії Δ E, а більш прохолодне тіло набуває таку ж кількість енергії. Ми описуємо цей процес, сказавши, що «Δ E джоулі тепла перейшли від більш теплого тіла до більш холодного». Важливо, однак, розуміти, що Тепло - це передача енергії за рахунок різниці температур.
Тепло НЕ тече
Ми часто посилаємося на «потік» тепла, нагадуючи уявлення 18 століття про те, що тепло - це фактична речовина під назвою «калорійність», яка могла текти, як рідина. Це неправильно; тепло - це процес і не те, що може міститися або зберігатися в організмі. Важливо, щоб ви це зрозуміли, тому що використання цього терміна в нашій звичайній розмові («спека страшна сьогодні»), як правило, змушує нас забути цю відмінність.
В основному існує три механізми, за допомогою яких може передаватися тепло: провідність, випромінювання та конвекція. Останній процес відбувається, коли дві різні температури призводять до того, що різні частини рідини мають різну щільність.

Робота
Робота - це передача енергії будь-яким іншим процесом, крім тепла.Робота, як і енергія, може приймати різні форми: механічну, електричну, гравітаційну тощо Всі мають спільне той факт, що вони є добутком двох факторів, терміна інтенсивності і терміну ємності. Наприклад, найпростіша форма механічної роботи виникає при переміщенні об'єкта на певну відстань проти протилежної сили. Електромонтажні роботи виконуються тоді, коли тіло, що має певний заряд, рухається через різницю потенціалів.
|
вид роботи
|
коефіцієнт інтенсивності
|
коефіцієнт ємності
|
формула
|
|---|---|---|---|
| механічні | сили | зміна відстані | \(f\Delta x\) |
| гравітаційний | гравітаційний потенціал (функція висоти) | маси | мгх |
| електричні | різниця потенціалів | кількість заряду | \(Q\Delta V\) |
Виконання роботи передбачає перетворення енергії; таким чином, коли книга опускається на підлогу, виконується гравітаційна робота (маса рухається через гравітаційну різницю потенціалів), а потенційна енергія, яку книга мала до того, як її скинути, перетворюється в кінетичну енергію, яка в кінцевому підсумку розсіюється як теплова енергія.
Механічна робота - це твір сили, що чиниться на тіло, і відстані, яку воно переміщається: 1 N-м = 1 Дж.
Тепло і роботу найкраще розглядати як процеси, за допомогою яких відбувається обмін енергією, а не як сама енергія. Тобто тепло «існує» тільки тоді, коли воно тече, робота «існує» тільки тоді, коли вона виконується.
Коли два тіла поміщаються в тепловий контакт і енергія надходить від більш теплого тіла до більш холодного, ми називаємо процес «теплом». Передача енергії в систему або від системи будь-яким іншим способом, крім тепла, називається «роботою».
Таким чином, ви можете думати про тепло і роботу як про різні способи виконання одного і того ж: передачі енергії з одного місця або об'єкта в інше.
Щоб переконатися, що ви розумієте це, припустимо, вам дають дві однакові ємності з водою при 25°C, в одну ємність ви поміщаєте електричний занурювальний нагрівач, поки вода не поглине 100 джоулів тепла. Другу ємність ви енергійно помішуєте, поки на ній не буде виконано 100 Дж роботи. Зрештою, обидві проби води будуть прогріті до однакової температури і міститимуть однакову збільшену кількість теплової енергії. Немає ніякого способу сказати, що містить «більше роботи» або «більше тепла».
Важливе обмеження на перетворення енергії
Газовий двигун перетворює хімічну енергію, наявну в його паливі, в теплову енергію. Тільки частина цього доступна для виконання робіт; решта розганяється в навколишнє середовище через вихлоп. Це обмеження є суттю Другого закону термодинаміки, до якого ми отримаємо набагато пізніше в цьому курсі.
Теплова енергія дуже особлива в одному вирішальному ключі. Всі інші форми енергії взаємоконвертовані: механічна енергія може бути повністю перетворена в електричну, а остання може бути повністю перетворена в теплову, як в описаному вище прикладі з підігрівом води. Але хоча робота може бути повністю перетворена в теплову енергію, повне перетворення теплової енергії в роботу неможливо. Пристрій, який частково виконує це перетворення, відомий як тепловий двигун; паровий двигун, реактивний двигун та двигун внутрішнього згоряння в автомобілі - відомі приклади.
Температура і її значення
Всі ми маємо загальне уявлення про те, що означає температура, і ми зазвичай пов'язуємо її з «теплом», яке, як ми зазначили вище, є широко незрозумілим словом. Обидва стосуються того, що ми описали вище як теплову енергію - рандомізовану кінетичну енергію, пов'язану з різними рухами речовини на атомному та молекулярному рівнях.
Тепло, ви згадаєте, - це не те, що «міститься всередині» тіла, а скоріше процес, при якому [теплова] енергія надходить або залишає тіло в результаті різниці температур.
Тож коли ви розігріваєте чашку чаю, дозволяючи їй поглинати 1000 Дж тепла від плити, можна сказати, що вода придбала 1000 Дж енергії, але не тепла. Якщо замість цього ви «нагріваєте» свій чай в мікрохвильовій печі, вода набуває свою додаткову енергію шляхом прямого поглинання електромагнітної енергії; оскільки цей процес не рухається різницею температур, тепло взагалі не задіяно!!
Термометрія
Зазвичай ми вимірюємо температуру за допомогою термометра - пристрою, який використовує якийсь матеріал, що володіє властивістю, яка змінюється прямо пропорційно температурі. Найпоширенішими з цих властивостей є щільність рідини, теплове розширення металу або електричний опір матеріалу.
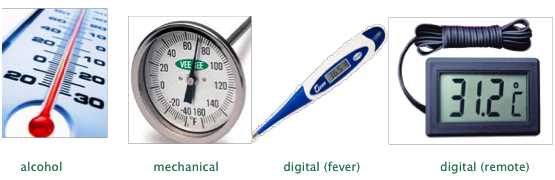
Звичайний термометр, про який ми зазвичай думаємо, використовує резервуар рідини, теплове розширення (зменшення щільності) викликає його підвищення в капілярній трубці. Для цієї мети традиційно використовується металева ртуть, так як має спирт (зазвичай ізопропіловий), що містить червоний барвник.
Ртуть була стандартною термометричною рідиною вибору більше 200 років, але її використання для цієї мети поступово припиняється через її нейротоксичність. Хоча спалювання вугілля, утилізація люмінесцентних ламп, спалювання та утилізація батарей є основними джерелами надходження ртуті в навколишнє середовище, зламані термометри давно відомо, що виділяють сотні тонн ртуті. Після розливу крихітні краплі рідкого металу, як правило, осідають у поглибленнях підлоги та тріщинами, де вони можуть виділяти пар роками.
Температура
Температура - це міра середньої кінетичної енергії молекул всередині води. Ви можете думати про температуру як вираз «інтенсивності», з якою теплова енергія в тілі проявляється з точки зору хаотичного, мікроскопічного молекулярного руху.
- Тепло - це кількість теплової енергії, яка надходить або залишає тіло.
- Температура вимірює середню поступальну кінетичну енергію молекул в тілі.
Ця анімація зображує теплові поступальні рухи молекул в газі. У рідинях і твердих тілах між молекулами є мало порожнього простору, і вони в основному просто натикаються і штовхають один одного.
Ви помітите, що ми проникли слово «поступальний» у це визначення температури. Під перекладом розуміється зміна місця розташування: в даному випадку молекули рухаються у випадкових напрямках. Це основна форма теплової енергії в звичайних умовах, але молекули можуть також піддаватися іншим видам руху, а саме обертанням і внутрішнім вібраціям. Ці останні дві форми теплової енергії насправді не є «хаотичними» і не сприяють підвищенню температури.
Енергія вимірюється в джоулі, а температура - в градусах. Ця різниця відображає важливу різницю між енергією і температурою:
- Можна сказати, що 100 г гарячої води містить більше енергії (не тепла!) більше 100 г холодної води. А оскільки енергія - це велика кількість, ми знаємо, що 10-г порція цієї гарячої води містить лише десять відсотків стільки енергії, скільки всього 100-г кількості.
- Температура, навпаки, не є мірою кількості; будучи інтенсивною властивістю, це скоріше «якість», яка описує «інтенсивність», з якою проявляється теплова енергія. Так що і 100-г, і 10-г порції гарячої води, описаної вище, мають однакову температуру.
Температурні шкали
Температура вимірюється шляхом спостереження за її впливом на деяку залежну від температури змінну, таку як об'єм рідини або електричний опір твердої речовини. Для того, щоб висловити температуру чисельно, нам потрібно визначити шкалу, яка відзначена рівномірними кроками, які ми називаємо градусами. Природа цієї шкали — її нульова точка і величина градуса, абсолютно умовні.
Хоча грубі засоби оцінки та порівняння температур були приблизно з 170 року нашої ери, перший ртутний термометр та температурна шкала були введені в Голландії в 1714 році Габріелем Даніелем Фаренгейтом.

Фаренгейт встановив три нерухомі точки на своєму термометрі. Нуль градусів - це температура суміші льоду, води та солі, яка була приблизно найхолоднішою температурою, яку можна було відтворити в лабораторії того часу. Коли він опустив сіль з суспензії, він досяг своєї другої фіксованої точки, коли комбінація вода-лід стабілізувалася на «тридцять другому ступені». Його третя фіксована точка була «знайдена як дев'яносто шоста ступінь, і дух розширюється до цього ступеня, коли термометр тримається в роті або під пахвою живої людини в доброму здоров'ї». Після того, як Фаренгейт помер в 1736 році, його термометр був перекалібрований, використовуючи 212 градусів, температуру, при якій вода закипає, як верхня фіксована точка. Нормальна температура тіла людини зареєстрована 98,6, а не 96.
Беліз і США - єдині країни, які все ще використовують шкалу Фаренгейта!
У 1743 році шведський астроном Андерс Цельсій розробив точно названу шкалу за Цельсієм, яка розміщує рівно 100 градусів між двома контрольними точками, визначеними температурами замерзання та кипіння води.
З причин, найбільш відомих за Цельсієм, він призначив 100 градусів точці замерзання води і 0 градусів до її температури кипіння, в результаті чого інвертована шкала, яка нікому не сподобалася. Після його смерті через рік шкалу поставили навпаки. Переглянута шкала за Цельсієм була швидко прийнята скрізь, крім англомовного світу, і стала метричною одиницею температури. У 1948 році вона була офіційно перейменована в шкалу Цельсія.
Порівняння температури та перетворення
Коли ми говоримо, що температура стільки градусів, ми повинні вказати конкретну шкалу, на якій ми виражаємо цю температуру. Температурна шкала має дві визначальні характеристики, обидві з яких можна вибрати довільно:
- Величина одиниці приросту температури— тобто розмір градуса.
Для того щоб висловити температуру, задану за однією шкалою в плані іншої, необхідно враховувати обидва ці фактори.
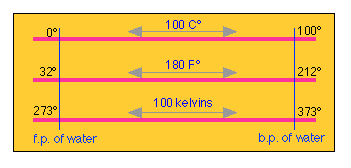
Перетворення між Цельсієм і Фаренгейтом легко, якщо ви маєте на увазі, що між так званими крижаними та паровими точками води є 180 градусів за Фаренгейтом, але лише 100 градусів Цельсія, що робить F° 100/180 = 5/9 величиною C°.
Оскільки точка льоду знаходиться на рівні 32° F, дві шкали компенсуються цією величиною. Якщо ви пам'ятаєте це, немає необхідності запам'ятовувати формулу перетворення; ви можете розробити її, коли вам це потрібно. Зверніть увагу на різницю між «°C» (температура) та «C°» (приріст температури).
Абсолютні температурні шкали
Близько кінця 19 століття, коли стало розуміти фізичне значення температури, відчувалася потреба в температурній шкалі, нуль якої дійсно означає нуль — тобто повна відсутність теплового руху. Це породило абсолютну шкалу температури, нульова точка якої становить -273,15° C, але яка зберігає ту саму величину градуса, що і шкала Цельсія. Зрештою, це було перейменовано на честь лорда Кельвіна (Вільям Томпсон), таким чином, градус Цельсія став Кельвіном. Зараз прийнято виражати приріст, такий як п'ять C°, як «п'ять кельвінів»
У 1859 році шотландський інженер і фізик Вільям Дж.М. Ренкін запропонував абсолютну температурну шкалу, засновану на градусі Фаренгейта. Абсолютний нуль (0° Ra) відповідає —459.67 °F Шкала Ренкіна широко використовувалася тими самими американськими та британськими інженерами, які із задоволенням висловлюють енергію в одиницях BTU і маси в фунтах.
Важливість абсолютних температурних шкал полягає в тому, що абсолютні температури можна вводити безпосередньо у всі фундаментальні формули фізики та хімії, в яких температура є змінною. Мабуть, найпоширенішим прикладом, відомим всім початківцям учням, є ідеальний стан рівняння газу.
\[PV = nRT\]
Теплоємність
Коли тіло втрачає або отримує тепло, його температура змінюється прямо пропорційно кількості теплової енергії q, що передається:
\[q= C\Delta T\]
Константа пропорційності C відома як теплоємність.
\[ C = \frac{q}{\Delta T} \]
Якщо Δ T виражається в кельвінів (градусах) і q в джоулі, одиницями C є J K —1. Іншими словами, теплоємність говорить нам, скільки джоулів енергії потрібно, щоб змінити температуру тіла на 1° С. Чим більше значення С, тим менше буде вплив заданого зміни енергії на температуру.
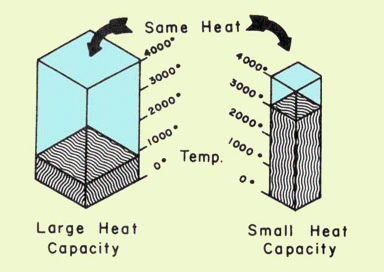
Повинно бути зрозуміло, що С - це велика властивість— тобто залежить від кількості речовини. Всім відомо, що для зміни температури 1 л води потрібно набагато більша кількість енергії в порівнянні з 10 мл води. З цієї причини прийнято виражати С в терміні одиниці кількості, наприклад на грам, і в цьому випадку він стає питомою теплоємністю, яку зазвичай називають «питомою теплотою» і має одиниці J K —1 g —1 g —1.
Таким чином, якщо однакові кількості тепла надходять на два тіла, що мають різну теплоємність, то той, що має меншу теплоємність, зазнає більшої зміни температури. (Можливо, вам буде корисно думати про теплоємність як про міру здатності організму протистояти зміні температури при поглинанні або втраті тепла.) Примітка: ви повинні знати одиниці питомої теплоти. Перевага цього полягає в тому, що вам не потрібно вивчати «формулу» для вирішення конкретних теплових задач.
Скільки джоулів тепла має надходити в 150 мл води при 0° C, щоб підняти її температуру до 25° C?
Рішення
Маса води становить (150 мл) × (1,00 г мл —1) = 150 м Питома теплоємність води 4,18 Дж К —1 г —1 г. З визначення питомої теплоти, кількості енергії
q = Δ Е є (150 г) (25,0 К) (4,18 Дж К —1 г —1) = 16700 Дж.
Як можна раціоналізувати цю процедуру? Повинно бути очевидно, що чим більше маса води і чим більше зміна температури, тим більше тепла буде потрібно, тому ці дві величини йдуть в чисельник. Аналогічно, необхідна енергія буде змінюватися обернено з питомою теплотою, яка, отже, йде в знаменник.
| Речовина |
С, Дж/г-К |
|---|---|
| Алюміній | 0.900 |
| Мідь | 0,386 |
| Свинець | 0.128 |
| Меркурій | 0.140 |
| Цинк | 0,387 |
| Спирт (етанол) | 2.4 |
| Вода | 4.18 |
| Лід (-10° C) | 2.05 |
| Бензин (н-октан) | 0,53 |
| Скло | 0,84 |
| Вуглець (графіт/алмаз) | 0,710/.509 |
| Хлорид натрію | 0,854 |
| Рок (граніт) | 0,790 |
| Повітря | 1.01 |
Особливо зверніть увагу на наступне:
- Молярні теплоємності металевих елементів практично ідентичні. Це основа Закону Дюлонга і Петі, який служив важливим інструментом оцінки атомних ваг деяких елементів.
- Міжмолекулярний водневий зв'язок у воді та спиртах призводить до аномально високих теплоємностей для цих рідин; те ж саме стосується льоду, порівняно з іншими твердими речовинами.
- Значення графіту та алмазу узгоджуються з принципом, що тверді речовини, які є більш «впорядкованими», як правило, мають більшу теплоємність.
Шматок нікелю вагою 2,40 г нагрівають до 200,0° C, а потім опускають у 10,0 мл води при 15,0° C Температура металу падає, а температура води підвищується до досягнення теплової рівноваги, і обидва вони знаходяться при 18,0° C. Яка питома теплота металу?
Рішення
Маса води становить (10 мл) × (1,00 г мл —1) = 10 г Питома теплоємність води становить 4,18 1 Дж К —1 г —1 г, а її температура збільшилася на 3,0 С°, що свідчить про те, що вона поглинає (10 г) (3 К) (4,18 Дж К —1 г —1) = 125 Дж енергії. Зразок металу втратив таку ж кількість енергії, в результаті чого падіння температури становило 182° С. Питома теплоємність металу становить:
(125 Дж)/(2,40 г) (182 К) = 0,287 Дж К —1 г —1.
Зверніть увагу, що ніякої «формули» тут не потрібно до тих пір, поки ви знаєте одиниці питомої теплоти; ви просто розміщуєте відповідні величини в чисельнику або знаменнику, щоб одиниці вийшли правильно.
