2.1: Класифікація та властивості речовини
- Page ID
- 19225
- Наведіть приклади великих і інтенсивних властивостей зразка речовини. Яке властивість корисніше для опису того чи іншого виду матерії?
- Поясніть, чим відрізняється гетерогенна речовина від однорідної речовини.
- Охарактеризуйте наступні процеси поділу: дистиляція, кристалізація, екстракція рідина-рідина, хроматографія.
- У дещо обмеженій мірі, в якій це має сенс, класифікують дане властивість як фізичне або хімічне властивість речовини.
Матерія - це «все, що має масу і займає простір», нас вчили в школі. Правда досить, але не дуже ситно. Дійсно повна відповідь, на жаль, виходить за рамки цього курсу, але ми запропонуємо натяк на це в наступному розділі про атомну структуру. На даний момент давайте відкладемо спробу визначити матерію і зосередимося на погляді хіміка: матерія - це те, з чого складаються хімічні речовини. Але що ми маємо на увазі під хімічними речовинами? Як ми організуємо наш погляд на матерію та її властивості? Саме ці практичні питання будуть предметами цього уроку.
властивості речовини
Наука про хімію розвивалася на основі спостережень, зроблених про природу і поведінку різних видів матерії, які ми називаємо в сукупності властивостями речовини. Властивості, на які ми посилаємося в цьому уроці, - це всі макроскопічні властивості: ті, які можна спостерігати в об'ємній речовині. На мікроскопічному рівні матерія, звичайно, характеризується своєю структурою: просторовим розташуванням окремих атомів у молекулярній одиниці або розширеному твердому тілі. Спостерігаючи за зразком речовини та вимірюючи її різні властивості, ми поступово отримуємо достатню кількість інформації, щоб охарактеризувати її; щоб відрізнити її від інших видів матерії. Це перший крок у розвитку хімічної науки, в якому інтерес зосереджений на конкретних видах матерії і перетвореннях між ними.
Якщо подумати про різні спостережувані властивості речовини, стане очевидним, що вони діляться на два класи. Деякі властивості, такі як маса і обсяг, залежать від кількості речовини в досліджуваному нами зразку. Зрозуміло, що ці властивості, якими б важливими вони не були, самі по собі не можуть бути використані для характеристики якоїсь матерії; сказати, що «вода має масу 2 кг» - це нісенітниця, хоча це може бути цілком вірно в конкретному випадку. Властивості такого роду називаються великими властивостями речовини.
Припустимо, ми знімемо подальші виміри, і виявимо, що така ж кількість води, маса якої становить 2,0 кг, також займає обсяг 2,0 літра. Ми виміряли дві великі властивості (масу і об'єм) одного і того ж зразка речовини. Це дозволяє нам визначити нову величину, частку м/v яка визначає іншу властивість води, яку ми називаємо щільністю. На відміну від маси і обсягу, які самі по собі відносяться тільки до окремих зразків води, щільність (маса на одиницю об'єму) є властивістю всіх зразків чистої води при однаковій температурі. Щільність - приклад інтенсивного властивості речовини.
Таке визначення щільності ілюструє важливе загальне правило: співвідношення двох екстенсивних властивостей завжди є інтенсивним властивістю.
Інтенсивні властивості надзвичайно важливі, адже кожен можливий вид матерії володіє унікальним набором інтенсивних властивостей, що відрізняє її від будь-якого іншого виду матерії. Деякі інтенсивні властивості можна визначити за допомогою простих спостережень: колір (спектр поглинання), температура плавлення, щільність, розчинність, кислотна або лужна природа і щільність - поширені приклади. Ще більш фундаментальним, але менш безпосередньо спостережуваним, є хімічний склад.
Чим інтенсивніше властивості ми знаємо, тим точніше ми можемо охарактеризувати зразок речовини.
Інтенсивні властивості надзвичайно важливі, адже кожен можливий вид матерії володіє унікальним набором інтенсивних властивостей, що відрізняє її від будь-якого іншого виду матерії. Іншими словами, інтенсивні властивості служать для характеристики речовини. Багато інтенсивні властивості залежать від таких змінних, як температура і тиск, але способи зміни цих властивостей з такими змінними самі по собі можна розцінювати як інтенсивні властивості.
Класифікуйте кожне з наступного як велике або інтенсивне властивість.
- Обсяг пива в гуртку
- Відсоток алкоголю в пиві
- Кількість калорій енергії, яку ви отримуєте від вживання банана
- Кількість калорій енергії, що надається вашому організму, коли ви споживаєте 10,0 г цукру
- Маса заліза, присутня у вашій крові
- Маса заліза присутня в 5 мл вашої крові
- Електричний опір відрізка мідного дроту 22 калібру.
- Електричний опір 1-кілометрової довжини мідного дроту 22 калібру
- Тиск повітря в велосипедній шині
- Відповідь на
-
екстенсивний; залежить від розміру кухля.
- Відповідь б
-
інтенсивний; однаковий для будь-якого зразка однакового розміру.
- Відповідь c
-
екстенсивний; залежить від розміру і вмісту цукру в банані.
- Відповідь d
-
інтенсивний; такий же для будь-якої 10 г порції цукру.
- Відповідь e
-
екстенсивний; залежить від обсягу крові в організмі.
- Відповідь f
-
інтенсивний; такий же для будь-якого зразка 5 мл.
- Відповідь g
-
екстенсивний; залежить від довжини проводу.
- Відповідь ч
-
інтенсивний; однаковий для будь-якої довжини 1 км одного і того ж проводу.
- Відповідь я
-
тиск сам по собі інтенсивний, але також залежить від кількості повітря в шині.
Останній приклад показує, що не все чорне або біле! Але ми часто стикаємося з матерією, яка не є однорідною у всьому, чиї різні частини проявляють різні набори інтенсивних властивостей. Це викликає ще одну відмінність, про яку ми звертаємось безпосередньо нижче.
Як класифікувати речовину?
Один корисний спосіб організації нашого розуміння матерії - думати про ієрархію, яка простягається від найзагальнішої та складної до найпростішої та найфундаментальнішої. Коробки оранжевого кольору представляють центральне царство хімії, яке в кінцевому підсумку займається конкретними хімічними речовинами, але як практична справа, хімічна наука поширюється як вище, так і нижче цього регіону.
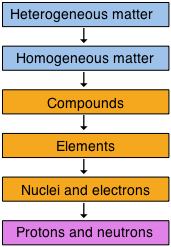
Крім того, коли ми думаємо про конкретні зразки матерії, може бути корисніше переробити нашу класифікацію у двох вимірах:
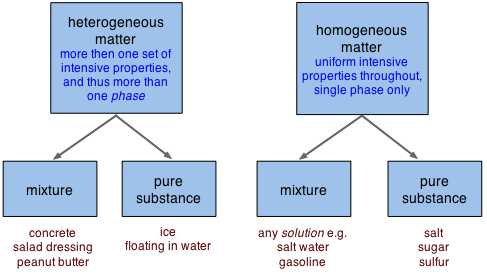
Зверніть увагу, в нижньому рядку ящиків вище, що «суміші» і «чисті речовини» можуть потрапляти як на однорідні, так і в неоднорідні категорії.
Однорідні і гетерогенні: справа фаз
Однорідну речовину (від грецького homo = те саме) можна розглядати як однорідну і безперервну, тоді як неоднорідна речовина (гетеро = різне) передбачає нерівномірність і розрив. Щоб взяти це далі, нам спочатку потрібно більш точно визначити «рівномірність», і це переводить нас до поняття фаз.
Фаза - це область речовини, яка володіє рівномірними інтенсивними властивостями по всьому своєму об'єму. Обсяг води, шматок льоду, піщинка, шматок міді - кожен з них становить одну фазу, і за вищевказаним визначенням, як кажуть, однорідний. Зразок речовини може містити більше однієї фази; прохолодний напій з плаваючим в ньому льодом складається щонайменше з двох фаз, рідини і льоду. Якщо це газований напій, ви, ймовірно, можете побачити в ньому бульбашки газу, які складають третю фазу.


Межі фаз
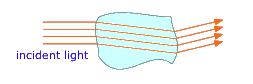
Кожна фаза в багатофазній системі відокремлена від своїх сусідів фазовою межею, тонкою областю, в якій інтенсивні властивості змінюються розривно. Ви коли-небудь замислювалися, чому ви можете легко побачити лід, що плаває в склянці води, хоча і вода, і лід прозорі? Відповідь полягає в тому, що коли світло перетинає фазову межу, його напрямок руху трохи викривляється, і частина світла відбивається назад; саме ці відбиті і спотворені світлові промені, що виходять з них, виявляють шматки льоду, що плавають в рідині.
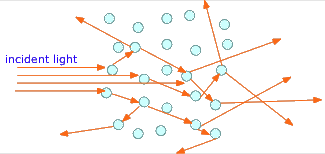
Якщо замість видимих шматків матеріалу друга фаза розбита на крихітні частинки, світлові промені зазвичай відскакують від поверхонь багатьох цих частинок у випадкових напрямках, перш ніж вони виходять із середовища і виявляються оком. Це явище, відоме як розсіювання, надає багатофазним системам такого роду похмурий вигляд, надаючи їх напівпрозорими замість прозорих. Два дуже поширених приклади - звичайний туман, при якому краплі води підвішені в повітрі, і молоко, яке складається з кульок молочного жиру, зважених у водному розчині.
Повертаючись до нашої класифікації, можна сказати, що однорідна речовина складається з однієї фази по всьому своєму об'єму; неоднорідна речовина містить дві і більше фаз.
Дихотомії (класифікації «або-або») часто мають тенденцію руйнуватися при уважному дослідженні, і відмінність між однорідною та гетерогенною речовиною є хорошим прикладом; це дійсно питання ступеня, оскільки на мікроскопічному рівні вся матерія складається з атомів або молекул, розділених порожнім простором! Для більшості практичних цілей ми вважаємо матерію однорідною, коли будь-які розриви, які вона містить, занадто малі, щоб вплинути на її зовнішній вигляд.
Наскільки великою повинна бути молекула або агломерація молекул, перш ніж вона почне проявляти властивості істоти окремої фази? Такі частинки охоплюють розрив між мікро- та макросвітами і були відомі як колоїди з тих пір, як вони почали вивчатися близько 1900 року. Але з розвитком нанотехнологій в 1990-х роках це розмежування стало ще більш нечітким.
Чисті речовини і суміші
Повітря навколо нас, більшість рідин і твердих речовин, з якими ми стикаємося, і вся занадто велика частина води, яку ми п'ємо, складається не з чистих речовин, а з сумішей. Ви, напевно, маєте загальне уявлення про те, що таке суміш, і чим вона відрізняється від чистої речовини; який науковий критерій для цього розмежування?
До хіміка, чиста речовина зазвичай відноситься до зразка речовини, який має чіткий набір властивостей, які є загальними для всіх інших зразків цієї речовини. Хорошим прикладом буде звичайна сіль, хлорид натрію. Незалежно від того, яке його джерело (з шахти, випаровується з морської води, або виготовлені в лабораторії), всі зразки цієї речовини, як тільки вони були очищені, володіють таким же унікальним набором властивостей.
Чиста речовина - це та, інтенсивні властивості якого однакові в будь-якому очищеному зразку того ж речовини.Суміш, навпаки, складається з двох або більше речовин, і вона може проявляти широкий спектр властивостей в залежності від відносної кількості компонентів, присутніх в суміші. Наприклад, можна розчинити до 357 г солі в одному літрі води кімнатної температури, роблячи можливим нескінченну різноманітність розчинів «солоної води». Для кожної з цих концентрацій такі властивості, як щільність, точки кипіння і замерзання, а також тиск пари отриманого розчину будуть різними.
Хіба щось дійсно чисте?
Ті з нас, хто любить арахісове масло, ніколи не охоче купують бренд, рекламований як «нечистий». Але стаття Consumer Reports, опублікована кілька років тому, показала таблицю з переліком кількості «мишачого посліду» та «частин комах» (імовірно, з силосів для зберігання арахісу), які вони знайшли у зразках усіх основних брендів. Приємного апетиту!
Нарешті, всі ми вважаємо за краще пити «чисту» воду, але ми зазвичай не турбуємося про розчинені атмосферні гази та іони, такі як Ca 2+ та HCO 3 - які присутні в більшості питних вод. Але ці нешкідливі «домішки» завжди присутні в тих «чистих» джерельних водах.
і пара-вода відповідно.Підсумок: Для хіміка термін «чистий» має значення лише в контексті конкретного застосування або процесу.
Операційні та концептуальні класифікації
Оскільки хімія є експериментальною наукою, нам потрібен набір експериментальних критеріїв для розміщення даного зразка речовини в одну з цих категорій. Не існує жодного експерименту, який завжди вдасться однозначно вирішити подібного роду питання. Однак є один принцип, який завжди буде працювати в теорії, якщо не на практиці. Це засновано на тому, що різні компоненти суміші можуть, в принципі, завжди розділятися на чисті речовини.
Розглянемо неоднорідну суміш солоної води і піску. Пісок можна відокремити від солоної води механічним процесом фільтрації. Аналогічно, молочний жир, що міститься в молоці, може бути відокремлений від води за допомогою процесу, відомого як збивання, в якому механічне перемішування змушує краплі молочного жиру зливатися в тверду масу, яку ми знаємо як масло. Ці приклади ілюструють загальний принцип, згідно з яким неоднорідну речовину можна розділити на однорідну речовину механічним способом.
Повертаючи це, ми маємо оперативне визначення неоднорідної речовини: Якщо за допомогою якоїсь механічної операції ми можемо розділити зразок речовини на два або більше інших видів матерії, то наш вихідний зразок був неоднорідним. Щоб знайти подібне оперативне визначення для однорідних сумішей, розглянемо, як ми можемо розділити два компоненти розчину солоної води. Найбільш очевидним способом було б випаруватися з води, залишивши сіль як твердий залишок. Таким чином, однорідну суміш можна розділити на чисті речовини, зазнаючи відповідні часткові зміни стану — тобто шляхом випаровування, заморожування тощо.
Зверніть увагу на термін частковий у наведеному вище реченні; в останньому прикладі ми випаровуємо тільки воду, а не сіль (що було б дуже важко зробити в будь-якому випадку!) Ідея полягає в тому, що на один компонент суміші переважно впливає процес, який ми проводимо. Цей принцип буде підкреслено на наступних прикладах.
Поділ однорідних сумішей
Деякі поширені способи поділу однорідних сумішей на їх складові викладені нижче.
Дистиляція
Суміш двох летких рідин частково уварюється; перші порції конденсованого пара будуть збагачені компонентом, що має нижчу температуру кипіння. Врахуйте, що якби вся рідина википіла, дистилят був би ідентичний вихідній рідині. Але якщо, скажімо, половина рідини переганяється, дистилят містив би більшу частку більш летючого компонента. Якщо дистилят потім повторно переганяти, його можна додатково збагатити в низькокиплячій рідині. Повторюючи цей процес багато разів (за сприяння фракціонуючої колони над киплячою посудиною), можна досягти високого ступеня поділу.
фракційна кристалізація
Гарячий насичений розчин, що містить два або більше розчинених твердих речовин, дають повільно охолоджуватися; найменш розчинний матеріал кристалізується першим і може бути відокремлений фільтрацією. Цей процес широко застосовується як в лабораторії, так і в значно більших масштабах в промисловості.

Аналогічно розплавлена суміш з декількох компонентів при повільному охолодженні спочатку дасть кристали матеріалу, що мають найвищу температуру плавлення. Цей процес відбувається у величезних масштабах в природі, коли розплавлена магма з земної мантії піднімається в літосферу і охолоджується під землею - процес, який може тривати до мільйона років. Так утворюється звичайна порода, відома як граніт. Зрештою ці породи піднімаються і стають оголеними на земній поверхні.


Рідина-рідка екстракція
Дві взаємно нерозчинні рідини, одна з яких містить два або більше розчинених речовин (розчинених речовин), струшують разом в сепараторній воронці. Кожен розчинений розчин буде концентруватися в рідині, в якій він більш розчинний. Потім два розчини відокремлюються, відкриваючи запірний кран внизу, дозволяючи більш щільному розчину стікати назовні.

Видобуток твердої рідини
При роботі з натуральними продуктами, такими як рослинні матеріали, першим кроком часто є витяг розчинних речовин з частин рослин. Це, і аналогічні екстракції розчинних компонентів складних твердих речовин, здійснюється в апараті, відомому як екстрактор Сокслета.

Ідея полягає в тому, щоб безперервно просочувати відповідний гарячий розчинник через матеріал, який міститься в пористому паперовому «наперстку». Гаряча пара з киплячої колби обходить екстракційну камеру через плече зліва (позначений «пар» на ілюстрації →) і в конденсатор, з якого він стікає вниз в екстракційну камеру, де частина розчинного матеріалу змішується з розчинником. Коли конденсат досягає верхньої частини камери, він витікає через плече сифона, спорожняючи його вміст в колбу для кипіння, яка стає все більш концентрованою в витягнутому матеріалі.
Перевага такої домовленості полягає в тому, що процес просочування та екстракції можна повторювати нескінченно довго (зазвичай години до днів) без особливої уваги.
Хроматографія
Оскільки рідка або газоподібна суміш тече уздовж колони, що містить адсорбентний матеріал, більш сильно адсорбовані компоненти мають тенденцію рухатися повільніше і з'являються пізніше, ніж менш сильно адсорбовані компоненти. У цьому прикладі екстракт, виготовлений з листя рослини, розділений на його основні компоненти: каротин, ксантофіл, хлорофіли А і В.

Хоча хроматографія виникла в середині 19 століття, вона не була широко використана до 1950-х років.З того часу вона охоплювала величезну різноманітність методик і більше не обмежується кольоровими речовинами. Хроматографія в даний час є одним з найбільш широко використовуваних методів аналізу і поділу складних сумішей рідин і газів.
Фізико-хімічні властивості
Оскільки хімія частково є вивченням перетворень, які може зазнати матерія, ми також можемо призначити будь-якій речовині набір хімічних властивостей, які виражають різні зміни складу, які, як відомо, зазнає речовина. Хімічні властивості також включають умови температури тощо, необхідні для зміни, та кількість енергії, що виділяється або поглинається у міру зміни.
Властивості, які ми описали вище, традиційно відомі як фізичні властивості, і їх слід відрізняти від хімічних властивостей, які зазвичай стосуються змін у складі, які може зазнати речовина. Наприклад, можна констатувати деякі більш характерні фізико-хімічні властивості елемента натрію:
|
Фізичні властивості (25° C)
|
Хімічні властивості
|
|---|---|
|
|
Чим уважніше розглядається відмінність між фізичними та хімічними властивостями, тим більш розмитим стає ця відмінність. Наприклад, висока температура кипіння води порівняно з температурою метану, CH 4, є наслідком електростатичних атракціонів між O-H зв'язками в сусідніх молекулах, на відміну від тих, що між C-H зв'язками; на цьому рівні ми дійсно потрапляємо в хімію! Тож хоча ви, швидше за все, очікуєте «розрізняти» фізичні та хімічні властивості на іспиті, не сприймайте це занадто серйозно - це виявляється досить сумнівна дихотомія, улюблена вчителями, але обмежена корисність!
