стехіометрія
- Page ID
- 24747
Навички для розвитку
- Виконуємо стехіометріческіе розрахунки
- Відрізнити динамічну рівновагу від рівнова
- Опишіть, чому фактична прибутковість може бути меншою за теоретичну
Стехіометрія є загальним терміном для взаємозв'язку між кількістю речовин в хімічних реакціях. Він також описує розрахунки, зроблені для визначення того, скільки речовини буде використано в реакції, що залишилася після реакції, виробленої реакцією тощо.
Як ви ним користуєтеся?
Розрахунки теоретичної прибутковості в попередньому розділі є простими стехіометріческімі розрахунками. Щоб зробити стехіометріческіе розрахунки, вам знадобляться:
- Збалансоване хімічне рівняння: можливо, вам доведеться написати рівняння і збалансувати його самостійно, виходячи з того, що ви знаєте
- Ваги формули або молекулярні ваги (скорочено FW або MW) для відповідних сполук: вам часто потрібно буде обчислити їх для себе, використовуючи періодичну таблицю і формули; просто складіть атомні ваги відповідно до формули
- Зазвичай вам потрібно з'ясувати, скільки родимок реагують; щоб зробити це, вам потрібно буде вирішити, що є обмежуючим реагентом, порівнявши кількість молів кожної сполуки, які присутні, та коефіцієнти в рівнянні
- Нарешті, коли у вас є всі частини, ви можете зробити перетворення одиниць вимірювання в стилі аналізу, щоб знайти відповідь. Переконайтеся, що ви розумієте, що робить кожен крок і що кожен крок множиться на 1. Можливо, вам також доведеться зробити деяке інше додавання або віднімання, залежно від того, що запитує питання, наприклад, віднімання кількості сполуки, яка реагує від початкової суми, щоб знайти частину, що залишилася
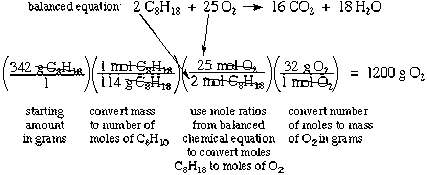
Стехіометрія та концепції реакції
Розрахунки стехіометрії - це не просто процедура для вирішення проблеми в книзі. Це спосіб описати речі, які насправді відбуваються, і це пов'язано з поняттями та розумінням хімії.
Розрахунки стехіометрії засновані на збереженні маси (див. сторінку Лавуазьє) та ідеї про те, що частинки, такі як ядра та електрони, не створюються або руйнуються під час реакцій, просто переставляються. Ці розуміння дозволяють зробити ці розрахунки.
Розрахунки стехіометрії також пов'язані з поняттям хімічної рівноваги. Рівновага означає стабільний стан, при якому протиборчі сили врівноважуються. Наприклад, коли ви стоїте на одній нозі, щоб зберегти рівновагу і не впасти, якщо ви трохи рухаєтеся в одну сторону, вам потрібно буде виправити це і трохи повернутися назад в іншому напрямку, щоб не втратити рівновагу. У хімії рівновага означає стан, при якому відбуваються 2 протилежних процесу, але з однаковою швидкістю. Наприклад, реакція може йти в прямому напрямку (праворуч), і в той же час деякі молекули продукту перетворюються на реагенти, рухаючись у зворотному напрямку (ліворуч). У багатьох хімічних реакціях можливі обидва напрямки; коли вони відбуваються з однаковою швидкістю, це називається динамічною рівновагою, що означає «рухома рівновага», оскільки окремі молекули рухаються вперед і назад між «реагентом» та «продуктом» (які насправді просто визначаються тим, як ви пишете рівняння), але загальна кількість реагенту та продукту не змінюється.

Коли ми робимо розрахунки стехіометрії, ми припускаємо, що реакція буде повною, а це означає, що граничний реагент буде реагувати повністю, тому жоден не залишається, утворюючи якомога більше продукту. Однак це лише іноді трапляється. Є кілька причин, чому цього може не статися.
Можливі причини, чому фактична врожайність менша за теоретичну
- Rate описує, наскільки швидко відбувається хімічна реакція. Деякі хімічні реакції дуже повільні, як ті, що розчиняють породу і змінюють форму гір; інші дуже швидкі, або між ними. Загалом, швидкість реакції буде залежати від умов, таких як температура. Зараз ми в основному поговоримо про реакції, які відбуваються досить швидко, але якщо реакція не закінчиться, перш ніж ви її виміряєте, це може бути тому, що вона занадто повільна. Про це обговорюється докладніше при вивченні хімічної кінетики.

- Положення рівноваги є ще однією можливою причиною реакції може не виробляти стільки продукту, скільки ви розраховуєте. Для всіх реакцій рівновага досягається до того, як буде використаний весь реагент; він може використовувати майже весь реагент, так що ви не помітите крихітного шматочка, що залишився, або він може досягти рівноваги з більш ніж половиною реагенту залишилося. Якщо рівновага досягнута (якщо реакція досить швидка), прогнозований теоретичний вихід буде досягнутий лише в тому випадку, якщо рівновага майже весь продукт. Пізніше ви дізнаєтеся способи передбачити, де рівновага. Наразі просто знайте, що реакції можуть йти в обох напрямках, і що рівновага не завжди є продуктом.

Останнє можливе ускладнення - побічні або конкуруючі реакції. Це означає, що деякі інші реакції, про які ви не думали або дізналися про можуть відбуватися, які використовують деякі з реагентів або продукту. Оскільки хімія дійсно складна, і дуже мало матеріалів насправді дійсно чисті, майже кожна реальна система або реакція матимуть деякі побічні реакції. Іноді вони дуже важливі і запобігають тому, що ви хочете статися; в інших випадках вони зовсім не мають значення.

Для ваших розрахунків вам зазвичай не потрібно дійсно турбуватися про швидкість, рівновагу або побічні реакції, тому що ми ще не вивчили стратегії боротьби з ними. Однак, щоб ваші психічні моделі хімічних реакцій відповідали реальним хімічним системам, важливо знати, що реальні реакції є більш складними, ніж ми змушуємо їх здаватися в перші кілька тижнів хімічного класу.