Конфігурації електронів
- Page ID
- 24727
Навички для розвитку
- Прогнозувати та проілюструвати конфігурації електронів
Хвильові функції в попередньому розділі були отримані лише для одноелектронних атомів. Дуже важко, якщо не зовсім неможливо ідеально вирішити рівняння Шредінгера, коли є 2 або більше електронів, через електронно-електронні відбиття, які роблять гамільтоніан неймовірно складним. Однак виявляється, що ми можемо наблизити орбіталі в інших атомах з невеликими модифікаціями хвильових функцій водню, як зменшення ядерного заряду для обліку відштовхування електронів.
Конфігурації електронів
Бор з'ясував кількість електронів в кожній оболонці, де оболонкою є всі електрони з однаковим головним квантовим числом. Візерунок, який він використовував, який можна перевірити за допомогою таблиці Менделєєва, був 2, 8, 8, 18, 18, 32, 32. Однак йому було не так зрозуміло розташування в підоболонках, які представляють собою групи електронів з однаковим принципом і квантовими числами моменту моменту моменту, наприклад 1s або 2p. Це стало набагато зрозумілішим після того, як були введені хвильові функції Шредінгера для атома водню, оскільки хвильові функції розв'язку явно мали лише певні допустимі величини, а також m α значень. Хоча всі орбіталі в оболонці мають однакову енергію в одному атомі електронів, коли електронів більше, підоболонки мають різну енергію. Це пояснюється тим, що чим більше знаходиться в оболонці, тим далі електрон зазвичай знаходиться від ядра. На орбіталах s електрони часто знаходяться близько до ядра, тому інші електрони не сильно блокують ядерний заряд. На орбіталах d і f електрони знаходяться далеко від ядра і заблоковані. Таким чином, орбіталі, як правило, заповнюються в порядку найнижчого n і найнижчого.
Орбіталі з однаковою енергією називаються виродженими. (В інших контекстах вироджений означає аморальні або інші погані речі.) Загалом, чим більше ускладнень ви додасте, як більше електронів, сусідніх атомів, магнітних полів тощо, тим менше орбіталів вироджується. Отже, для атома водню сам по собі всі орбіталі в кожній оболонці вироджені. Коли ви переходите до самотнього атома гелію, орбіталі в підоболонках вироджуються. Коли ви робите хімічні зв'язки, орбіталі в підоболонках більше не вироджуються. При застосуванні магнітного поля електрони в одній орбіталі не вироджуються.
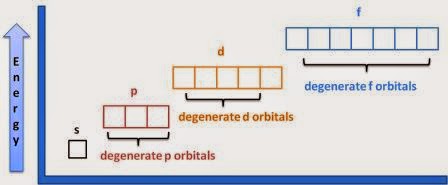
Прості правила прогнозування електронних конфігурацій атомів
Як передбачити конфігурації електронів для елементів? Електронна конфігурація якраз означає, скільки електронів в кожній орбіталі. Вам потрібно буде знати кількість електронів, які ви використовуєте. Ви можете отримати це з таблиці Менделєєва (атомний номер − заряд, якщо це іон). Або вам можуть просто дати атомний номер. Якщо у вас є таблиця Менделєєва, це легко, через форми таблиці. Якщо ви зайдете в таблицю Менделєєва на цьому сайті, то побачите, що вона має синій блок, червоний блок, жовтий блок і зелений блок. Код синій = s; жовтий = p; червоний = d; і зелений = f Лужні метали та лужноземельні метали мають найвищі енергетичні електрони в орбіталі s. Електрони найвищої енергії, ті, що знаходяться у вищій оболонці, називаються валентними електронами. Основна група (жовта), що включає галогени і благородні гази, мають свої найвищі електрони на p орбіталів. Перехідні метали мають свої орбіталі d, а лантаноїди та актиноїди - на орбіталі f. Зверніть увагу, що кожна секція має 2, 6, 10 або 14 елементів поперек, оскільки в підоболонках s, p, d і f є 1,3,5,7 орбіталі, і кожна орбіталь містить 2 електрони. Таким чином, ви можете записати електронну конфігурацію, просто подивившись на періодичну таблицю. Слідкуйте за своїм шляхом, записуючи, скільки електронів знаходиться в кожній підоболонці, поки у вас не буде потрібної кількості електронів загалом. Наприклад, для Al, ви б 1s 2 2s 2 2p 6 3s 2 3s 2 3p 1. Зверніть увагу, що ми вказуємо кількість електронів у кожній підоболонці, використовуючи надскрипти, ми пишемо електронні конфігурації.
Ще одна хитрість, яку ви можете використовувати для написання електронних конфігурацій, - це слідувати стрілкам на цій схемі. Шаблон заповнення називається «aufbau», що означає «нарощування» німецькою мовою, або так я чув. Зверніть увагу, що ви насправді не заповнюєте всі підоболонки в одній оболонці, перш ніж перейти до наступної. Це може бути трохи заплутаним (особливо тому, що s орбіталі лише трохи нижче попередніх d орбіталів, а у іонів енергетичний порядок перемикається назад!). Або використовуйте цю діаграму або періодичну таблицю, і ви отримаєте правильні відповіді до тих пір, поки ви будете обережні, щоб рахувати з верхньої частини періодичної таблиці. Зверніть увагу, як перший ряд d приходить після 4-го ряду з? Але ми можемо мати 3d орбіталі, так що перший ряд d 3d, а не 4d.
Часто ми не хочемо виписувати всі електрони на важкі атоми, тому що внутрішні такі ж, як і всі інші елементи. Таким чином, ми могли б показати тільки валентні електрони, що означає в даному випадку ті, що додаються в цьому рядку таблиці Менделєєва, або після останнього благородного газу. Таким чином, ми могли б написати Ti як [Ar] 4s 2 3d 2, що просто означає, що він має ту ж конфігурацію, як аргон, + 4s 2 3d 2.
Наступне питання виникає, коли не всі орбіталі в підоболонці заповнені. Ви парюєте електрони або поміщаєте їх на окремі орбіталі? Наприклад, розглянемо вуглець. Ви можете представити його електронну конфігурацію так, зі стрілками вгору і вниз, що представляють спін електронів.
Але яка з 3 можливостей це? Пам'ятайте, що електронний спін з'явився в спектроскопії з магнітними полями. Електрони схожі на крихітні магніти, і коли вони парні (один вгору, один вниз), вони скасовують один одного і не здаються магнітними, якщо ви не виглядаєте дуже важко. Але ви знаєте, що там багато дуже магнітних матеріалів (можливо, ви використовуєте їх на своєму холодильнику; ви також використовуєте їх у навушниках та інших пристроях). Причина, по якій вони магнітні, полягає в тому, що нижнє розташування - це найнижча енергія. Електрони воліють мати однаковий спін на різних орбіталах, де вони менше відштовхуються один від одного (серед інших більш складних причин). Це називається Правило Гунда. Причиною кращих магнітів є перехідні метали або лантаноїди є те, що d і f орбіталі мають простір для поширення 5 або 7 електронів з однаковим спіном.
Єдине, що вам потрібно знати про конфігурації електронів прямо зараз, це те, що є деякі винятки з правил про те, в якому порядку вони заповнюють (в основному в блоках d і f). Це не дуже важливо. Інша річ, яку ви, можливо, захочете знати, чи важлива електронна конфігурація в ізольованих атомах для хіміків. В основному лише валентні електрони впливають на зв'язок, тому елементна конфігурація, ймовірно, все ще застосовуватиметься до електронів ядра. І конфігурації атомних електронів відповідають зразкам реактивності, на яких спочатку була заснована періодична таблиця, так що це корисно. Інша причина полягає в тому, що ці правила застосовуються майже однаково до реальних хімічних ситуацій. Навіть якщо орбіталі є більш складними молекулярними орбіталями (ми вивчимо їх пізніше) замість атомних орбіталів, ви все одно заповнюєте їх від найнижчого до найвищого і використовуєте правило Гунда.