2.3: Джон Дальтон і атомна теорія матерії
- Узагальнити атомну теорію Дальтона.
- Поясніть Закон множинних пропорцій.
Хоча слід припустити, що ще багато вчених, філософів та інших вивчали склад речовини після Демокріта, великий стрибок вперед у нашому розумінні складу речовини відбувся в 1800-х роках з роботою британського вченого Джона Далтона. Він почав викладати школу у віці дванадцяти років, і в першу чергу був відомий як вчитель. У двадцяті роки він переїхав до зростаючого міста Манчестер, де зміг продовжити деякі наукові дослідження. Його робота в декількох областях науки принесла йому ряд почестей. Коли він помер, понад 40 000 людей у Манчестері пройшли маршем на його похороні.
Сучасна атомна теорія Далтона, запропонована приблизно в 1803 році, є фундаментальною концепцією, яка стверджує, що всі елементи складаються з атомів. Раніше ми визначали атом як найменшу частину елемента, який підтримує ідентичність цього елемента. Окремі атоми надзвичайно малі; навіть найбільший атом має приблизний діаметр всього 5,4 × 10 −10 м При такому розмірі він займає понад 18 мільйонів цих атомів, вишикувалися поруч, щоб дорівнювати ширині людського мізинечого пальця (близько 1 см).

Дальтон вивчав ваги різних елементів і з'єднань. Він помітив, що матерія завжди поєднується у фіксованих співвідношеннях на основі ваги або обсягу у випадку газів. Хімічні сполуки завжди містять однакову частку елементів по масі, незалежно від кількості, що забезпечило подальшу підтримку закону Пруста певних пропорцій. Дальтон також зауважив, що може бути більше однієї комбінації двох елементів.
Зі своїх експериментів і спостережень, а також роботи однолітків свого часу Далтон запропонував свою нову теорію атома. Пізніше це стало відомо як атомна теорія Дальтона. Загальні принципи цієї теорії полягали в наступному:
- Вся матерія складається з надзвичайно дрібних частинок, званих атомами.
- Атоми даного елемента ідентичні за розміром, масі і іншим властивостям (рис.2.3.2). Атоми різних елементів відрізняються розмірами, масою, іншими властивостями.

- Атоми не можуть бути поділені, створені або знищені.
- Атоми різних елементів можуть об'єднуватися в простих цілих числових співвідношеннях з утворенням хімічних сполук (рис2.3.3).
- У хімічних реакціях атоми об'єднуються, відокремлюються або переставляються.

Атомна теорія Далтона була значною мірою прийнята науковим співтовариством, за винятком трьох змін. Сучасна наука визнає, що:
(1) Атом можна додатково поділити.
(2) Всі атоми елемента не однакові за масою.
(3) Використовуючи методи ядерного поділу та синтезу, ми можемо створювати або руйнувати атоми, змінюючи їх на інші атоми.

На наступному кресленні зелені сфери представляють атоми певного елемента. Фіолетові сфери представляють атоми іншого елемента. Якщо сфери торкаються, вони є частиною єдиної одиниці з'єднання. Чи є наступні хімічні зміни, представлені цими символами, порушують будь-яку з ідей атомної теорії Дальтона? Якщо так, то який з них?
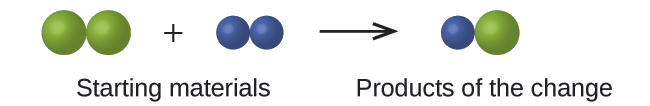
Рішення
Вихідні матеріали складаються з двох зелених сфер і двох фіолетових сфер. Вироби складаються тільки з однієї зеленої сфери і однієї фіолетової сфери. Це порушує постулат Дальтона про те, що атоми не створюються і не руйнуються під час хімічної зміни, а просто перерозподіляються. (У цьому випадку атоми, здається, були знищені.)
На наступному кресленні зелені сфери представляють атоми певного елемента. Фіолетові сфери представляють атоми іншого елемента. Якщо сфери торкаються, вони є частиною єдиної одиниці з'єднання. Чи є наступні хімічні зміни, представлені цими символами, порушують будь-яку з ідей атомної теорії Дальтона? Якщо так, то який з них?

- Відповідь
-
Вихідні матеріали складаються з чотирьох зелених сфер і двох фіолетових сфер. Вироби складаються з чотирьох зелених сфер і двох фіолетових сфер. Це не порушує жодного з постулатів Дальтона - атоми не створюються і не руйнуються, але перерозподіляються в малих співвідношеннях цілих чисел.
Закон множинних пропорцій
Багато комбінації елементів можуть реагувати, утворюючи більше одного з'єднання. У таких випадках маси конкретного елемента, які з'єднуються з фіксованою масою другого елемента, продемонстровані в співвідношеннях малих цілих чисел. Це легко сказати, але, будь ласка, переконайтеся, що ви розумієте, як це працює. Азот утворює дуже велику кількість оксидів, п'ять з яких показані тут.
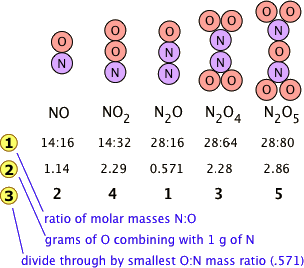
- У рядку 1 показано співвідношення відносних ваг двох елементів у кожному з'єднанні. Ці співвідношення були розраховані шляхом простого взяття молярної маси кожного елемента і множення на кількість атомів цього елемента на моль сполуки. Таким чином, для NO 2 ми маємо (1 × 14): (2 × 16) = 14:32. (Ці числа не були відомі в перші дні хімії, оскільки атомні ваги [тобто молярні маси] більшості елементів не були достовірно відомі.)
- Числа в рядку 2 - це лише масові співвідношення O: N, знайдені шляхом ділення відповідних співвідношень у рядку 1. Але хтось, хто залежить виключно від експерименту, буде працювати їх, знайшовши масу O, яка поєднується з одиницею маси (1 г) азоту.
- Рядок 3 виходить діленням фігур Лінії 2 на найменше співвідношення O:N в рядку 2 (яке є співвідношенням для N 2 O). Зверніть увагу, що так само, як говорить закон множинних пропорцій, вага кисню, який поєднується з одиницею ваги азоту, працює до малих цілих чисел; є помилка в рядку 3 - де є 3, має бути 4.
- Звичайно, ми так само легко могли б проілюструвати закон, розглядаючи масу азоту, який поєднується з одним грамом кисню; це працює в обох напрямках!
Закон кратних пропорцій говорить, що якщо два елементи утворюють між ними більше однієї сполуки, то маси одного елемента в поєднанні з фіксованою масою другого елемента утворюються в співвідношеннях малих цілих чисел.
Відео 2.3.1Закон множинних пропорцій
Проаналізовано зразок сполуки А (прозорий безбарвний газ) і встановлено, що він містить 4,27 г вуглецю та 5,69 г кисню. Проаналізовано зразок сполуки В (також прозорий безбарвний газ) і встановлено, що він містить 5,19 г вуглецю та 13,84 г кисню. Чи є ці дані прикладом закону певних пропорцій, закону кратних пропорцій чи ні ні? Що ж говорять ці дані про речовини А і В?
Рішення
У з'єднанні А масове відношення вуглецю до кисню становить:
1.33gO1gC
У з'єднанні В масове відношення вуглецю до кисню становить:
2.67gO1gC
Співвідношення цих співвідношень становить:
1.33gO1gC2.67gO1gC=12
Це підтримує закон множинних пропорцій. Це означає, що A і B - це різні сполуки, причому A має на половину менше вуглецю на кількість кисню (або вдвічі більше кисню на кількість вуглецю), як B. Можливою парою сполук, які б відповідали цьому співвідношенню, буде A = CO 2 і B = CO.
Проаналізовано зразок сполуки Х (прозора, безбарвна горюча рідина з помітним запахом) і виявлено, що містить 14,13 г вуглецю та 2,96 г водню. Проаналізовано зразок сполуки Y (прозора, безбарвна горюча рідина з помітним запахом, який трохи відрізняється від запаху X) і виявлено, що містить 19,91 г вуглецю та 3,34 г водню. Чи є ці дані прикладом закону певних пропорцій, закону кратних пропорцій чи ні ні? Що ці дані говорять вам про речовини X і Y?
- Відповідь
-
У з'єднанні X масове відношення вуглецю до водню становить14.13gC2.96gH.
У з'єднанні Y масове відношення вуглецю до водню становить19.91gC3.34gH.
Співвідношення цих співвідношень становить
14.13gC2.96gH19.91gC3.34gH=4.77gC/gH5.96gC/gH=0.800=45.
Це невелике співвідношення цілих чисел підтримує закон множинних пропорцій. Це означає, що X і Y - різні сполуки.
Докази атомів настільки великі, що мало хто сумнівається в їх існуванні. Насправді окремі атоми зараз регулярно спостерігаються за допомогою найсучасніших технологій. Більше того, їх навіть можна використовувати для створення гарних зображень або, як показують дослідження IBM у відео2.3.1, управління окремими атомами можна використовувати для створення анімації.
Відео2.3.1: Хлопчик і його атом: Найменший у світі фільм
Хлопчик і його атом - це анімаційний короткометражний фільм із зупинкою руху 2012 року, випущений IBM Research. Фільм розповідає історію хлопчика і норовливого атома, які зустрічаються і стають друзями. На ній зображений хлопчик, який грає з атомом, який приймає різні форми. Це було зроблено шляхом переміщення молекул окису вуглецю, розглянутих за допомогою скануючого тунельного мікроскопа, пристрою, який збільшує їх у 100 мільйонів разів. Ці молекули були переміщені для створення зображень, які потім зберігалися як окремі кадри для створення фільму.
Резюме
- Атомна теорія Дальтона є першою науковою теорією, яка пов'язує хімічні зміни зі структурою, властивостями та поведінкою атома. Загальні принципи цієї теорії полягали в наступному:
- Вся матерія складається з надзвичайно дрібних частинок, званих атомами.
- Атоми даного елемента ідентичні за розміром, масі та іншим властивостям. Атоми різних елементів відрізняються розмірами, масою, іншими властивостями.
- Атоми не можуть бути поділені, створені або знищені.
- Атоми різних елементів можуть поєднуватися в простих цілих числових співвідношеннях, утворюючи хімічні сполуки.
- Закон множинних пропорцій стверджує, що всякий раз, коли одні й ті ж два елементи утворюють більше однієї сполуки, різні маси одного елемента, які поєднуються з однаковою масою іншого елемента, знаходяться в співвідношенні малих цілих чисел.
Дописувачі та атрибуція
- Template:ContribCK12
- Template:ContribAgnewM
- Template:ContribAgnewH
- TextMap: Chemistry - The Central Science (Brown et al.)
- Template:ContribOpenStax

