2.5: Менделєєв і Періодична таблиця
- Page ID
- 20730
- Поясніть, як елементи організовані в таблиці Менделєєва.
- Опишіть, як деякі характеристики елементів співвідносяться з їх позиціями в таблиці Менделєєва.
Періодична таблиця є символом хімії для багатьох. Це єдине зображення, яке містить всі відомі елементи у Всесвіті, об'єднані в легко розбірливу таблицю. Є багато шаблонів, присутніх в таблиці, а також. Всі елементи немов поєднуються між собою, з'єднуючись, утворюючи «образ хімії». Ідея стихії вперше виникла в 3000 році до н.е. великий грецький філософ Аристотель задумав ідею, що все на землі було складено з цих елементів. У давнину такі елементи, як золото і срібло, були легкодоступні, однак стихіями, які обрав Аристотель, були Земля, Вода, Вогонь і Повітря.
Нові закономірності та періодичність в межах відомих елементів
Сучасна таблиця Менделєєва еволюціонувала через довгу історію спроб хіміків розташувати елементи відповідно до їх властивостей, як допоміжний засіб у прогнозуванні хімічної поведінки. Одним з перших припустив таку домовленість німецький хімік Йоганнес Доберейнер (1780—1849), який помітив, що багато відомих елементів можна згрупувати в тріади. Тріада - це набір з трьох елементів, які мають схожі властивості - наприклад, хлор, бром та йод; мідь, срібло та золото. Доберейнер запропонував, щоб всі елементи могли бути згруповані в такі тріади, але подальші спроби розширити його концепцію не увінчалися успіхом.
До середини 19 століття були визначені атомні маси багатьох елементів. Такі вчені, як Джон Ньюлендс і Александер-Еміль Бегуєр де Шанкуртуа, сформували власні версії періодичних таблиць. Англійський хімік Джон Ньюлендс (1838—1898), який висував гіпотезу, що хімія елементів може бути пов'язана з їх масами, розташував відомі елементи в порядку збільшення атомної маси і виявив, що кожен сьомий елемент має подібні властивості. Тому Ньюлендс припустив, що елементи можна класифікувати на октави. Він описав октави як групу з семи елементів, які відповідають горизонтальним рядам в основних групах сьогоднішньої таблиці Менделєєва. Було сім елементів, тому що благородні гази в той час не були відомі. На жаль, «закон октав» Ньюлендса, схоже, не працював для елементів важче кальцію, і його ідея була публічно висміяна.
Періодична таблиця: Менделєєв і Мейєр
Менделєєва таблиця досягла свого сучасного вигляду завдяки праці німецького хіміка Юліуса Лотара Мейєра (1830—1895) та російського хіміка Димитрія Менделєєва (1834—1907), обидва з яких зосередилися на взаємозв'язку між атомною масою та різними фізико-хімічними властивостями. У 1869 році вони самостійно запропонували по суті ідентичні розташування елементів. Мейєр вирівняв елементи в своїй таблиці відповідно до періодичних варіацій простих атомних властивостей, таких як «атомний обсяг», який він отримав шляхом ділення атомної маси (молярної маси) в грамах на моль на щільність елемента в грамах на кубічний сантиметр. Ця властивість еквівалентна тому, що сьогодні визначається як молярний об'єм—t молярна маса елемента, поділена на його щільність (вимірюється в кубічних сантиметрах на моль):
\[ \frac{molar\; mass\left ( \cancel{g}/mol \right )}{density\left ( \cancel{g}/cm^{3} \right )}=molar\; volume\left ( cm^{3}/mol \right ) \tag{3.1.1} \]
Менделєєва, який вперше опублікував свою таблицю Менделєєва в 1869 році (рис.\(\PageIndex{1}\)), Зазвичай приписують походження сучасної таблиці Менделєєва. Ключова відмінність його розташування елементів, від розташування Мейєра та інших, полягає в тому, що Менделєєв не припускав, що всі елементи були виявлені (насправді на той момент було відомо лише близько двох третин природних елементів). Натомість він навмисно залишив пробіли у своїй таблиці при атомних масах 44, 68, 72 та 100 - в очікуванні, що елементи з цими атомними масами будуть виявлені. Ці заготовки відповідають елементам, які ми зараз знаємо як скандій, галій, германій та технецій.
Групи в таблиці Менделєєва визначаються тим, скільки атомів кисню або водню необхідно для утворення з'єднань з кожним елементом. Наприклад, в I групі два атоми водню (H), літію (Li), натрію (Na) і калію (K) утворюють сполуки з одним атомом кисню. У групі VII один атом фтору (F), хлору (Cl) і брому (Br) вступають в реакцію з одним атомом водню. Зверніть увагу, як цей підхід має проблеми з переходом металів. Приблизно до 1960 року прямокутний стіл, заснований на реактивності - і розроблений зі столу Менделєєва - був стандартним на передній частині лекційних залів з хімії.
Найбільш переконливим доказом на підтвердження розташування елементів Менделєєва стало відкриття двох раніше невідомих елементів, властивості яких тісно відповідали його прогнозам (табл.\(\PageIndex{1}\)). Дві заготовки, які Менделєєв залишив у своїй первісній таблиці, були нижче алюмінію та кремнію, очікуючи відкриття двох поки невідомих елементів, ека-алюмінію та ека-кремнію (від санскритської еки, що означає «один», як у «один за алюмінієм»). Спостережувані властивості галію та германію настільки добре збігалися з властивостями ека-алюмінію та ека-кремнію, що як тільки вони були виявлені, Менделєєва періодична таблиця швидко отримала визнання.
Відео\(\PageIndex{1}\): Геній таблиці Менделєєва Менделєєва.
| Нерухомість | Ека - Алюміній (передбачено) | Галій (спостерігається) | Ека -кремній (передбачено) | Германій (спостерігається) |
|---|---|---|---|---|
| атомна маса | 68 | 69.723 | 72 | 72.64 |
| елемент | метал | метал | брудно-сірий метал | сіро-білий метал |
| низький мп* | мп = 29,8°C | високий депутат | мп = 938°C | |
| d = 5,9 г/см 3 | d = 5,91 г/см 3 | d = 5,5 г/см 3 | d = 5,323 г/см 3 | |
| оксид | Е 2 З 3 | Газ 2 О 3 | ЕО 2 | ГеО 2 |
| d = 5,5 г/см 3 | d = 6,0 г/см 3 | d = 4,7 г/см 3 | d = 4,25 г/см 3 | |
| хлорид | Цель 3 | ГКЛ 3 | Цель 4 | ГеКл 4 |
| непостійний |
мп = 78°C бп* = 201° C |
б.п. <100°C | бп = 87°C | |
| * mp = температура плавлення; bp = температура кипіння. | ||||
Коли хімічні властивості елемента припускали, що йому, можливо, було присвоєно неправильне місце в попередніх таблицях, Менделєєв ретельно переглянув його атомну масу. Він виявив, наприклад, що атомні маси, про які раніше повідомляли про берилій, індій та уран, були неправильними. Атомна маса індію спочатку повідомлялася як 75.6, на основі передбачуваної стехіометрії iNO для його оксиду. Якби ця атомна маса була правильною, то індій довелося б розміщувати посередині неметалів, між миш'яком (атомна маса 75) і селеном (атомна маса 78). Оскільки елементарний індій є сріблясто-білим металом, Менделєєв постулював, що стехіометрія його оксиду дійсно була в 2 O 3, а не iNO. Це означало б, що атомна маса індію насправді становила 113, розміщуючи елемент між двома іншими металами, кадмієм та оловом.
Однією з груп елементів, яка була відсутня в таблиці Менделєєва, є благородні гази, всі вони були виявлені більш ніж через 20 років - між 1894 і 1898 роками - сер Вільям Рамсей (1852—1916; Нобелівська премія з хімії 1904). Спочатку Рамзі не знав, де розмістити ці елементи в таблиці Менделєєва. Аргон, перший був виявлений, мав атомну масу 40. Це було більше, ніж хлору і порівнянне з калієм; тому Рамсей, використовуючи ті ж міркування, що і Менделєєв, вирішив розмістити благородні гази між галогенами і лужними металами. Однак у 1913 році молодий британський фізик Х.Дж.Мозлі (1887—1915) проаналізував частоти рентгенівських променів, випромінюваних елементами, і виявив, що основою порядку елементів є атомний номер, а не атомна маса. Мозлі висунув гіпотезу, що розміщення кожного елемента в його ряду відповідає його атомному номеру Z, який є кількістю позитивних зарядів (протонів) в його ядрі. Мозлі залишив свою дослідницьку роботу в Оксфордському університеті, щоб приєднатися до британської армії в якості офіцера телекомунікацій під час Першої світової війни Він був убитий під час битви при Галліполі в Туреччині. Нарешті, в 1945 році Манхеттенський проект дав відкриття багатьох нових радіоактивних елементів. Гленн Сіборг запропонував додати ряд актинідів і лантанідів в нижній частині таблиці. Ця ідея прийшла з відкриттям америція і куріума, і їх унікальних властивостей. Зміна спочатку не була прийнята, але тепер включена до всіх періодичних таблиць. \(\PageIndex{2}\)На малюнку показаний часовий проміжок для відкриття різних елементів.
- До 1800 (36 елементів): Відкриття під час і до епохи Просвітництва.
- 1800-1849 (+22 елементи): Імпульс наукової революції та атомної теорії та промислової революції.
- 1850-1899 (+23 елементи): Вік класифікуючих елементів отримав імпульс від аналізу спектра.
- 1900-1949 (+13 елементів): Імпульс від старої квантової теорії, уточнення до періодичної таблиці та квантова механіка.
- 1950-1999 (+15 елементів): Манхеттенський проект і питання фізики частинок, для атомних номерів 97 і вище.
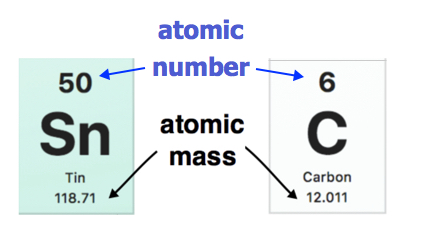
Кожен елемент сучасної таблиці Менделєєва представлений своїм атомним номером і атомною масою (рис. \(\PageIndex{3}\)). Атомна маса кожного елемента знаходиться під символом елемента в таблиці Менделєєва. Приклади наведені нижче. Атомна маса олова (Sn) становить 118,71 u, тоді як атомна маса вуглецю (С) - 12,011 u З іншого боку, атомний номер (Z) кожного елемента знаходиться над атомним символом.
Таблицю Менделєєва можна знайти за цим посиланням:
Резюме
- Сучасна таблиця Менделєєва базувалася на емпіричних кореляціях таких властивостей, як атомна маса; ранні моделі з використанням обмежених даних відзначали існування тріад і октав елементів зі схожими властивостями.
- Менделєєва таблиця досягла свого нинішнього вигляду завдяки роботі Димитрія Менделєєва та Юліуса Лотара Мейєра, обидва з яких зосередилися на взаємозв'язку між атомною масою та хімічними властивостями.
- Кореляція з електронною структурою атомів була виявлена, коли Мозлі показав, що періодичне розташування елементів визначається атомним номером, а не атомною масою.
