2.2: Наукові закони - збереження маси і певних пропорцій
- Поясніть закон збереження маси.
- Поясніть закон певних пропорцій.
Закон збереження маси
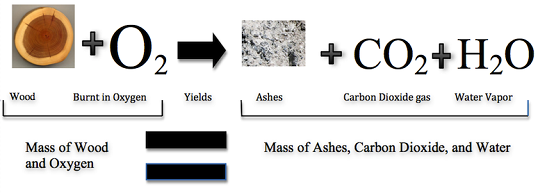
Може здатися, що спалювання руйнує матерію, але така ж кількість, або маса, речовини все ще існує після багаття, як і раніше. На малюнку2.2.2 (нижче) видно, що при згорянні деревини вона з'єднується з киснем і змінюється не тільки на золу, але і на вуглекислий газ і водяну пару. Гази спливають в повітря, залишаючи після себе якраз попіл. Припустимо, ви вимірювали масу деревини до того, як вона згоріла, і масу попелу після того, як вона згоріла. Також припустимо, що ви змогли виміряти кисень, який використовується вогнем, і гази, що утворюються вогнем. Що б ти знайшов? Загальна маса речовини після пожежі була б такою ж, як і загальна маса речовини до пожежі.

Закон збереження маси був створений в 1789 році французьким хіміком Антуаном Лавуазьє. Закон збереження маси говорить, що матерія не може бути створена або знищена в хімічній реакції. Наприклад - на малюнку2.2.3 - коли деревина горить, маса сажі, золи та газів дорівнює початковій масі деревини та кисню, коли вона вперше реагувала.
Отже, маса продукту (ів) дорівнює масі реагентів. Реагенти - це два або більше елементів, які хімічно взаємодіють для отримання нової речовини; продукт - це речовина (и), що утворилися в результаті хімічної реакції (Відео2.2.1). Матерія (і маса) не можуть бути створені або знищені, але можуть змінювати форми на інші речовини, такі як рідини, гази, тверді речовини тощо.
Відео2.2.1 Це приємна маленька демонстрація, що показує збереження маси в дії.
Важливо добре знати закон. Якщо дерево вагою 300 кг згорає - коли процес завершиться, залишається лише зола, і всі вони разом важать 10 кг. Ви можете задатися питанням, куди пішли інші 290 кг. Відсутні 290 кг були випущені в атмосферу як дим, тому єдиною видимою речовиною залишилося 10 кг золи. Якщо розібратися в законі збереження маси, то знаєте, що інші 290 кг повинні були кудись піти, тому що він повинен був дорівнювати масі дерева до того, як воно згоріло.
Якщо при нагріванні 10,0 г карбонату кальцію (CaCo 3) утворюється 4,4 г вуглекислого газу (СО 2) і 5,6 г оксиду кальцію (СаО), показують, що ці спостереження узгоджуються з законом збереження маси.
Рішення
Mass of the reactants=Mass of the products10.0g of CaCO3=4.4g of CO2+5.6g of CaO10.0g of reactant=10.0g of products
Оскільки маса реагенту дорівнює масі продуктів, спостереження узгоджуються з законом збереження маси.
Гідроксид калію (KOH) легко реагує з вуглекислим газом (CO2) з утворенням карбонату калію (K2CO3) і води (H2O). Скільки грам карбонату калію виробляється, якщо 224,4 гKOH реагують з 88,0 гCO2? При реакції також виробляється 36,0 г води.
- Відповідь
- 276,4 г карбонату калію
Закон певних пропорцій
Йосип Пруст (1754-1826) сформулював закон певних пропорцій (його також називають Законом постійного складу або Законом Пруста). Цей закон стверджує, що якщо з'єднання розбити на складові елементи, маси складових завжди матимуть однакові пропорції, незалежно від кількості або джерела вихідної речовини. Йосип Пруст грунтував цей закон насамперед на своїх експериментах з основним карбонатом міді. На ілюстрації нижче зображений цей закон в дії.
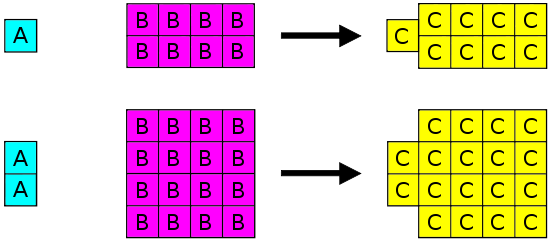
Закон певних пропорцій стверджує, що в даному типі хімічної речовини елементи завжди поєднуються в однакових пропорціях по масі.
Закон певних пропорцій застосовується, коли елементи реагують разом, утворюючи один і той же продукт. Тому, хоча Закон певних пропорцій може бути використаний для порівняння двох експериментів, в яких водень і кисень реагують з утворенням води, Закон певних пропорцій не може бути використаний для порівняння одного експерименту, в якому водень і кисень реагують з утворенням води, і інший експеримент, в якому водень і кисень реагують з утворенням перекису водню (перекис - ще один матеріал, який можна зробити з водню і кисню).
Кисень становить 88,8% від маси будь-якої проби чистої води, в той час як водень становить залишилися 11,2% маси. Ви можете отримати воду шляхом танення льоду або снігу; або шляхом конденсації пари з річки, моря, ставка тощо Це може бути з різних місць: США, Великобританії, Австралії або де завгодно. Вода може бути зроблена хімічними реакціями, такими як спалювання водню в кисні.
Однак якщо вода чиста, вона завжди буде складатися з 88,8% кисню по масі і 11,2% водню по масі, незалежно від її джерела або способу приготування.
Відео2.2.2 Закон певних пропорцій.
Резюме
- Горіння та інші зміни матерії не руйнують матерію.
- Маса матерії завжди однакова до і після того, як відбуваються зміни.
- Закон збереження маси говорить, що матерія не може бути створена або знищена.
- Закон певних пропорцій говорить, що дане хімічна сполука завжди містить однакові елементи в точно однакових пропорціях по масі.
Посилання
- Петруччі, Ральф, Вільям Харвуд, Джеффрі Оселедець та Джеффрі Мадура. Загальна хімія. 9-е видання. Верхня річка Сідло, Нью-Джерсі: Пірсон Прентінс Холл, 2007.
- Мур, Джон. Хімія для чайників. Джон Вілі і сини Inc, 2002.
- Азімов, Айзек. Коротка історія хімії., КТ.: Грінвуд Прес, 1965.
- Паттерсон, Елізабет Джон Далтон і атомна теорія. Гарден-Сіті, Нью-Йорк: Даблдей, 1970.
- Майерс, Річард. Основи хімії. Грінвуд, 2003.
- Демтредер, Вольфганг. Атоми, молекули та фотони: вступ до атомно-молекулярної та квантової фізики. 1-е видання. Спрінгер. 2002 рік.

