8.3: Квантові числа для електронів
- Page ID
- 22535
- Поясніть, що таке спектри.
- Вивчіть квантові числа, які присвоюються електронам.
Існує два основні способи генерації світла: або нагріти об'єкт, щоб він був настільки гарячим, що він світиться, або пропускати електричний струм через зразок речовини (як правило, газ). Лампи розжарювання та люмінесцентні лампи генерують світло за допомогою цих двох методів відповідно.
Гарячий об'єкт виділяє континуум світла. Ми помічаємо це, коли видима частина електромагнітного спектра пропускається крізь призму: призма розділяє світло на складові його кольори, а всі кольори присутні в суцільній веселці (рис.\(\PageIndex{1a}\) - Призми і Світло). Це зображення відоме як безперервний спектр. Однак, коли електрика пропускається через газ і випромінюється світло і це світло пропускається через призму, ми бачимо лише певні лінії світла на зображенні (рис.\(\PageIndex{1b}\)). Це зображення називається лінійним спектром. Виходить, що кожен елемент має свій унікальний, характерний лінійний спектр.

Чому світло, що випромінюється електрично збудженим газом, має лише певні кольори, тоді як світло, що виділяється гарячими предметами, має безперервний спектр? Довгий час це не дуже добре пояснювалося. Особливо простим був спектр водневого газу, який можна було легко описати рівнянням; жоден інший елемент не має такого передбачуваного спектра (рис.\(\PageIndex{2}\) - Водневий спектр). Наприкінці дев'ятнадцятого століття вчені встановили, що положення ліній підкоряються шаблону, заданому рівнянням.
\[\frac{1}{\lambda }=(109,700cm^{-1})\left ( \frac{1}{4} -\frac{1}{n^{2}}\right )\nonumber \]
де n = 3, 4, 5, 6 і т.д. проте вони не змогли пояснити, чому це так.

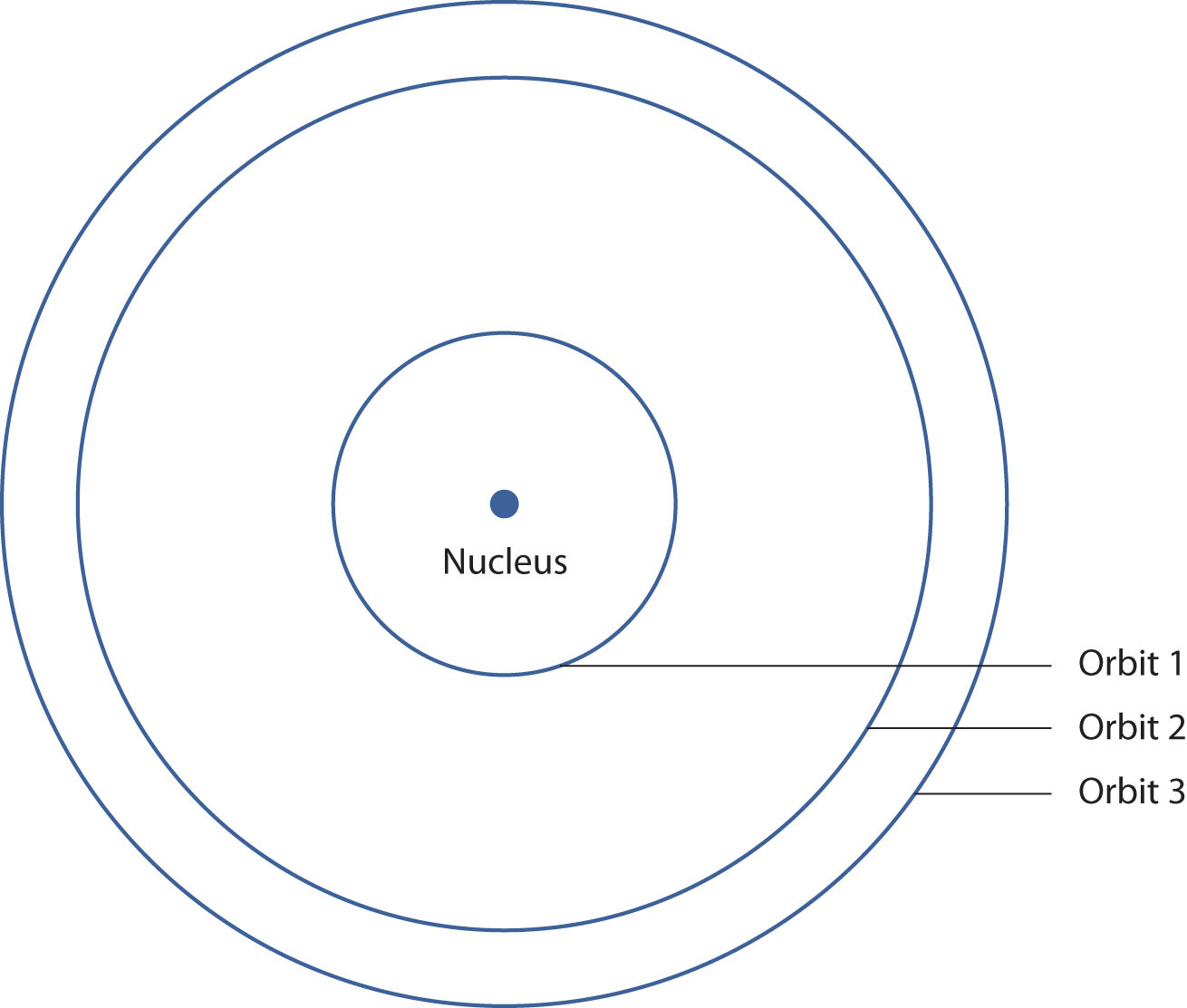
У 1913 році датський вчений Нільс Бор запропонував причину, чому спектр атомів водню виглядав таким чином. Він припустив, що електрон в атомі водню не міг мати ніякої випадкової енергії, маючи лише певні фіксовані значення енергії, які індексувалися числом n (те саме n у рівнянні вище і тепер називаються квантовим числом). Величини, які мають певні конкретні значення, є квантованими значеннями. Бор припустив, що енергія електрона у водні була квантована, оскільки вона перебувала на певній орбіті. Оскільки енергії електрона можуть мати лише певні значення, зміни енергій можуть мати лише певні значення (дещо схожі на сходи - не тільки сходи встановлені на певній висоті, але й висота між ступенями фіксована). Нарешті, Бор припустив, що енергія світла, що випромінюється електрифікованим водневим газом, дорівнює різниці енергій енергетичних станів електрона:
\[E_{light}=h\nu =\Delta E_{electron}\nonumber \]
Це означає, що випромінюються лише певні частоти (і, отже, певні довжини хвиль) світла. Малюнок\(\PageIndex{3}\) - Модель Атома водню Бора, показує модель атома водню, засновану на ідеях Бора.
Ідеї Бора були корисні, але були застосовні лише до атома водню. Однак пізніше дослідники узагальнили ідеї Бора в нову теорію під назвою квантова механіка, яка пояснює поведінку електронів так, ніби вони діють як хвиля, а не як частинки. Квантова механіка передбачає дві основні речі: квантовані енергії для електронів всіх атомів (не тільки водню) і організацію електронів всередині атомів. Електрони більше не вважаються випадковим чином розподіленими навколо ядра або обмеженими певними орбітами (у зв'язку з цим Бор помилявся). Замість цього електрони збираються в групи та підгрупи, які багато пояснюють хімічну поведінку атома.
У квантово-механічній моделі атома стан електрона описується чотирма квантовими числами, а не тільки передбаченим Бором. Перше квантове число називається головним квантовим числом (n). Головне квантове число багато в чому визначає енергію електрона. Кажуть, що електрони в одному атомі, які мають однакове основне квантове число, займають електронну оболонку атома. Основним квантовим числом може бути будь-яке ненульове натуральне число: 1, 2, 3, 4,...
Усередині оболонки може бути декілька можливих значень наступного квантового числа - квантового числа моментального моменту (). Квантове число має незначний вплив на енергію електрона, але також впливає на просторовий розподіл електрона у тривимірному просторі, тобто на форму розподілу електрона у просторі. Значення l квантового числа може бути будь-яким цілим числом від 0 до n − 1: ly = 0, 1, 2,..., n − 1.
Таким чином, для заданого значення n існують різні можливі значення, що дорівнюють:
| Якщо n дорівнює | може бути |
|---|---|
| 1 | 0 |
| 2 | 0 або 1 |
| 3 | 0, 1 або 2 |
| 4 | 0, 1, 2 або 3 |
і так далі. Кажуть, що електрони всередині оболонки, які мають однакову величину, як кажуть, займають підоболонку в атомі. Зазвичай замість того, щоб посилатися на числове значення, літера представляє значення ly (щоб допомогти відрізнити його від основного квантового числа):
| Якщо л дорівнює | Лист є |
|---|---|
| 0 | s |
| 1 | р |
| 2 | d |
| 3 | f |
Наступне квантове число називається магнітним квантовим числом (m ly). Для будь-якого значення ly існує 2:05 + 1 можливі значення m ly , починаючи від −ly до ⟩:
\[−ℓ \lt mℓ \lt ℓ\nonumber \]
або
Нижче наведено список можливих значень m ly для можливих значень, що дорівнює числу:
| Якщо л дорівнює | Значення m можуть бути |
|---|---|
| 0 | 0 |
| 1 | −1, 0 або 1 |
| 2 | −2, −1, 0, 1 або 2 |
| 3 | −3, −2, −1, 0, 1, 2 або 3 |
Особливе значення m ⟩ диктує орієнтацію розподілу електрона у просторі. Коли дорівнює нулю, m ly може бути тільки нулем, тому можлива лише одна орієнтація. Коли л дорівнює 1, існує три можливі орієнтації розподілу електрона. Коли л дорівнює 2, існує п'ять можливих орієнтацій розподілу електронів. Це продовжується і продовжується для інших значень, але ми не повинні розглядати будь-які більш високі значення, які тут. Кожне значення m позначає певну орбіталь. Таким чином, існує лише одна орбіталь, коли α дорівнює нулю, три орбіталі, коли дорівнює 1, п'ять орбіталів, коли дорівнює 2, і так далі. Квантове число m ly не впливає на енергію електрона, якщо електрони не піддаються магнітному полю - звідси і його назва.
Ql квантове число диктує загальну форму розподілу електронів у просторі (рис.\(\PageIndex{4}\) - Електронні орбіталі). Будь-яка s орбітальна сферично симетрична (рис.\(\PageIndex{4a}\) - Електронні орбіталі), а в будь-якій s підоболонці є тільки одна орбіталь. Будь-яка орбітальна p має дволопатеву, подібну до гантелей форму (рис.\(\PageIndex{4b}\) - Електронні орбіталі); оскільки їх три, ми зазвичай представляємо їх як спрямовані вздовж x-, y- та z-осей декартового простору. Орбіталі d - це чотирилопатеві розетки (рис.\(\PageIndex{4c}\) - Електронні орбіталі) і вони по-різному орієнтовані в просторі (та, що позначенамає дві частки і тор замість чотирьох часточок, але він еквівалентний іншим орбіталям). Коли існує більше одного можливого значення m, кожна орбіталь позначається одним з можливих значень. Слід зазначити, що діаграми на малюнку\(\PageIndex{4}\) є оцінками розподілу електронів у просторі, а не поверхнях, на яких закріплені електрони.
Кінцеве квантове число - спінове квантове число (m s). Електрони та інші субатомні частинки поводяться так, ніби вони обертаються (ми не можемо сказати, чи є вони насправді, але вони поводяться так, ніби вони є). Самі електрони мають два можливих спінових стану, і через математику їм присвоюються квантові числа +1/2 і −1/2. Це єдині два можливі варіанти спінового квантового числа електрона.
З множини квантових чисел {n, ⟩ , m, m s}, які можливі, а які не допускаються?
- {3, 2, 1, +1/2}
- {2, 2, 0, −1/2}
- {3, −1, 0, +1/2}
Рішення
- Головне квантове число n має бути цілим числом, як воно тут. Квантове число ly має бути менше, ніж n, яке воно є. Квантове число m ly має бути між −⟩ і ⟩, Яким воно є. Спінове квантове число дорівнює +1/2, що допускається. Оскільки цей набір квантових чисел дотримується всіх обмежень, це можливо.
- Квантове число n є цілим числом, але квантове число ly має бути менше n, а це не так. Таким чином, це не дозволений набір квантових чисел.
- Головне квантове число n є цілим числом, але не допускається бути від'ємним. Тому це не дозволений набір квантових чисел.
З множини квантових чисел {n, ⟩ , m, m s}, які можливі, а які не допускаються?
- {4, 2, −2, 1}
- {3, 1, 0, −1/2}
Відповіді
- Спін має бути +1/2 або −1/2, тому цей набір квантових чисел не допускається.
- дозволено
Неонове світло - це в основному електрифікована трубка з невеликою кількістю газу в ній. Електрика збуджує електрони в атомах газу, які потім виділяють світло, коли електрони повертаються в стан нижчої енергії. Однак багато так звані «неонові» вогні не містять неонових!
Хоча ми знаємо тепер, що газовий розряд виділяє лише певні кольори світла, без призми чи іншого компонента для розділення окремих світлих кольорів, ми бачимо композицію всіх випромінюваних кольорів. Не дивно, що певний колір переважає. Справжні неонові вогні, з неоновим газом в них, мають червонувато-оранжеве світло завдяки великій кількості випромінюваного червоного, оранжевого та жовтого кольорів світла. Однак якщо замість неону використовується криптон, випромінюється білуватий світло, тоді як використання аргону дає синьо-фіолетове світло. Світло, наповнене газом азотом, світиться фіолетовим кольором, як і гелієва лампа. Інші гази - і суміші газів - випромінюють інші кольори світла. Як не дивно, незважаючи на свою важливість у розвитку сучасної електронної теорії, водневі лампи випромінюють мало видимого світла і рідко використовуються в освітлювальних цілях.

Неонові вогні. Різні кольори цих «неонових» вогнів викликані газами, відмінними від неону в розрядних трубках. Людина/Потреба/Бажання. Неонова скульптура Брюса Наумана (1983), який був охарактеризований як концептуальний художник. (CC BY-SA 3.0; ескіпул).
Ключові виноси
Електрони в атомах мають квантовану енергію. Стан електронів в атомах описується чотирма квантовими числами.
