8.4: Організація електронів в атомах
- Page ID
- 22534
- Дізнайтеся, як електрони організовані всередині атомів.
- Представляють організацію електронів електронною конфігурацією.
Тепер, коли ви знаєте, що електрони мають квантові числа, як вони розташовані в атомах? Ключ до розуміння електронного розташування узагальнений у принципі виключення Паулі: жоден два електрони в атомі не може мати однаковий набір з чотирьох квантових чисел. Це різко обмежує кількість електронів, які можуть існувати в оболонці або підоболонці.
Електрони, як правило, організовуються навколо атома, спочатку починаючи з найменших можливих квантових чисел, які є оболонками-підоболонками з нижчими енергіями. Розглянемо H, атом з єдиним електроном. У нормальних умовах одиночний електрон переходив би в оболонку n = 1, яка має лише одну підоболонку s з однією орбітальною (оскільки m ly може дорівнювати лише 0). Угода полягає в тому, щоб позначити комбінацію оболонки та підоболонки номером оболонки та літерою, яка представляє підоболонку. Таким чином, електрон йде в комбінації 1s оболонка-підоболонка. Зазвичай не потрібно вказувати квантові числа m ly або m s, але для атома H електрон має m = 0 (єдино можливе значення) і m s або +1/2 або −1/2.
Атом Він має два електрони. Другий електрон також може перейти в комбінацію 1s оболонка-підоболонка, але тільки в тому випадку, якщо його спінове квантове число відрізняється від спінового квантового числа першого електрона. Таким чином, множинами квантових чисел для двох електронів є {1, 0, 0, +1/2} і {1, 0, 0, −1/2}. Зверніть увагу, що загальний набір відрізняється для двох електронів, як того вимагає принцип виключення Паулі.
Наступний атом - Li, з трьома електронами. Однак тепер принцип виключення Паулі передбачає, що ми не можемо помістити цей електрон у оболонку-підоболонку 1-ї оболонки, тому що як би ми не намагалися, цей третій електрон мав би той самий набір з чотирьох квантових чисел, що і один з перших двох електронів. Таким чином, цей третій електрон повинен бути призначений для іншої комбінації оболонки та підоболонки. Однак оболонка n = 1 не має іншої підоболонки; вона обмежена лише 0 = 0 або підоболонкою s. Тому цей третій електрон повинен бути присвоєний оболонці n = 2, яка має підоболонку s (= 0) та підоболонку p (= 1). Знову ж таки, ми зазвичай починаємо з найменшого квантового числа, тому цей третій електрон присвоюється комбінації квантових чисел 2s оболонки-підоболонки.
Принцип виключення Паулі має чистий ефект обмеження кількості електронів, яким може бути присвоєно комбінація квантових чисел оболонки-підоболонки. Наприклад, в будь-якій s підоболонці, незалежно від того, яке число оболонки, може бути максимум лише два електрони. Після того, як підоболонка s заповнена, будь-які додаткові електрони повинні перейти до іншої підоболонки в оболонці (якщо вона існує) або до оболонки з вищим номером. Подібний аналіз показує, що p підоболонка може утримувати максимум шість електронів. D підоболонка може містити максимум 10 електронів, тоді як підоболонка f може мати максимум 14 електронів. Обмежуючи підоболонки цими максимумами, ми можемо розподілити наявні електрони на їх оболонки та підоболонки.
Як би шість електронів для C були присвоєні квантовим числам n та l?
Рішення
Перші два електрони йдуть в комбінацію 1s оболонка-підоболонка. Два додаткових електрона можуть йти в 2s оболонку-підоболонку, але тепер ця підоболонка заповнена максимальною кількістю електронів. Оболонка n = 2 також має p підоболонку, тому інші два електрони можуть перейти в підоболонку 2p. Підоболонка 2p не повністю заповнена, оскільки вона може утримувати максимум шість електронів.
Як би 11 електронів для Na були присвоєні квантовим числам n та l?
Відповідь
два електрони 1s, два електрони 2s, шість 2p електронів і один електрон 3s
Тепер, коли ми бачимо, як електрони розподіляються між оболонками та підоболонками, нам потрібен більш стислий спосіб передачі цього розділу. Хіміки використовують електронну конфігурацію для представлення організації електронів в оболонках і підоболонках в атомі. Електронна конфігурація просто перераховує мітки оболонки та підоболонки, а правий верхній індекс дає кількість електронів у цій підоболонці. Оболонки і підоболонки перераховуються в порядку заповнення.
Наприклад, атом Н має один електрон у підоболонці 1s. Його електронна конфігурація
Н: 1с 1
Атом He має два електрони в підоболонці 1s. Його електронна конфігурація
Він: 1с 2
Три електрони для Li розташовані в підоболонці 1s (два електрони) та підоболонці 2s (один електрон). Електронна конфігурація Li дорівнює
Лі: 1с 2 2с 1
Атом Be має чотири електрони, два в підоболонці 1s і два в підоболонці 2s. Його електронна конфігурація
Бути: 1с 2 2с 2
Тепер, коли підоболонка 2s заповнена, електрони в більших атомах повинні перейти в підоболонку 2p, яка може утримувати максимум шість електронів. Наступні шість елементів поступово заповнюють підоболонку 2p:
- Б: 1с 2 2с 2 2р 1
- С: 1с 2 2с 2 2р 2
- Н: 1с 2 2с 2 2р 3
- О: 1с 2 2с 2 2р 4
- Ф: 1с 2 2с 2 2р 5
- Новий: 1с 2 2 2с 2 2р 6
Тепер, коли 2p підоболонка заповнена (всі можливі підоболонки в оболонці n = 2), наступний електрон для наступного більшого атома повинен перейти в оболонку n = 3, s підоболонки.
Яка електронна конфігурація для Na, яка має 11 електронів?
Рішення
Перші два електрони займають підоболонку 1s. Наступні два займають підоболонку 2s, тоді як наступні шість електронів займають підоболонку 2p. Це дає нам 10 електронів поки що, з 1 електроном залишився. Цей останній електрон йде в оболонку n = 3, s підоболонки. Таким чином, електронна конфігурація Na дорівнює 1s 2 2s 2 2p 6 3s 1.
Яка електронна конфігурація для Mg, яка має 12 електронів?
Відповідь
1с 2 2с 2 2п 6 3с 2
Для більших атомів розташування електронів ускладнюється. Це пов'язано з тим, що після заповнення підоболонки 3p спочатку заповнення підоболонки 4s фактично призводить до меншої загальної енергії, ніж заповнення 3d підоболонки. Нагадаємо, що в той час як основне квантове число значною мірою диктує енергію електрона, квантове число кутового моменту також впливає на енергію; до того часу, коли ми дійдемо до 3d і 4s підоболонок, ми бачимо перекриття в наповненні оболонок. Таким чином, після повного заповнення підоболонки 3p (що відбувається для Ar) наступний електрон для K займає підоболонку 4s, а не 3d підоболонку:
К: 1с 2 2с 2 2р 6 3с 2 3п 6 4с 1,
не
К: 1с 2 2с 2 2р 6 3с 2 3р 6 3р 6 3д 1
Для більших і великих атомів порядок заповнення оболонок і підоболонок здається ще більш складним. Є кілька корисних способів запам'ятати порядок, як показано на малюнку\(\PageIndex{1}\). Якщо слідувати стрілкам по порядку, вони проходять крізь підоболонки в тому порядку, що вони заповнені електронами в більших атомах. Спочатку порядок такий самий, як очікуваний порядок оболонки та підоболонки, але для більших атомів спостерігається деяке зміщення основних квантових чисел. Однак Рисунок\(\PageIndex{1}\) дає дійсне впорядкування заповнення підоболонок електронами для більшості атомів.
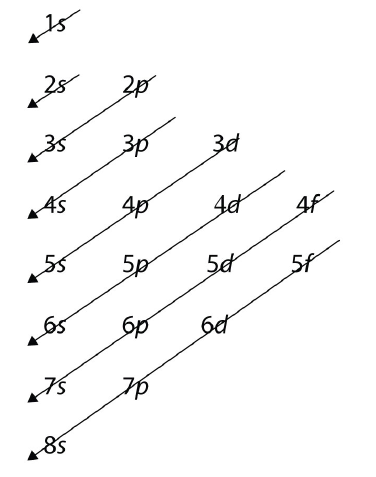
Яка прогнозована електронна конфігурація для Sn, яка має 50 електронів?
Рішення
Ми будемо слідувати діаграмі на малюнку 8.4., поки ми не зможемо розмістити 50 електронів у підоболонках у належному порядку: Sn: 1s 2 2s 2 2p 6 3s 2 3s 2 3p 6 4s 2 3d 10 4п 6 5с 2 4д 10 5п 2
Перевірте, додавши надскрипти, які вказують кількість електронів: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 2 + 10 + 10 + 2 = 50, тому ми розмістили всі 50 електронів в підоболонках в належному порядку.
Яка електронна конфігурація для Ba, який має 56 електронів?
Відповідь
1с 2 2с 2 2п 6 3с 2 3п 6 4с 2 3д 10 4п 6 5с 2 4д 10 5п 6 6 с 2
Як показав попередній приклад, електронні конфігурації можуть отримати досить довгі. Скорочена електронна конфігурація використовує один з елементів з останнього стовпця періодичної таблиці, який містить благородні гази, для представлення ядра електронів до цього елемента. Потім, інші електрони перераховуються явно. Наприклад, скорочена електронна конфігурація для Li, яка має три електрони, буде
Лі: [Він] 2s 1
де [Він] являє собою двоелектронне ядро, що еквівалентно електронній конфігурації Він. Квадратні дужки представляють електронну конфігурацію благородного газу. Це не так вже й абревіатура. Однак розглянемо скорочену електронну конфігурацію для W, яка має 74 електрона:
W: [Се] 6 х 2 4г 14 5х 4
Це значне спрощення над явним перерахуванням всіх 74 електронів. Таким чином, для великих елементів, скорочена електронна конфігурація може бути дуже корисним скороченням.
Що таке скорочена електронна конфігурація для Р, яка має 15 електронів?
Рішення
З 15 електронів електронна конфігурація Р дорівнює
П: 1с 2 2с 2 2р 6 3с 2 3р 3
Першим безпосереднім благородним газом є Ne, який має електронну конфігурацію 1s 2 2s 2 2p 6. Використовуючи електронну конфігурацію Ne для представлення перших 10 електронів, скорочена електронна конфігурація P дорівнює
P: [Не] 3с 2 3р 3
Що таке скорочена електронна конфігурація для Rb, яка має 37 електронів?
Відповідь
[Кр] 5 с 1
Є деякі винятки з суворого заповнення підоболонок електронами. У багатьох випадках електрон переходить від оболонки з вищим номером до нижчої, але заповненої пізніше, підоболонки, щоб заповнити пізніше заповнену підоболонку. Одним із прикладів є Ag. З 47 електронів передбачається, що його електронна конфігурація буде
Тег: [Кр] 5s 2 4 х 9
Однак експерименти показали, що електронна конфігурація насправді
Тег: [Кр] 5s 1 4х 10
Це, отже, кваліфікується як виняток з наших очікувань. У цей момент не потрібно запам'ятовувати винятки; але якщо ви зіткнетеся з одним, зрозумійте, що це виняток із звичайних правил заповнення підоболонок електронами, що може статися.
Резюме
Принцип виключення Паулі обмежує кількість електронів у підоболонках і оболонках. Електрони в більших атомах заповнюють оболонки і підоболонки в регулярному шаблоні, за яким можна слідувати. Електронні конфігурації - це стенографічний метод вказівки, які підоболонки займають електрони в атомах. Скорочені електронні конфігурації - це простіший спосіб представлення електронних конфігурацій для більших атомів. Винятки з суворого заповнення підоболонок електронами трапляються.
