5.E: стехіометрія і родимка (вправи)
- Page ID
- 22507
5.1: стехіометрія
- Згадайте рецепт торта з фунтом. Які можливі коефіцієнти перетворення ви можете побудувати, що стосуються компонентів рецепта?
- Згадайте рецепт млинців. Які можливі коефіцієнти перетворення ви можете побудувати, що стосуються компонентів рецепта?
- Які всі коефіцієнти перетворення можна побудувати з збалансованої хімічної реакції:\[\ce{2H2(g) + O2(g) → 2H2O(ℓ)}?\]
- Які всі коефіцієнти перетворення можна побудувати з збалансованої хімічної реакції N 2 (g) + 3H 2 (g) → 2NH 3 (g)?
- Задано хімічне рівняння: Na (s) + H 2 O () → NaOH (aq) + H 2 (g)
- Збалансувати рівняння.
- Скільки молекул Н 2 утворюється при реагуванні 332 атомів Na?
- Задано хімічне рівняння: S (s) + O 2 (g) → SO 3 (g)
- Збалансувати рівняння.
- Скільки молекул O 2 потрібно, коли 38 атомів S реагують?
- Для збалансованого хімічного рівняння:
6Н + (ак) + 2МН 4 − (ак) + 5Н 2 О 2 () → 2Мн 2+ (ак) + 5О 2 (г) + 8H 2 О ( )
скільки молекул Н 2 О утворюється при реагуванні 75 молекул Н 2 О 2?
-
Для збалансованої хімічної реакції
2С 6 Н 6 (л) + 15О 2 (г) → 12СО 2 (г) + 6Н 2 О ()скільки молекул СО 2 утворюється при реагуванні 56 молекул С 6 Н 6?
-
З огляду на збалансоване хімічне рівняння
Фе 2 О 3 (и) + 3СО 3 (г) → Фе 2 (СО 4) 3скільки молекул Fe 2 (SO 4) 3 утворюється, якщо реакція 321 атома S?
-
Для збалансованого хімічного рівняння
КуО (и) + Н 2 С (г) → КуС + Н 2 О ()скільки молекул CU утворюється, якщо реагують 9,044 атома Н?
-
Для збалансованого хімічного рівняння
Фе 2 О 3 (и) + 3СО 3 (г) → Фе 2 (СО 4) 3припустимо, нам потрібно зробити 145 000 молекул Fe 2 (SO 4) 3. Скільки молекул SO 3 нам потрібно?
- Одним із способів виготовлення гексафториду сірки є реакція тіоформальдегіду, CH 2 S, з елементарним фтором:
СН 2 С+6Ф 2 → СФ 4 + 2ВЧ + СФ 6
Якщо потрібно 45 750 молекул SF 6, скільки молекул F 2 потрібно?
- Побудувати три незалежні коефіцієнти перетворення, можливі для цих двох реакцій:
- 2Н 2 + О 2 → 2Н 2 О
- Н 2 + О 2 → Н 2 О 2
Чому співвідношення між Н 2 і О 2 відрізняються?
Коефіцієнти перетворення різні, оскільки стехіометрії збалансованих хімічних реакцій різні.
- Побудувати три незалежні коефіцієнти перетворення, можливі для цих двох реакцій:
- 2Н+ Сл 2 → 2НаКл
- 4Н+2Сл 2 → 4NaCl
Які подібності, якщо такі є, існують у коефіцієнтах перетворення цих двох реакцій?
- \[\frac{1\, pound\, butter}{1\, pound\, flour}\]або два\[\frac{1\, pound\, sugar}{1\, pound\, eggs}\] коефіцієнти перетворення, які можуть бути побудовані з рецепту фунта торт. Можливі й інші коефіцієнти перетворення. 1 фунт вершкового масла 1 фунт борошна
-
-
2 molecules H 2 1 molecule O 2 2 molecules H 2 1 molecule O 2 -
-
-
2На (и) + 2Н 2 О () → 2НаО (ак) + Н 2 (г)
-
166 молекул
-
-
-
120 молекул
-
-
107 молекул
-
-
435 000 молекул
-
-
- \[\frac{2\, molecules\, H_{2}}{1\, molecule\, O_{2}}\ , \frac{1\, molecule\, O_{2}}{2\, molecules\, H_{2}O}\ , \frac{2\, molecules\, H_{2}}{2\, molecules\, H_{2}O}\]
- \[\frac{1\, molecules\, H_{2}}{1\, molecule\, O_{2}}\ , \frac{1\, molecule\, O_{2}}{2\, molecules\, H_{2}O_{2}}\ , \frac{1\, molecule\, H_{2}}{1\, molecule\, H_{2}O_{2}}\]
5.2: Крот
- Скільки атомів присутній в 4,55 моль Fe?
- Скільки атомів присутній в 0,0665 моль К?
- Скільки молекул присутній в 2,509 моль H 2 S?
- Скільки молекул присутній в 0,336 моль ацетилену (С 2 Н 2)?
- Скільки родимок присутній в атомах 3,55 × 10 24 Pb?
- Скільки родимок присутній в 2,09 × 10 22 атомах Ti?
- Скільки родимок присутній в молекулах 1,00 × 10 23 PF 3?
- Скільки родимок присутній в молекулах пеніциліну 5,52 × 10 25?
- Визначте молярну масу кожної речовини.
- СІ
- Ш 4
- К 2 О
- Визначте молярну масу кожної речовини.
- Сл 2
- SeCl 2
- Са (С 2 Н 3 О 2) 2
- Визначте молярну масу кожної речовини.
- Аль
- Всі 2 з 3
- CoCl 3
- Визначте молярну масу кожної речовини.
- О 3
- Ані
- З 12 Ч 22 З 11
- Яка маса 4,44 моль Rb?
- Яка маса 0,311 моль Xe?
- Яка маса 12,34 моль Al 2 (SO 4) 3?
- Яка маса 0,0656 моль PbCl 2?
- Скільки родимок присутній в 45,6 г СО?
- Скільки родимок присутній в 0,00339 г LiF?
- Скільки родимок присутній в 1,223 г SF 6?
- Скільки родимок присутній в 48,8 г BaCo 3?
- Скільки родимок присутній в 54,8 мл ртуті, якщо щільність ртуті 13,6 г/мл?
- Скільки родимок присутній в 56,83 мл О 2, якщо щільність О 2 становить 0,00133 г/мл?
Відповіді
- 2,74 × 10 24 атома
-
-
1,511 × 10 24 молекули
-
-
5.90 моль
-
-
0,166 моль
-
-
-
28.086 г
-
32.118 г
-
94.195 г
-
-
-
-
26.981 г
-
101.959 г
-
165.292 г
-
-
-
379 г
-
-
4 222 г
-
-
1,63 моль
-
-
0,008374 моль
-
-
3,72 моль
5.3: Моль в хімічних реакціях
- Висловіть в мольних термінами, що означає це хімічне рівняння: CH 4 + 2O 2 → CO 2 + 2H 2 O
-
Висловіть в моль терміни, що означає це хімічне рівняння.
Na 2 СО 3 + 2HCl → 2NaCl + Н 2 О + СО 2 -
Скільки молекул кожної речовини беруть участь у рівнянні у Вправі 1, якщо воно інтерпретується термінами родимок?
-
Скільки молекул кожної речовини беруть участь у рівнянні у вправі 2, якщо воно інтерпретується термінами родимок?
-
Для хімічного рівняння
2С 2 Н 6 + 7О 2 → 4СО 2 + 6Н 2 Оякі еквіваленти можна писати в терміні родимок? Використовуйте знак ⇔.
-
Для хімічного рівняння
2Ал + 3Сл 2 → 2АлСл 3які еквіваленти можна писати в терміні родимок? Використовуйте знак ⇔.
-
Напишіть збалансовану хімічну реакцію на згоряння С 5 Н 12 (продукти - СО 2 і Н 2 О) і визначте, скільки молів Н 2 О утворюється при 5,8 моль О. 2 реагують.
-
Напишіть збалансовану хімічну реакцію на утворення Fe 2 (SO 4) 3 з Fe 2 O 3 і SO 3 і визначити, скільки родимок Fe 2 (SO 4) 3 утворюються при реагуванні 12,7 моль SO 3.
-
Для збалансованого хімічного рівняння
3Cu (и) + 2NO 3 − (ак) + 8H + (ак) → 3Cu 2+ (aq) + 4H 2 О () + 2NO (г)скільки родимок Cu 2+ утворюється при реагуванні 55,7 моль Н +?
-
Для збалансованого хімічного рівняння
Аль (и) +3Аг + (ак) → Аль 3+ (ак) + 3Аг (и)скільки родимок Ag утворюється при реагуванні 0,661 моль Al?
-
Для збалансованої хімічної реакції
4Н 3 (г) + 5O 2 (г) → 4NO (г) + 6Н 2 О ()скільки родимок H 2 O утворюється при реагуванні 0,669 моль NH 3?
-
Для збалансованої хімічної реакції
4NaOH (ак) + 2С (и) + 3О 2 (г) → 2На 2 СО 4 (ак) + 2Н 2 О ()скільки родимок Na 2 SO 4 утворюється при реагуванні 1,22 моль О 2?
-
Для збалансованої хімічної реакції
4КО 2 (с) + 2СО 2 (г) → 2К 2 СО 3 (с) + 3О 2 (г)визначити кількість молів обох продуктів, що утворюються при реагуванні 6,88 моль КО 2.
- Для збалансованої хімічної реакції
Відповіді
- Один моль СН 4 реагує з 2 моль О 2, щоб зробити 1 моль СО 2 і 2 моль Н 2 О.
-
-
6.022 × 10 23 молекули СН 4, 1,2044 × 10 24 молекули O 2, 6.022 × 10 23 молекули СО 2 і 1,2044 × 10 24 молекули Н 2 О
-
-
2 моль С 2 Н 6 ⇔ 7 моль O 2 ⇔ 4 моль СО 2 ⇔ 6 моль H 2 O
-
-
С 5 Н 12 + 8О 2 → 5СО 2 + 6Н 2 О; 4,4 моль
-
-
20,9 моль
-
-
1,00 моль
-
-
3,44 моль К 2 СО 3; 5,16 моль О 2
5.4: Розрахунки моль-маси та маси
- Яка маса СО 2 утворюється при згорянні 1,00 моль СН 4? СН 4 (г) + 2О 2 (г) → СО 2 (г) + 2Н 2 О ()
-
Яка маса Н 2 О утворюється при згорянні 1,00 моль СН 4?
СН 4 (г) + 2О 2 (г) → СО 2 (г) + 2Н 2 О () -
Яка маса HgO потрібна для отримання 0,692 моль O 2?
2хГо (и) → 2Hg () + О 2 (г) -
Яка маса NaHCO 3 потрібна для отримання 2,659 моль СО 2?
2NaHCO 3 (и) → Na 2 СО 3 (и) + Н 2 О () + СО 2 (г) -
Скільки родимок Al можна виробляти з 10,87 г Ag?
Аль (НІ 3) +3 Аг → Аль + 3Аго 3 -
Скільки родимок HCl можна отримати з 0,226 г SoCl 2?
СоЦл 2 () + Н 2 О () → СО 2 (г) + 2HCl (г) -
Скільки кротів О 2 потрібно для приготування 1,00 г Са (NO 3) 2?
Са (и) + N 2 (г) + 3О 2 (г) → Са (НІ 3) 2 (с) -
Скільки кротів С 2 Н 5 ОН потрібно для генерації 106,7 г Н 2 О?
С 2 Н 5 ОН () + 3О 2 (г) → 2СО 2 (г) + 3Н 2 О () -
Яка маса O 2 може бути утворена при розкладанні 100,0 г NaClO 3?
2NaCl 3 → 2NaCl (и) + 3 О (2 г) -
Яка маса Li 2 O потрібна для реакції з 1,060 г СО 2?
Лі 2 О (ак) + СО 2 (г) → Лі 2 СО 3 (ак) -
На яку масу Fe 2 O 3 необхідно реагувати, щоб генерувати 324 г Al 2 O 3?
Фе 2 О 3 (и) + 2Ал (и) → 2Фе (и) + Аль 2 О 3 (и) -
Яка маса Fe утворюється при реакції 100,0 г Al?
Фе 2 О 3 (и) + 2Ал (и) → 2Фе (и) + Аль 2 О 3 (и) -
Яка маса MnO 2 виробляється при реагуванні 445 г Н 2 О?
Н 2 О () + 2МН 4 − (ак) + Br − (ак) → БРо 3 − (ак) + 2МНО 2 (с) + 2ОН − (aq) -
Яка маса PbSO 4 утворюється при реагуванні 29,6 г H 2 SO 4?
Пб (и) + ПбО 2 (и) + 2Н 2 СО 4 (ак) → 2ПБСО 4 (и) + 2Н 2 О () -
Якщо утворюється 83,9 г ZnO, то яка маса Mn 2 O 3 утворюється з ним?
Зн (и) + 2МН 2 (и) → ZnO (и) + Мн 2 О 3 (и) -
Якщо прореагували 14,7 г NO 2, то яка маса Н 2 О вступає в реакцію з ним?
3NO 2 (г) + Н 2 О () → 2HNO 3 (aq) + НІ (г) -
Якщо реагують 88,4 г СН 2 S, яка маса ВЧ виробляється?
СН 2 С+6Ф 2 → СФ 4 + 2ВЧ + СФ 6
- Якщо потрібно 100,0 г Cl 2, на яку масу NaOCl необхідно реагувати?
Анокл+ HCl → АнОН + Cl 2
Відповіді
- 44,0 г
-
-
3,00 × 10 2 г
-
-
0,0336 моль
-
-
0,0183 моль
-
-
45,1 г
-
-
507 г
-
-
4,30 × 10 3 г
-
-
163 г
-
-
76,7 г
5.5: Врожайність
- У чому різниця між теоретичною прибутковістю і фактичною прибутковістю?
-
Яка різниця між фактичною прибутковістю і відсотковою прибутковістю?
-
Працівник виділяє 2,675 г SiF 4 після реакції 2,339 г SiO 2 з HF. Що таке теоретична прибутковість і фактична прибутковість?
SiO 2 (и) + 4ВЧ (г) → SiF 4 (г) + 2Н 2 О () -
Працівник синтезує аспірин, C 9 H 8 O 4, згідно з цим хімічним рівнянням. Якщо 12,66 г С 7 Н 6 О 3 відреагували і виділяють 12,03 г аспірину, які теоретичний вихід і фактичний вихід?
С 7 Н 6 О 3 + С 4 Н 6 О 3 → С 9 Н 8 О 4 + ХК 2 Н 3 О 2 -
Хімік розкладає 1,006 г NaHCO 3 і отримує 0,0334 г Na 2 CO 3. Що таке теоретична прибутковість і фактична прибутковість?
2NaHCO 3 (и) → Na 2 СО 3 (и) + Н 2 О () + СО 2 (г) -
Хімік спалює 3,009 г зразка С 5 Н 12 і отримує 3,774 г Н 2 О. Які теоретичний вихід і фактичний вихід?
С 5 Н 12 () + 8О 2 (г) → 5СО 2 + 6Н 2 О () -
Який відсоток прибутковості у вправі 3?
-
Який відсоток прибутковості у вправі 4?
-
Який відсоток прибутковості у вправі 5?
- Який відсоток прибутковості у вправі 6?
Відповіді
- Теоретичний вихід - це те, що ви очікуєте стехіометрично від хімічної реакції; фактичний вихід - це те, що ви насправді отримуєте від хімічної реакції.
-
-
теоретичний вихід = 4,052 г; фактичний вихід = 2,675 г
-
-
теоретичний вихід = 0,635 г; фактичний вихід = 0,0334 г
-
-
66,02%
-
-
5,26%
5.6: Обмежувальні реагенти
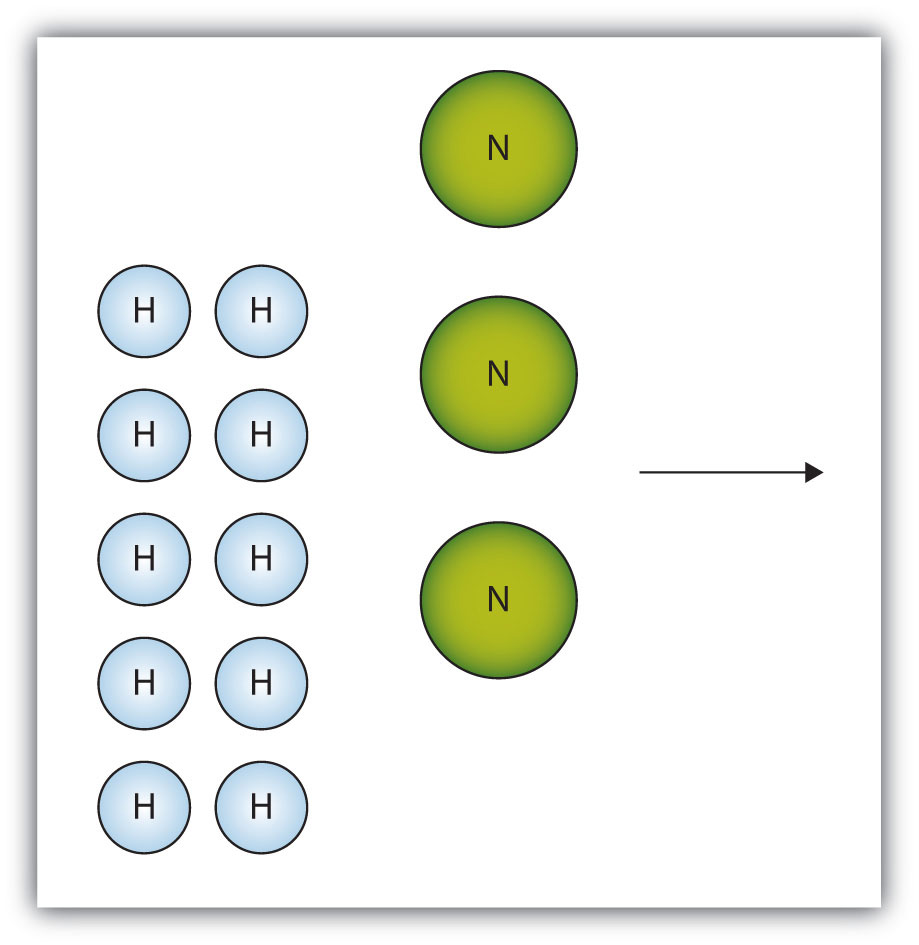
- У полі нижче показана група молекул азоту та водню, які реагуватимуть на отримання аміаку, NH 3. Що таке граничний реагент?
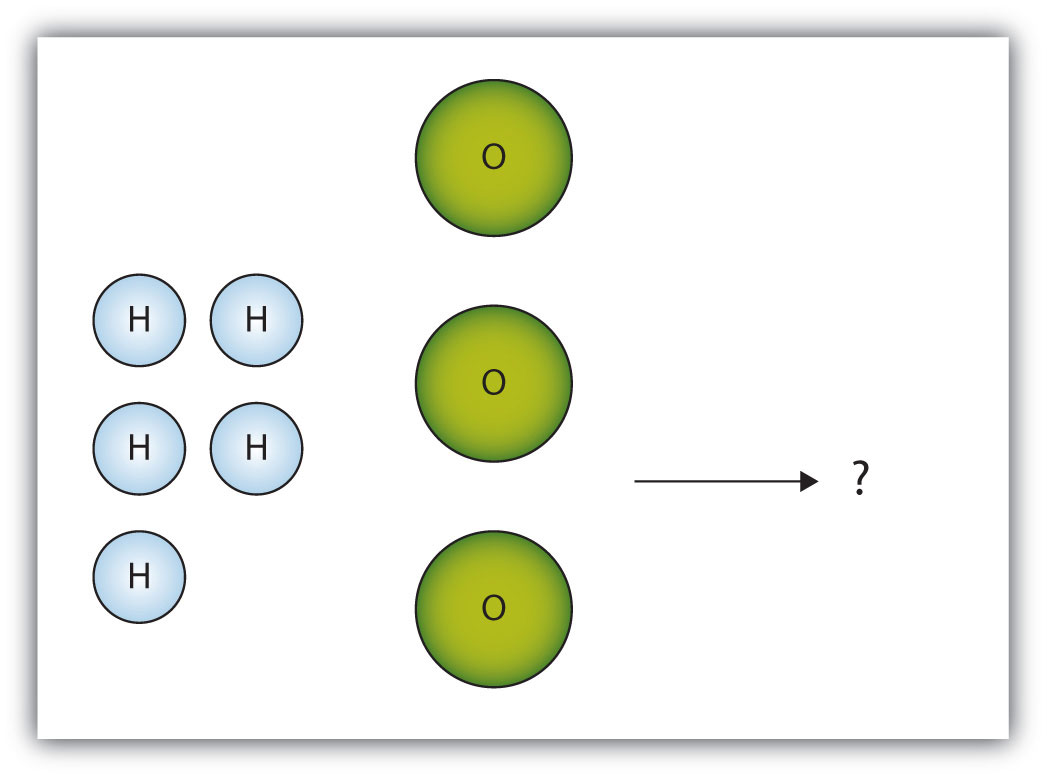
- У коробці нижче показана група молекул водню та кисню, які реагуватимуть на отримання води, H 2 O. Що таке граничний реагент?
- Враховуючи твердження «20,0 г метану спалюється в надлишку кисню», чи очевидно, який реагент є граничним реагентом?
-
Враховуючи твердження «метал нагрівається в присутності надлишку водню», чи очевидно, яка речовина є граничним реагентом, незважаючи на те, що не вказує жодної кількості реагенту?
-
Ацетилен (С 2 Н 2) утворюється при взаємодії 7,08 г С і 4,92 г Н 2.
2С (с) + Н 2 (г) → С 2 Н 2 (г)Що таке граничний реагент? Скільки іншого реагенту в надлишку?
-
Етан (С 2 Н 6) утворюється при взаємодії 7,08 г С і 4,92 г Н 2.
2С (и) + 3Н 2 (г) → С 2 Н 6 (г)Що таке граничний реагент? Скільки іншого реагенту в надлишку?
- Враховуючи початкові перераховані кількості, що таке граничний реагент, і скільки іншого реагенту в надлишку?
\[\underset{35.6\, g}{P_{4}O_{6}(s)}+6\underset{4.77\, g}{H_{2}O(l)}\rightarrow 4H_{3}PO_{4}\]
- Враховуючи початкові перераховані кількості, що таке граничний реагент, і скільки іншого реагенту в надлишку?
\[\underset{377\, g}{3NO_{2}(g)}+\underset{244\, g}{H_{2}O(l)}\rightarrow 2HNO_{3}(aq)+NO(g)\]
- Для утворення осаду PbCl 2 в розчині змішують 2,88 г NaCl і 7,21 г Pb (NO 3) 2. Скільки утворюється осад? Скільки з яких реагентів в надлишку?
- В реакції нейтралізації 18,06 г КОН вступають в реакцію з 13,43 г HNO 3. Яка маса Н 2 О виробляється, і яка маса якого реагенту в надлишку?
Відповіді
- Азот є граничним реагентом.
-
-
Так; метан є обмежуючим реагентом.
-
-
С - граничний реагент; 4,33 г Н 2 залишають.
-
-
Н 2 О є граничним реагентом; 25,9 г Р 4 О 6 залишають над.
-
-
Утворюється 6,06 г PbCl 2; залишається 0,33 г NaCl.
5.7: Додаткові вправи
- Скільки молекул O 2 буде реагувати з 6.022 × 10 23 молекулами Н 2, щоб зробити воду? Реакція становить 2Н 2 (г) + О 2 (г) → 2Н 2 О ().
-
Скільки молекул Н 2 буде реагувати з 6.022 × 10 23 молекулами N 2, щоб зробити аміак? Реакція становить N 2 (г) + 3H 2 (г) → 2NH 3 (г).
-
Скільки родимок присутній в 6,411 кг СО 2? Скільки це молекул?
-
Скільки родимок присутній в 2,998 мг ScL 4? Скільки це молекул?
-
Яка маса в міліграмах 7,22 × 10 20 молекул СО 2?
-
Яка маса в кілограмах 3,408 × 10 25 молекул SiS 2?
-
Яка маса в грамах 1 молекули Н 2 О?
-
Яка маса в грамах 1 атома Al?
-
Який обсяг 3,44 моль Ga, якщо щільність Ga становить 6,08 г/мл?
-
Який обсяг 0,662 моль Він, якщо щільність Він дорівнює 0,1785 г/л?
-
Для хімічної реакції
2С 4 Н 10 (г) +13О 2 (г) → 8СО 2 (г) +10Н 2 О ()припустимо, що 13,4 г С 4 Н 10 повністю реагує на продукти. Щільність СО 2 становить 1,96 г/л Який обсяг в літрах виробляється СО 2?
-
Для хімічної реакції
2ГКЛ (3 с) + 3Н 2 (г) → 2Га () + 6HCl (г)якщо 223 г GacL 3 повністю реагує на продукти і щільність Ga становить 6,08 г/мл, який обсяг в мілілітрах Ga виробляється?
-
Розрахуйте масу кожного продукту, коли 100,0 г CuCl реагують відповідно до реакції
2 Кусл (ак) → КуСл (2 кв) + Куб (и)Що ви помічаєте про суму мас продуктів? Яка концепція ілюструється тут?
-
Розрахуйте масу кожного продукту, коли 500,0 г SnCl 2 реагують відповідно до реакції
2СНЛ (2 ак) → СнКл 4 (ак) + Сн (и)Що ви помічаєте про суму мас продуктів? Яка концепція ілюструється тут?
-
Яка маса СО 2 виробляється при згорянні 1 галона бензину? Хімічну формулу бензину можна наблизити як C 8 H 18. Припустимо, що на галон припадає 2801 г бензину.
-
Яка маса Н 2 О виходить при згорянні 1 галона бензину? Хімічну формулу бензину можна наблизити як C 8 H 18. Припустимо, що на галон припадає 2801 г бензину.
-
Хімічна реакція має теоретичний вихід 19,98 г і відсотковий вихід 88,40%. Яка фактична прибутковість?
-
Хімічна реакція має фактичний вихід 19,98 г і відсотковий вихід 88,40%. Що таке теоретична прибутковість?
- З огляду на початкові перераховані кількості, що є граничним реагентом, і скільки інших реагентів в надлишку?
\[\underset{35.0\, g}{P_{4}}+\underset{12.7\, g}{3NaOH}+\underset{9.33\, g}{3H_{2}O}\rightarrow 2Na_{2}HPO_{4}+PH_{3}\]
- З огляду на початкові перераховані кількості, що є граничним реагентом, і скільки інших реагентів в надлишку?
\[\underset{46.3\, g}{2NaCrO_{2}}+\underset{88.2\, g}{3NaBrO_{4}}+\underset{32.5\, g}{2NaOH}\rightarrow 3NaBrO_{3}+2Na_{2}CrO_{4}+H_{2}O\]
- Переконайтеся, що не має значення, який продукт ви використовуєте для прогнозування граничного реагенту, використовуючи обидва продукти в цій реакції горіння для визначення граничного реагенту та кількості реагенту в надлишку. Наведено початкові кількості кожного реагенту.
\[\underset{26.3\, g}{C_{3}H_{8}}+\underset{21.8\, g}{5O_{2}}\rightarrow 3CO_{2}(g)+4H_{2}O(l)\]
- На всякий випадок, якщо ви підозрюєте, що Вправа 21 сфальсифікована, зробіть це для іншої хімічної реакції і переконайтеся, що не має значення, який продукт ви використовуєте для прогнозування граничного реагенту, використовуючи обидва продукти в цій реакції горіння, щоб визначити граничний реагент і кількість реагенту в надлишку. Наведено початкові кількості кожного реагенту.
\[\underset{35.0\, g}{2P_{4}}+\underset{12.7\, g}{6NaOH}+\underset{9.33\, g}{6H_{2}O}\rightarrow 3Na_{2}HPO_{4}+5PH_{3}\]
Відповіді
- 1,2044 × 10 24 молекули
-
-
145,7 моль; 8,77 × 10 25 молекул
-
-
52,8 мг
-
-
2,99 × 10 −23 г
-
-
39,4 мл
-
-
20.7 Л
-
-
67,91 г CuCl 2; 32.09 г Cu. Дві маси додають до 100,0 г початкової кількості вихідного матеріалу, демонструючи закон збереження речовини.
-
-
8 632 г
-
-
17,66 г
-
-
Граничним реагентом є NaOH; залишилося 21,9 г Р 4 і 3,61 г Н 2 О.
-
-
Обидва продукти прогнозують, що O 2 є граничним реагентом; 20,3 г C 3 H 8 залишаються над.