5.7: Обмежувальні реагенти
- Визначте обмежуючий реагент з набору реагентів.
- Розрахуйте, скільки продукту буде вироблено з граничного реагенту.
- Обчисліть, скільки реагенту (ів) залишається, коли реакція завершена.
На додаток до припущення, що реакції протікають аж до завершення, одне додаткове припущення, яке ми зробили щодо хімічних реакцій, полягає в тому, що всі реагенти присутні в належних кількостях, щоб реагувати на продукти; це не завжди так. На малюнку5.7.2 ми беремо атоми водню та атоми кисню (зліва), щоб зробити молекули води (праворуч). Однак атомів кисню недостатньо, щоб витратити всі атоми водню. У нас закінчуються атоми кисню і більше не можемо створювати молекули води, тому процес зупиняється, коли у нас закінчуються атоми кисню.
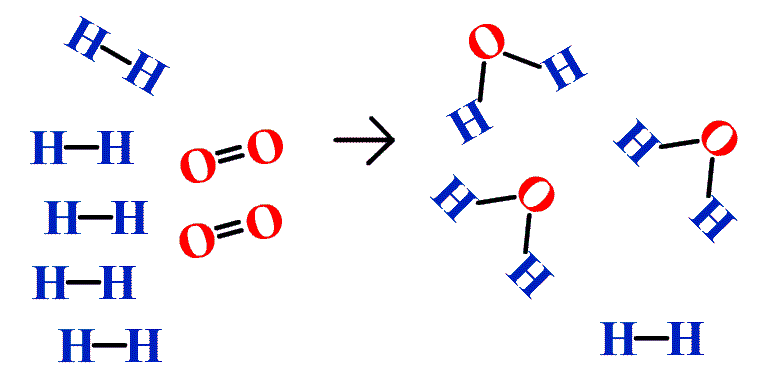
Подібна ситуація існує для багатьох хімічних реакцій: зазвичай у вас закінчується один реагент, перш ніж всі інші реагенти відреагують. Реагент, з якого ви закінчуєте, називається обмежуючим реагентом; інший реагент або реагенти вважаються надлишковими. Найважливішим навиком оцінки умов хімічного процесу є визначення того, який реагент є граничним реагентом, а який в надлишку.
Ключ до визнання того, який реагент є граничним реагентом, базується на розрахунку моль-маси або маси маси: залежно від того, який реагент дає меншу кількість продукту, є граничним реагентом. Що нам потрібно зробити, це визначити кількість одного продукту (або молі, або маси), припускаючи, що всі кожен реагент реагує. Який би реагент не дає найменшу кількість цього конкретного продукту, є граничним реагентом. Не має значення, який продукт ми використовуємо, якщо ми використовуємо один і той же кожен раз. Не має значення, чи ми визначаємо кількість моль або грамів цього продукту; однак незабаром ми побачимо, що знання кінцевої маси продукту може бути корисним.
Наприклад, розглянемо таку реакцію:
4As(s)+3O2(g)→2As2O3(s)
Припустимо, ми починаємо реакцію з 50,0 г As і 50,0 г O 2. Який з них є обмежуючим реагентом? Потрібно виконати два розрахунки моль-маси, кожен з яких припускає, що кожен реагент реагує повністю. Потім порівнюємо кількість виробленого кожним продукту і визначаємо, яке менше.
Розрахунки такі:
50.0gAs×1molAs74.92gAs×2molAs2O34molAs=0.334molAs2O3
50.0gO2×1molO232.00gO2×2molAs2O33molO2=1.04molAs2O3
Порівнюючи ці дві відповіді, зрозуміло, що 0,334 моль As 2 O 3 менше 1,04 моль As 2 O 3, тому миш'як є граничним реагентом. Якщо ця реакція буде проведена в цих початкових умовах, миш'як закінчиться до того, як закінчиться кисень. Ми говоримо, що кисень «в надлишку».
Визначення граничного реагенту, значить, нескладне. Однак зазвичай виникають два пов'язаних питання: (1) яка маса продукту (або продуктів) тоді фактично формується? і (2) яка маса якого реагенту залишилася? На перше питання однозначно відповісти: просто виконайте перетворення від кількості молей утворився продукту в його масу, використовуючи його молярну масу. Для As 2 O 3 молярна маса становить 197,84 г/моль; знаючи, що ми сформуємо 0,334 моль As 2 O 3 за заданих умов, отримаємо
0.334molAs2O3×197.84gAs21molAs2O3=66.1gAs2O3
Друге питання дещо заплутаніше, щоб відповісти. По-перше, ми повинні зробити розрахунок маси маси, що стосується граничного реагенту (тут, As) з іншим реагентом (O 2). Як тільки ми визначимо масу O 2, яка відреагувала, ми віднімаємо її з початкової суми, щоб визначити кількість, що залишилася. Згідно з розрахунком мас-маса,
50.0gAs×1molAs74.92gAs×3molO24molAs×32.00gO21molO2=16.0gO2reacted
Оскільки ми відреагували 16,0 г нашого вихідного O 2, ми віднімаємо це з початкової кількості, 50,0 г, щоб отримати масу O 2, що залишилася:
50,0 г О 2 − 16,0 г О 2 відреагував = 34,0 г О 2 залишилося
Ви повинні пам'ятати, щоб виконати це остаточне віднімання, щоб визначити суму, що залишилася; поширеною помилкою є повідомлення про 16,0 г як суму, що залишилася.
Кількість 5,00 г Rb поєднується з 3,44 г MgCl 2 відповідно до цієї хімічної реакції:
2Rb(s)+MgCl2(s)→Mg(s)+2RbCl(s)
Яка маса Mg утворюється, і яка маса якого реагенту залишилася?
Рішення
Оскільки питання задається питанням, яка маса магнію утворюється, ми можемо виконати два розрахунки мас-маса і визначити, яка кількість менше.
5.00gRb×1molRb85.47gRb×1molMg2molRb×24.31gMg1molMg=0.711gMg
3.44gMgCl2×1molMgCl295.21gMgCl2×1molMg1molMgCl2×24.31gMg1molMg=0.878gMg
0,711 г Mg є меншою кількістю, тому асоційований реагент - 5,00 г RB - є граничним реагентом. Щоб визначити, скільки залишилося іншого реагенту, ми повинні зробити ще один розрахунок маси маси, щоб визначити, яка маса MgCl2 вступила в реакцію з 5,00 г Rb, а потім відняти кількість, що відреагувала від початкової кількості.
5.00gRb×1molRb85.47gRb×1molMgCl22molRb×95.21gMg1molMgCl2=2.78gMgCl2reacted
Тому що ми почали з 3,44 г MgCl2, ми маємо
3,44 г MgCl2 − 2,78 г MgCl2 відреагували = 0,66 г MgCl2 ліворуч
З огляду на перераховані початкові кількості, що таке граничний реагент, і яка маса залишкового реагенту?
22.7g⏟MgO(s)+17.9g⏟H2S→MgS(s)+H2O(l)
- Відповідь
- Н 2 S є граничним реагентом; 1,5 г MgO залишаються.
Резюме
Граничним реагентом є реагент, який виробляє найменшу кількість продукту. Масово-масові розрахунки дозволяють визначити, скільки виробляється продукту і скільки залишилося інших реагентів.
