25.1: Переварювання білків
- Перерахуйте етапи перетравлення білка.
Розщеплення білка починається в шлунку (рис.25.1.1), де під дією шлункового соку гідролізується близько 10% пептидних зв'язків. Шлунковий сік являє собою суміш води (більше 99%), неорганічних іонів, соляної кислоти, різних ферментів та інших білків.
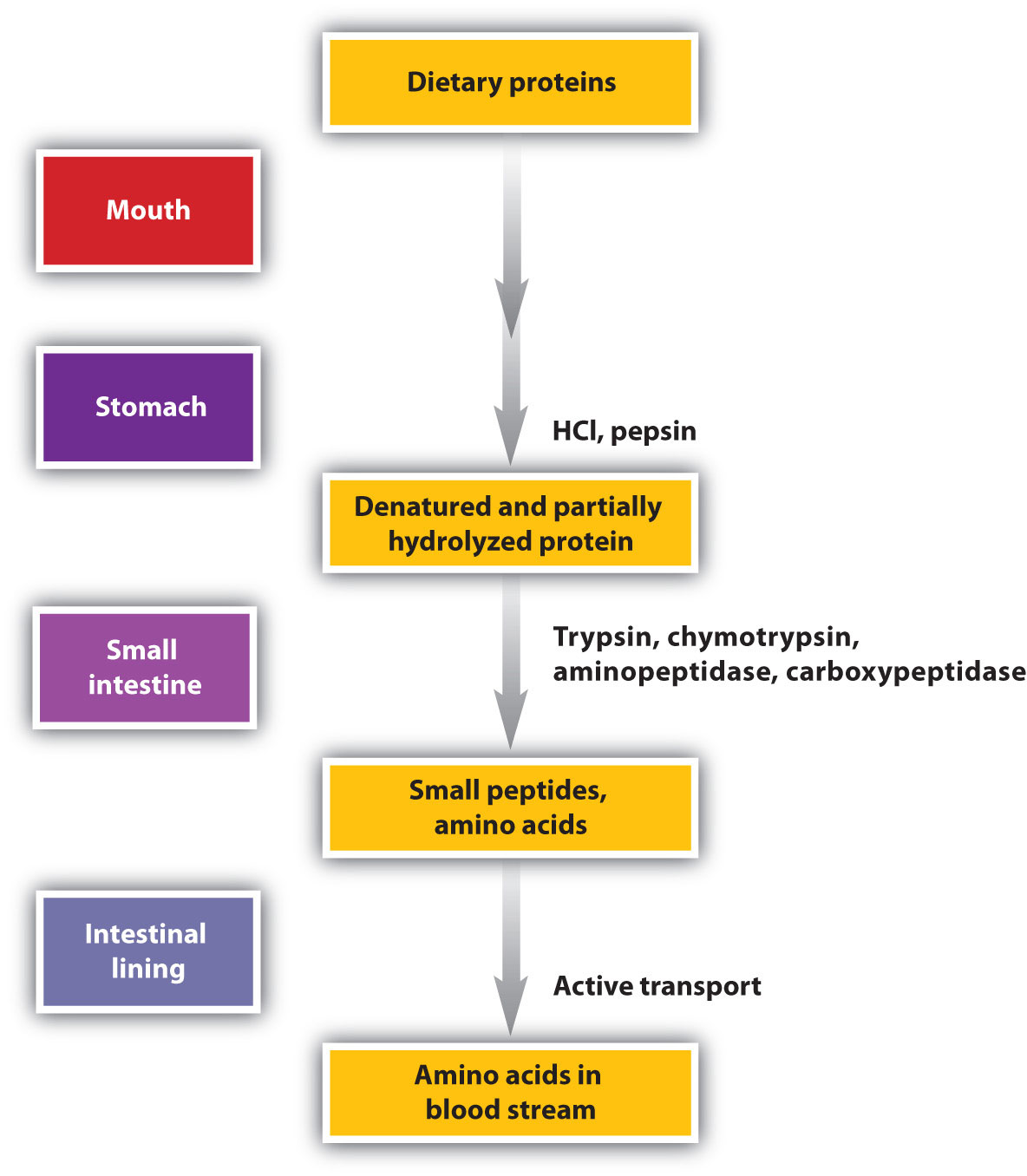
Соляна кислота (HCl) в шлунковому соку секретується залозами в слизовій оболонці шлунка. РН свіжосекретованого шлункового соку становить близько 1,0, але вміст шлунка може підняти рН до 1,5 і 2,5. HCl допомагає денатурувати харчові білки; тобто він розгортає молекули білка, щоб піддавати їх ланцюги більш ефективній дії ферментів. Основним травним компонентом шлункового соку є пепсиноген, неактивний фермент, що виробляється в клітині, розташованих в стінці шлунка. Коли їжа потрапляє в шлунок після періоду голодування, пепсиноген перетворюється в його активну форму - пепсин - в ряд етапів, ініційованих падінням рН. Пепсин каталізує гідроліз пептидних зв'язків всередині білкових молекул. Він має досить широку специфіку, але діє переважно на зв'язки за участю ароматичних амінокислот триптофан, тирозин та фенілаланін, а також метіонін та лейцин.
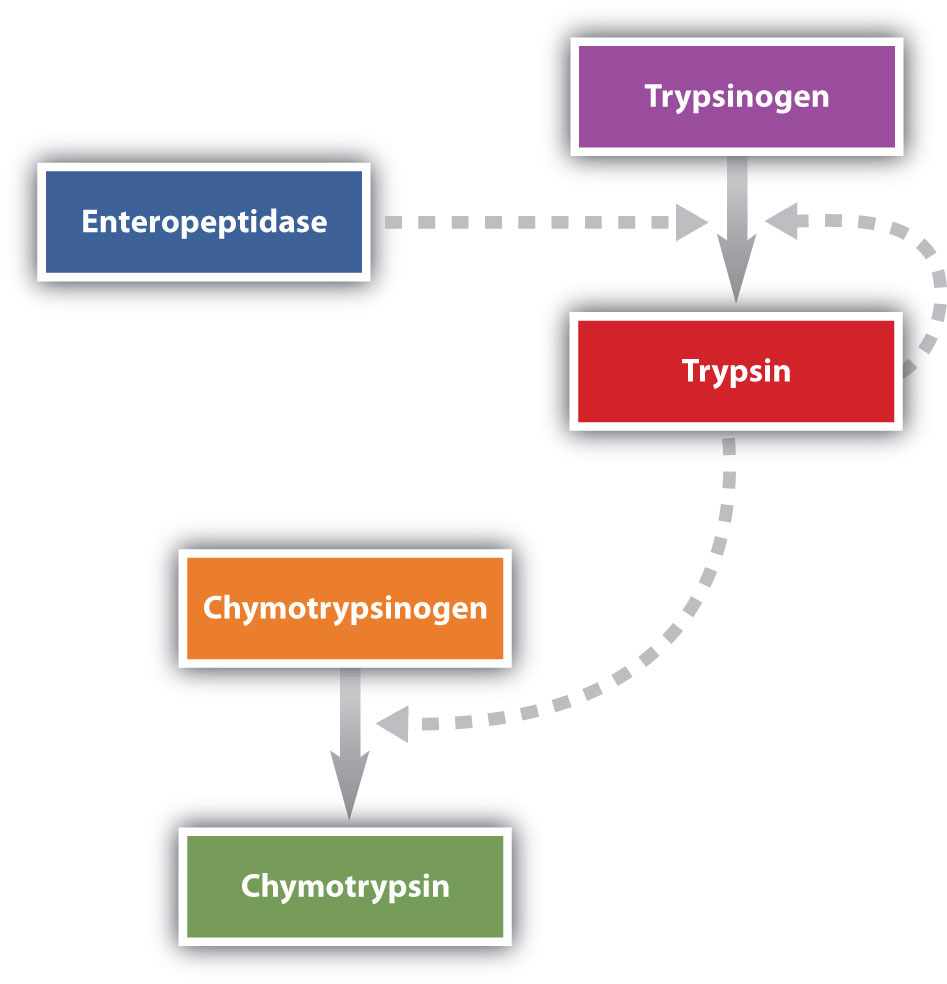
Перетравлення білка завершується в тонкому кишечнику. Панкреатичний сік, що переноситься з підшлункової залози через протоку підшлункової залози, містить неактивні ферменти, такі як трипсиноген і хімотрипсиноген. Вони активуються в тонкому кишечнику наступним чином (рис.25.1.2): Клітини слизової оболонки кишечника виділяють протеолітичний фермент ентеропептидазу, який перетворює трипсиноген в трипсин; трипсин потім активує хімотрипсиноген до хімотрипсину (а також завершує активацію трипсиногена). Обидва ці активні ферменти каталізують гідроліз пептидних зв'язків в білкових ланцюгах. Хімотрипсин переважно атакує пептидні зв'язки за участю карбоксильних груп ароматичних амінокислот (фенілаланін, триптофан та тирозин). Трипсин атакує пептидні зв'язки за участю карбоксильних груп основних амінокислот (лізин і аргінін). Панкреатичний сік також містить прокарбоксипептидазу, яка розщеплюється трипсином до карбоксипептидази. Останній являє собою фермент, який каталізує гідроліз пептидних зв'язків на вільному карбоксильному кінці пептидного ланцюга, в результаті чого відбувається поступове звільнення вільних амінокислот з карбоксильного кінця поліпептиду.
Амінопептидази в кишковому соку видаляють амінокислоти з N-кінцевого кінця пептидів і білків, що володіють вільною аміногрупою. Малюнок25.1.3 ілюструє специфічність цих білково-перетравлюючих ферментів. Амінокислоти, які виділяються при перетравленні білка, всмоктуються через стінку кишечника в кровоносну систему, де їх можна використовувати для синтезу білка.
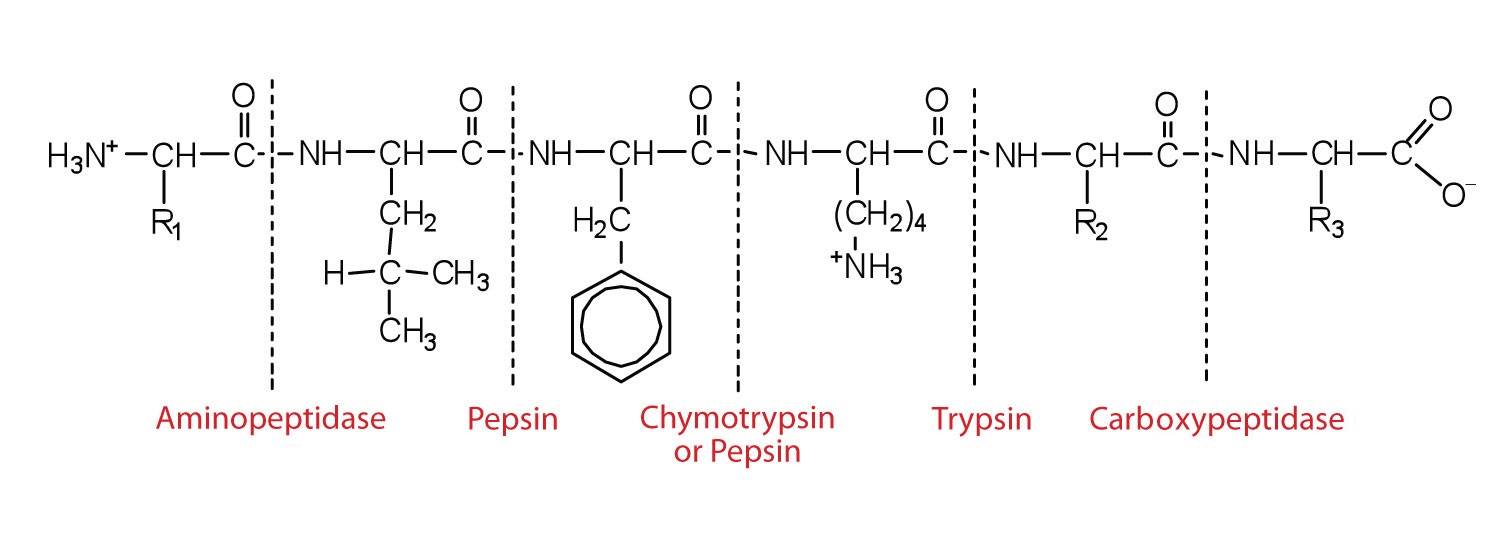
Ця діаграма ілюструє, де в пептиді різні пептидази, про які ми обговорювали, каталізують гідроліз пептидних зв'язків.