19.4: Як працюють ферменти
- Page ID
- 22091
- Описати взаємодію між ферментом і його субстратом.
Ферментно-каталізовані реакції відбуваються не менше ніж в два етапи. На першому етапі фермент (Е) і молекула субстрату або молекули (S) стикаються і реагують, утворюючи проміжну сполуку, звану комплексом фермент-субстрат (ES). (Цей крок є оборотним, оскільки комплекс може розпастися на вихідний субстрат або субстрати та вільний фермент.) Після того, як комплекс ЕС утворюється, фермент здатний каталізувати утворення продукту (Р), який потім вивільняється з ферментної поверхні:
\[E + S \leftrightarrow ES \tag{\(\PageIndex{1}\)} \]
\[ES \rightarrow E + P \tag{\(\PageIndex{2}\)} \]
Водневий зв'язок та інші електростатичні взаємодії утримують фермент і субстрат разом у комплексі. Структурні особливості або функціональні групи на ферменті, які беруть участь в цих взаємодіях, розташовуються в ущелині або кишені на поверхні ферменту. Цей кишеню, де фермент з'єднується з субстратом і перетворює субстрат в продукт, називається активним місцем ферменту (рис.\(\PageIndex{1}\)).
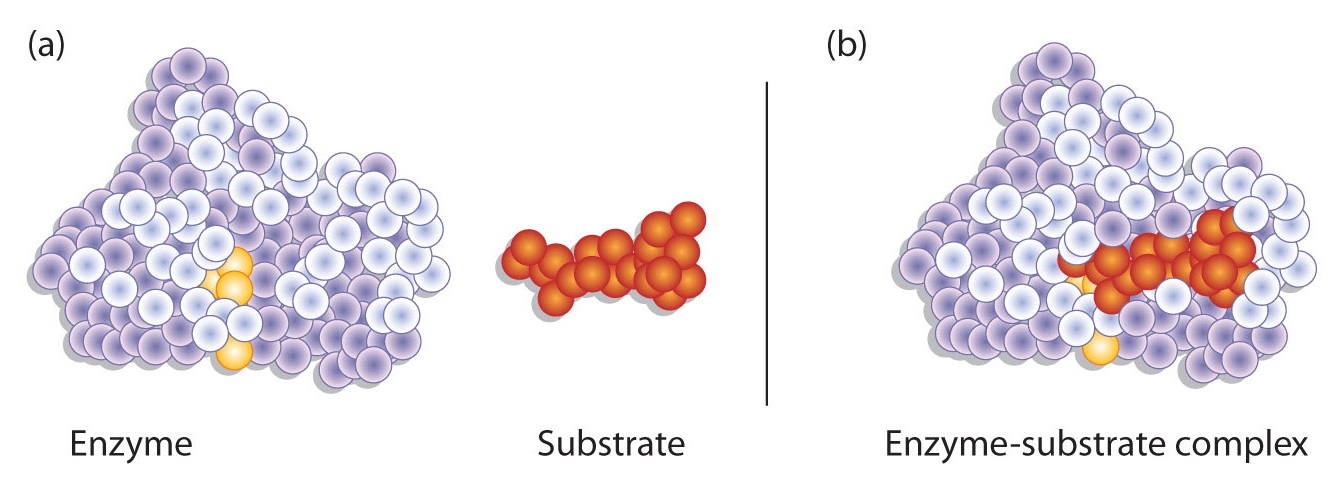
Моделі взаємодії ензим-субстрат
Активний сайт ферменту має унікальну конформацію (включаючи правильно розташовані групи зв'язку), яка доповнює структуру субстрату, так що молекули ферменту та субстрату поєднуються приблизно так само, як ключ вписується в тумблер замок. Фактично ранню модель, що описує утворення ферментно-субстратного комплексу, отримала назву замково-ключової моделі (рис.\(\PageIndex{2}\)). Ця модель зображувала фермент як конформаційно жорсткий і здатний зв'язуватися тільки з субстратами, які точно відповідають активній ділянці.
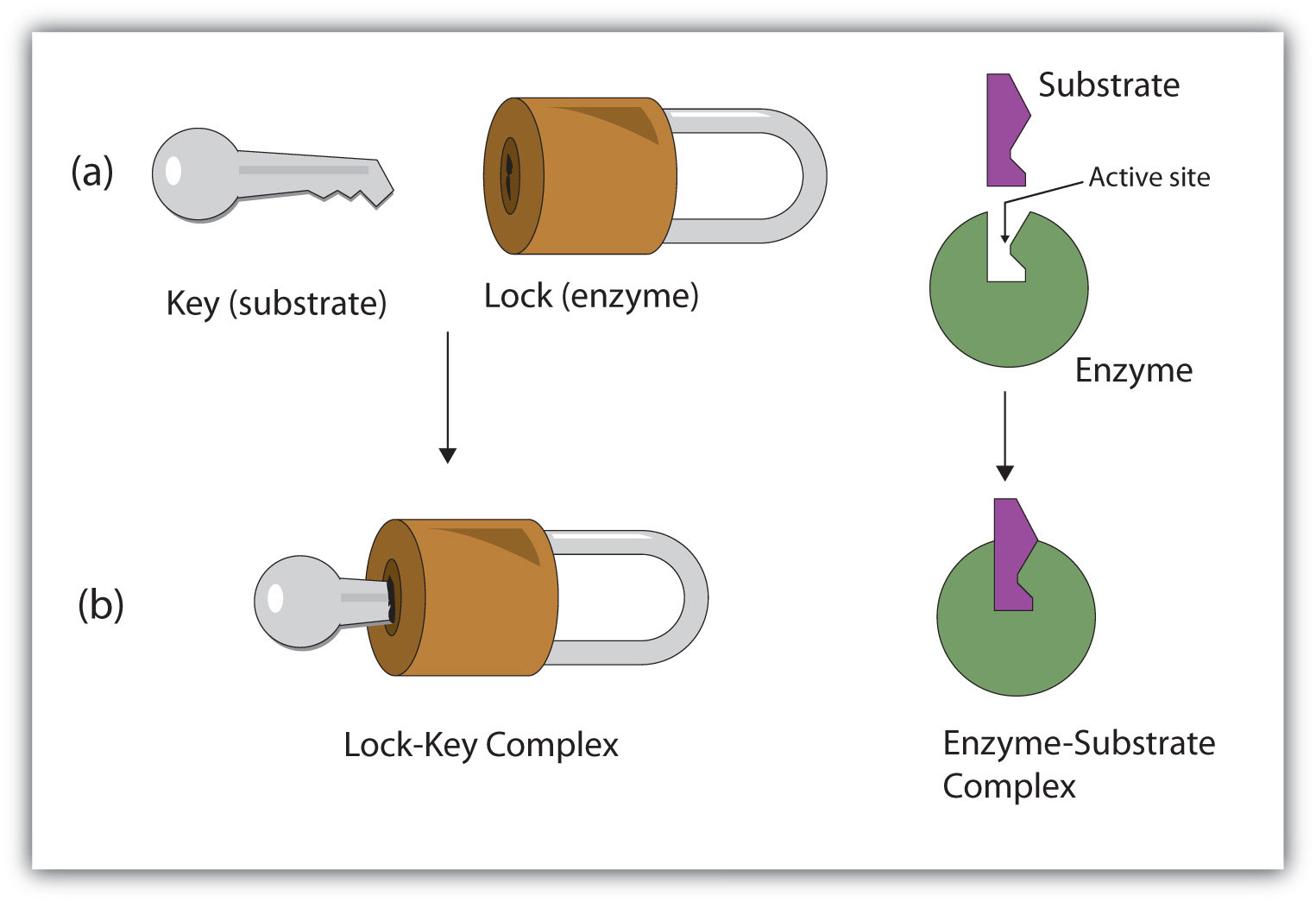
Розробка точних тривимірних структур численних ферментів дозволила хімікам вдосконалити оригінальну замкову модель дії ферментів. Вони виявили, що зв'язування субстрату часто призводить до великої конформаційної зміни ферменту, а також до змін структури субстрату або субстратів. Сучасна теорія, відома як модель індукованої посадки, говорить, що ферменти можуть зазнати зміни конформації, коли вони зв'язують молекули субстрату, а активний сайт має форму, що доповнює форму субстрату лише після того, як субстрат пов'язаний, як показано для гексокінази на малюнку \(\PageIndex{3}\). Після каталізу фермент відновлює свою первісну структуру.
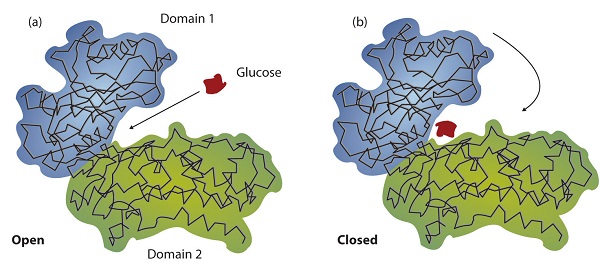
Структурні зміни, що відбуваються, коли фермент і субстрат з'єднуються разом, приводять конкретні частини субстрату у відповідність з конкретними частинами активної ділянки ферменту. Амінокислотні бічні ланцюги в місці зв'язування або поблизу нього можуть потім виступати в якості кислотних або базових каталізаторів, забезпечувати місця зв'язування для перенесення функціональних груп з одного субстрату на інший або допомагати в перестановці субстрату. Учасники амінокислоти, які зазвичай широко розділені в первинній послідовності білка, зводяться впритул в активній ділянці в результаті згортання і згинання поліпептидного ланцюга або ланцюгів, коли білок набуває свою третинну і четвертинну структуру. Зв'язування з ферментами наближає реагенти один до одного і вирівнює їх належним чином, що надає такий же ефект, як і збільшення концентрації реагуючих сполук.
- Який тип взаємодії відбуватиметься між групою OH, присутньою на молекулі субстрату, та функціональною групою в активній ділянці ферменту?
- Запропонуйте амінокислоту, бічний ланцюг якої може бути в активному місці ферменту і сформувати тип взаємодії, який ви щойно визначили.
Рішення
- Група OH, швидше за все, буде займатися водневим зв'язком з відповідною функціональною групою, присутньою в активному місці ферменту.
- Кілька бічних ланцюгів амінокислот зможуть брати участь у водневому зв'язку з групою OH. Одним із прикладів може бути аспарагін, який має амідну функціональну групу.
- Який тип взаємодії відбуватиметься між COO − групою, присутньою на молекулі субстрату, та функціональною групою в активній ділянці ферменту?
- Запропонуйте амінокислоту, бічний ланцюг якої може бути в активному місці ферменту і сформувати тип взаємодії, який ви щойно визначили.
Однією з характеристик, що відрізняє фермент від всіх інших видів каталізаторів, є його субстратна специфічність. Неорганічна кислота, така як сірчана кислота, може бути використана для підвищення швидкості реакції багатьох різних реакцій, таких як гідроліз дисахаридів, полісахаридів, ліпідів та білків, з повною неупередженістю. На відміну від цього, ферменти набагато більш специфічні. Деякі ферменти діють на єдиний субстрат, в той час як інші ферменти діють на будь-яку з групи споріднених молекул, що містять аналогічну функціональну групу або хімічний зв'язок. Деякі ферменти навіть розрізняють D- і L-стереоізомери, зв'язуючи один стереоізомер, але не інший. Наприклад, уреаза - це фермент, який каталізує гідроліз одного субстрату - сечовини - але не тісно пов'язаних сполук метилсечовини, тіосечовини або біурету. З іншого боку, фермент карбоксипептидаза набагато менш специфічний. Він каталізує видалення майже будь-якої амінокислоти з карбоксильного кінця будь-якого пептиду або білка.
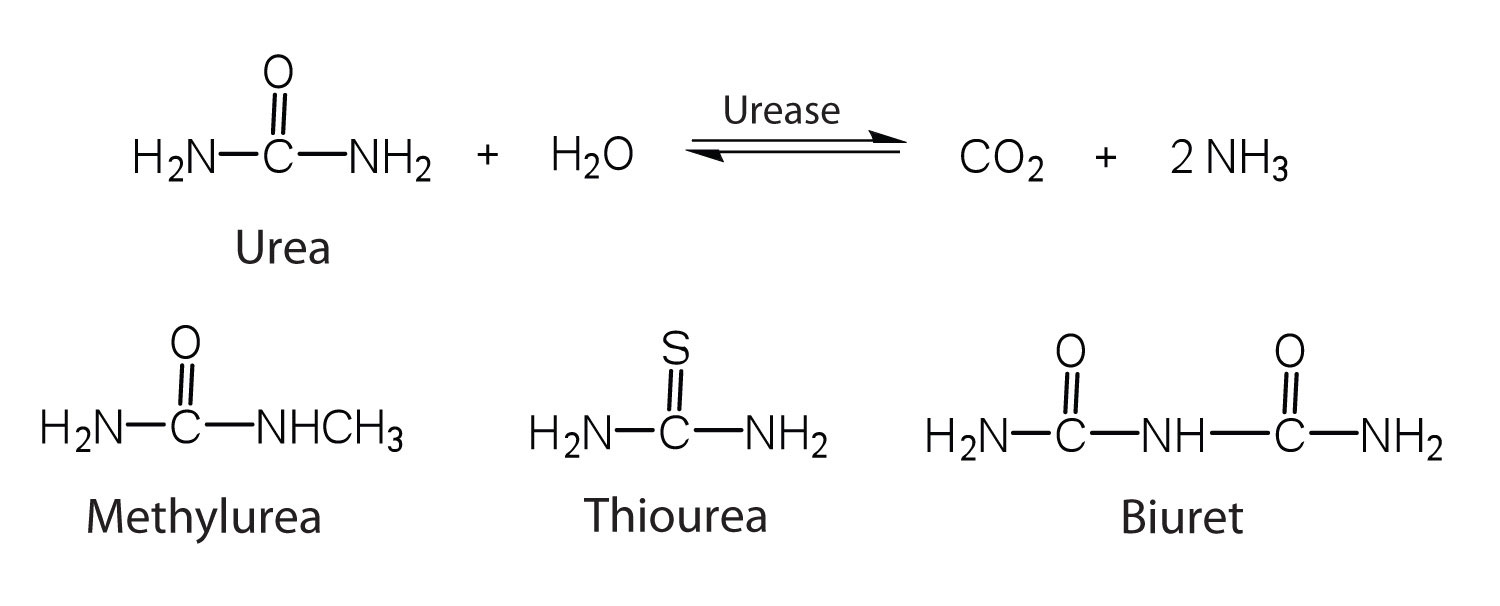
Ферментна специфічність обумовлена унікальністю активної ділянки в кожному окремому ферменті через ідентичність, заряд та просторову орієнтацію розташованих там функціональних груп. Він регулює хімію клітин, щоб належні реакції відбувалися в належному місці в належний час. Зрозуміло, що він має вирішальне значення для правильного функціонування живої клітини.
Резюме
Субстрат зв'язується з певною областю на ферменті, відомому як активний сайт, де субстрат може бути перетворений у продукт. Субстрат зв'язується з ферментом насамперед за допомогою водневого зв'язку та інших електростатичних взаємодій. Модель індукованої посадки говорить про те, що фермент може зазнати конформаційних змін при зв'язуванні субстрату. Ферменти проявляють різний ступінь специфічності субстрату.