19.3: Класифікація ферментів
- Завдання 1
- Завдання 2
Сотні ферментів були очищені і вивчені, намагаючись зрозуміти, як вони працюють так ефективно і з такою специфічністю. Отримані знання були використані для розробки препаратів, які інгібують або активують певні ферменти. Прикладом можуть служити інтенсивні дослідження для поліпшення лікування або пошуку ліків від синдрому набутого імунодефіциту (СНІД). СНІД викликається вірусом імунодефіциту людини (ВІЛ). Дослідники вивчають ферменти, що виробляються цим вірусом, і розробляють препарати, призначені для блокування дії цих ферментів, не втручаючись у ферменти, що виробляються організмом людини. Деякі з цих препаратів зараз схвалені для використання хворими на СНІД.
Ферментна номенклатура
Більшість ферментів можна розпізнати, оскільки вони мають закінчення прізвища — ase. Однак перші ферменти, які слід відкрити, були названі відповідно до їх джерела або методу відкриття. Фермент пепсин, який допомагає в гідролізі білків, міститься в травних соках шлунка (грец. Pepsis, що означає «травлення»). Папаїн, ще один фермент, який гідролізує білок (насправді він використовується в м'ясних тендерайзерах), виділяється з папайї.
Крім прізвища, більш систематичні назви ферментів дадуть два специфічні фрагменти інформації: перша частина - субстрат, на який діє фермент, а друга частина - тип реакції, яку він каталізує. Наприклад, спиртово-дегідрогеназа (рис.19.3.1) каталізує окислення спирту до альдегіду.
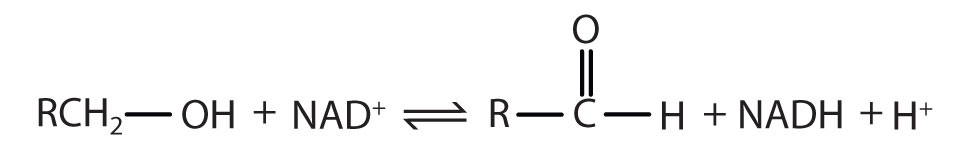
Класифікація ферментів
У міру виявлення більшої кількості ферментів хіміки визнали необхідність більш систематичної і хімічно інформативної схеми ідентифікації. У поточній схемі нумерації та найменування під наглядом Комісії з номенклатури Міжнародного союзу біохімії ферменти розташовані на шість груп відповідно до загального типу реакції, яку вони каталізують (табл.19.3.1), з підгрупами та вторинними підгрупами, які уточніть реакцію точніше.
Кожному ферменту присвоюється чотиризначне число, якому передує префікс EC - для класифікації ферментів - що вказує на його групу, підгрупу тощо. Це продемонстровано в табл19.3.2 для спиртодегідрогенази.
| Основний клас | Тип реакції, що каталізується | Підкласи | Приклади |
|---|---|---|---|
| Оксидоредуктази | окислювально-відновні реакції |
Дегідрогенази каталізують окислювально-відновні реакції за участю водню. |
Спиртодегідрогеназа |
| Оксидази каталізують окислення шляхом додавання O 2 до субстрату. | |||
| Редуктази каталізують реакції, при яких субстрат відновлюється. | |||
| трансферази | реакції перенесення функціональних груп | Трансамінази каталізують перенесення аміногрупи. | |
| Кінази каталізують перенесення фосфатної групи. | Фосфофруктокіназа | ||
| Гідролази | реакції, які використовують воду для розриву хімічного зв'язку | Ліпази каталізують гідроліз ліпідів | |
| Протеази каталізують гідроліз білків | |||
| Амілази каталізують гідроліз вуглеводів | |||
| Нуклеази каталізують гідроліз ДНК і РНК | |||
| ліази | реакції, при яких функціональні групи додаються або видаляються без гідролізу | Декарбоксилази каталізують видалення карбоксильних груп. | |
| Деамінази каталізують видалення аміногруп. | |||
| Дегідратази каталізують видалення води. | |||
| Гідратази каталізують додавання води. | Фумараза | ||
| Ізомерази | реакції, в яких з'єднання перетворюється в його ізомер | Ізомерази можуть каталізувати перетворення альдози в кетозу. | Триоза фосфат ізомерази |
| Мутази каталізують реакції, при яких функціональна група переноситься від одного атома в субстраті до іншого. | |||
| Лігази | реакції, при яких між вуглецем і іншим атомом утворюються нові зв'язки; потрібна енергія | Синтетази каталізують реакції, в яких дві менші молекули пов'язані, утворюючи більшу. | |
| Карбоксилази каталізують додавання СО 2 за допомогою АТФ | Піруваткарбоксилаза |
| Алкогольдегідрогеназа: EC 1.1.1.1 | |
|---|---|
| Перша цифра вказує на те, що цей фермент є окисно-редукційною тазою; тобто ферментом, який каталізує окислювально-відновну реакцію. | |
| Друга цифра вказує на те, що ця оксидоредуктаза каталізує реакцію за участю первинного або вторинного спирту. | |
| Третя цифра вказує на те, що для цієї реакції необхідний або коензим NAD +, або НАДФ +. | |
| Четверта цифра вказує на те, що це був перший фермент, виділений, охарактеризований і названий за допомогою цієї системи номенклатури. | |
| Систематична назва цього ферменту - спирт:NAD + оксидоредуктаза, тоді як рекомендована або загальна назва - алкогольдегідрогеназа. | |
|
Реакція каталізується: |
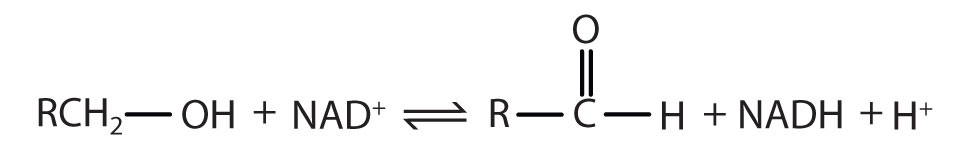 |
Рисунок19.3.1: Структура білка алкогольдегідрогенази (E.C.1.1.1.1) (EE ISOZYME) в комплексі з нікотинамідом аденіні-динульцеотидом (NAD) та цинком (PDB: 1CDO).
Резюме
Фермент - це біологічний каталізатор, речовина, яка збільшує швидкість хімічної реакції без зміни або споживання в реакції. Систематичний процес використовується для назви і класифікації ферментів.