19.5: Фактори, що впливають на активність ферментів
- Page ID
- 22104
- Описати, як pH, температура і концентрація ферменту і його субстрату впливають на активність ферменту.
Єдиним найважливішим властивістю ферментів є здатність збільшувати швидкості реакцій, що відбуваються в живих організмах, властивість, відоме як каталітична активність. Оскільки більшість ферментів - це білки, на їх активність впливають фактори, що порушують структуру білка, а також фактори, що впливають на каталізатори в цілому. Фактори, що порушують структуру білка, включають температуру та рН; фактори, що впливають на каталізатори загалом, включають концентрацію реагенту або субстрату та концентрацію каталізатора або ферменту. Активність ферменту можна виміряти, контролюючи або швидкість, з якою субстрат зникає, або швидкість, з якою формується продукт.
Концентрація субстрату
При наявності заданої кількості ферменту швидкість ферментативної реакції збільшується в міру збільшення концентрації субстрату до досягнення граничної швидкості, після чого подальше збільшення концентрації субстрату не призводить до істотної зміни швидкості реакції (частина (а) рис.\(\PageIndex{1}\)). У цей момент присутня стільки субстрату, що по суті всі активні ділянки ферменту мають субстрат, пов'язаний з ними. Іншими словами, молекули ферменту насичені субстратом. Надлишкові молекули субстрату не можуть реагувати до тих пір, поки субстрат, вже пов'язаний з ферментами, не відреагував і не вивільнився (або не був звільнений без реакції).
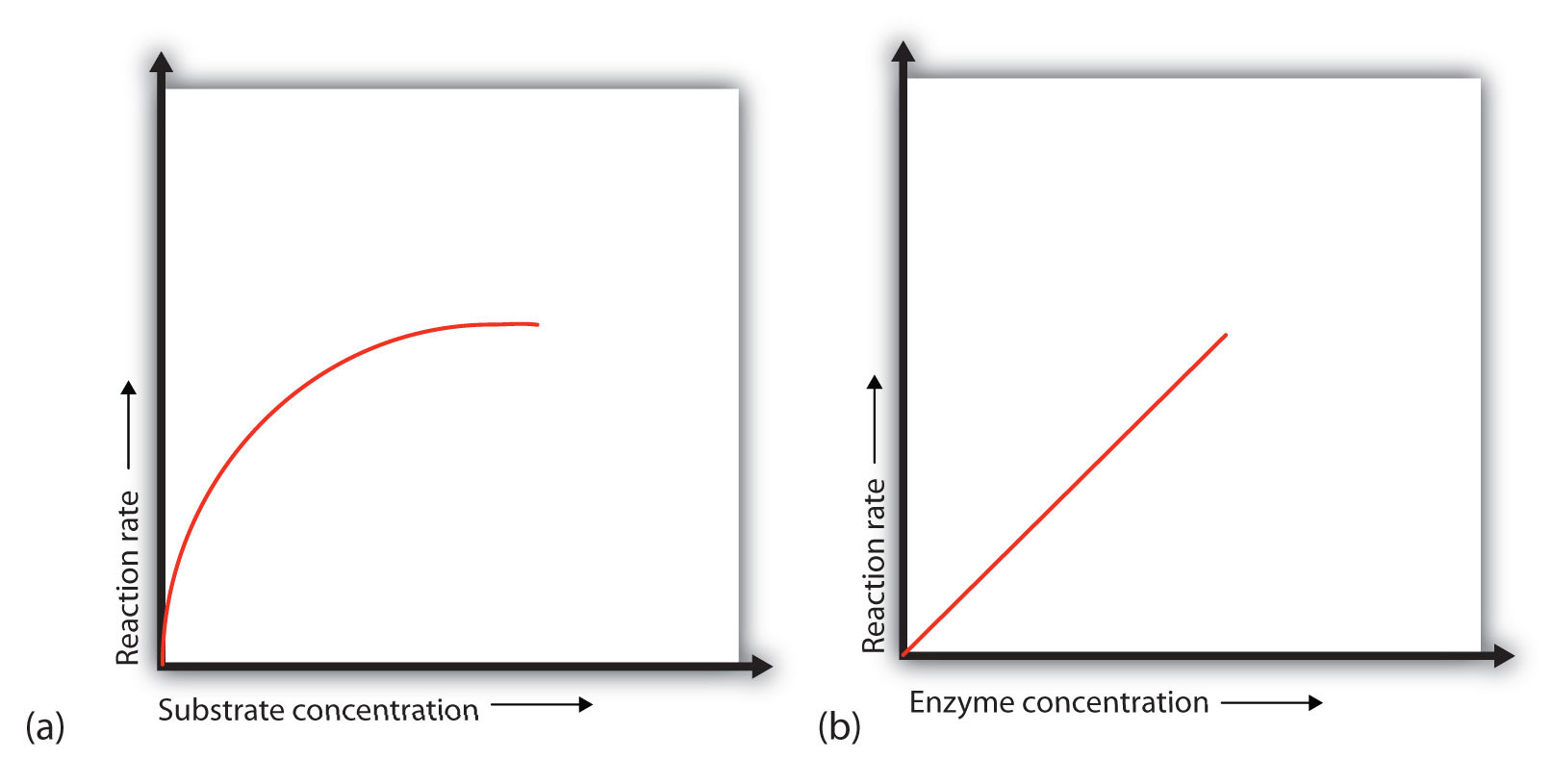
Розглянемо аналогію. Десять таксі (молекули ферментів) чекають на стоянці таксі, щоб доставити людей (субстрат) на 10-хвилинну поїздку до концертного залу, по одному пасажиру за раз. Якщо на стенді присутні всього 5 осіб, швидкість їх прибуття в концертний зал становить 5 осіб за 10 хвилин. Якщо кількість осіб на стенді збільшити до 10, ставка збільшується до 10 заїздів за 10 хвилин. З 20 людьми на стенді ставка все одно становила б 10 заїздів за 10 хвилин. Таксі були «насиченими». Якби таксі могли перевозити по 2 або 3 пасажирів кожен, застосовувався би той же принцип. Ставка була б просто вищою (20 або 30 осіб за 10 хвилин), перш ніж вона вирівнялася.
Концентрація ферментів
Коли концентрація ферменту значно нижче концентрації субстрату (так як при кількості таксі набагато нижче числа очікуючих пасажирів) швидкість ферментативно-каталізованої реакції безпосередньо залежить від концентрації ферменту (частина (б) рис.\(\PageIndex{1}\)). Це справедливо для будь-якого каталізатора; швидкість реакції збільшується в міру збільшення концентрації каталізатора.
Вплив температури на активність
Загальним правилом для більшості хімічних реакцій є те, що підвищення температури на 10° C приблизно подвоює швидкість реакції. В якійсь мірі це правило дотримується для всіх ферментативних реакцій. Після певного моменту, однак, підвищення температури викликає зниження швидкості реакції ферменту, внаслідок денатурації структури білка і порушення активної ділянки (частина (а) рис.\(\PageIndex{2}\)). Для багатьох білків денатурація відбувається між 45° C і 55° C. крім того, незважаючи на те, що фермент може мати максимальну швидкість реакції між 40° C і 50° C, більшість біохімічних реакцій проводяться при більш низьких температурах, оскільки ферменти не стабільні при цих більш високих температурах і денатурують після кілька хвилин.
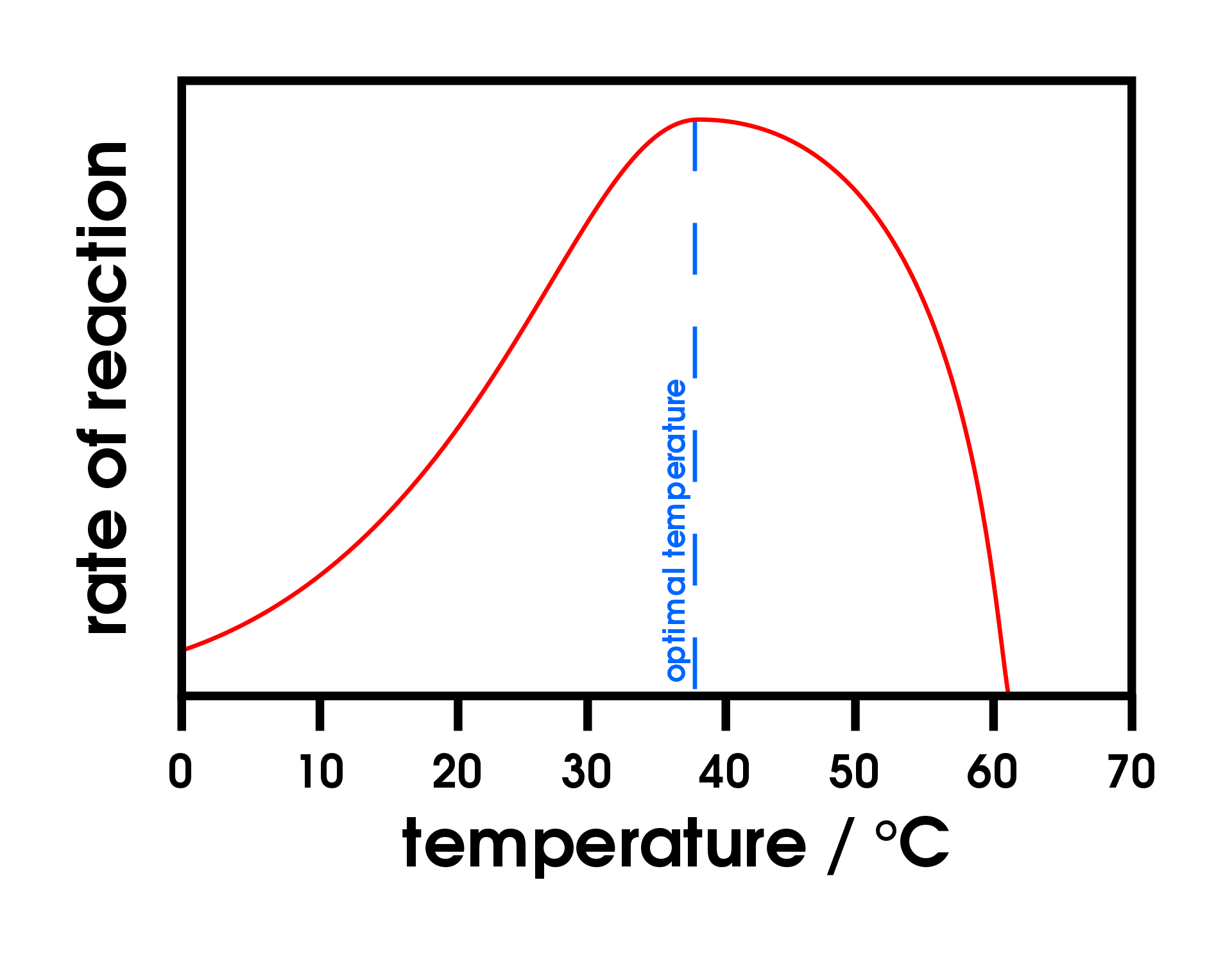
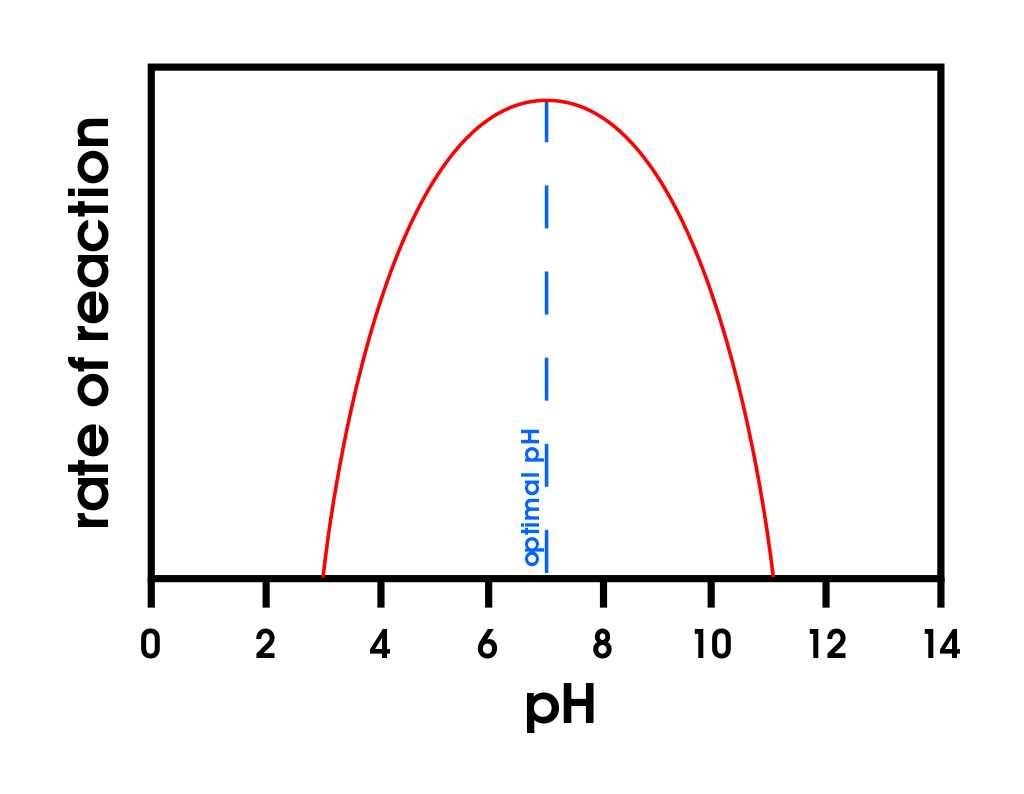
Малюнок\(\PageIndex{2}\): Температура і рН проти концентрації. (а) Цей графік відображає вплив температури на швидкість реакції, яка каталізується фіксованою кількістю ферменту. (б) Цей графік зображує вплив рН на швидкість реакції, яка каталізується фіксованою кількістю ферменту.
При 0° C і 100° C швидкість реакцій, каталізованих ферментами, майже дорівнює нулю. Цей факт має кілька практичних застосувань. Ми стерилізуємо предмети, поміщаючи їх у киплячу воду, яка денатурує ферменти будь-яких бактерій, які можуть перебувати в них або на них. Ми зберігаємо нашу їжу, охолоджуючи або заморожуючи її, що уповільнює активність ферментів. Коли тварини взимку впадають в сплячку, температура їх тіла падає, знижуючи темпи обмінних процесів до рівнів, які можуть підтримуватися кількістю енергії, що зберігається в жирових запасах тканин тварин.
Вплив концентрації іонів водню (рН) на активність
Оскільки більшість ферментів є білками, вони чутливі до змін концентрації іонів водню або рН. Ферменти можуть бути денатуровані екстремальними рівнями іонів водню (високий або низький); будь-яка зміна рН, навіть невелика, змінює ступінь іонізації кислотних і основних бічних груп ферменту та компонентів субстрату, а також. Іонізуючі бічні групи, розташовані в активній ділянці, повинні мати певний заряд для того, щоб фермент зв'язував свій субстрат. Нейтралізація навіть одного з цих зарядів змінює каталітичну активність ферменту.
Фермент проявляє максимальну активність у вузькому діапазоні рН, в якому молекула існує у належним чином зарядженій формі. Медіана значення цього діапазону pH називається оптимальним рН ферменту (частина (b) рис\(\PageIndex{2}\)). За помітним винятком шлункового соку (рідини, що виділяються в шлунку), більшість рідин організму мають значення рН між 6 і 8. Не дивно, що більшість ферментів проявляють оптимальну активність в цьому діапазоні рН. Однак кілька ферментів мають оптимальні значення рН поза цим діапазоном. Наприклад, оптимальний рН для пепсину, ферменту, який активний в шлунку, становить 2,0.
Резюме
Спочатку збільшення концентрації субстрату призводить до збільшення швидкості ферментативно-каталізованої реакції. Оскільки молекули ферменту насичуються субстратом, це збільшення рівня швидкості реакції вимкнено. Швидкість ферментативно-каталізованої реакції збільшується зі збільшенням концентрації ферменту. При низьких температурах підвищення температури збільшує швидкість ферментативно-каталізованої реакції. При більш високих температурах білок денатурируется, і швидкість реакції різко знижується. Фермент має оптимальний діапазон рН, в якому він проявляє максимальну активність.
Концепція Огляд Вправи
- Концентрація субстрату X низька. Що відбувається зі швидкістю ферментативно-каталізованої реакції, якщо концентрація Х подвоюється?
- Який вплив робить підвищення концентрації ферменту на швидкість ферментативно-каталізованої реакції?
Відповіді
- Якщо концентрація субстрату низька, збільшення його концентрації збільшить швидкість реакції.
- Збільшення кількості ферменту збільшить швидкість реакції (за умови наявності достатнього субстрату).
Вправи
-
У неферментно-каталізованих реакціях швидкість реакції збільшується в міру збільшення концентрації реагенту. У реакції, що каталізується ферментом, швидкість реакції спочатку збільшується, коли концентрація субстрату збільшується, але потім починає вирівнюватися, так що збільшення швидкості реакції стає все менше і менше зі збільшенням концентрації субстрату. Поясніть цю різницю.
-
Чому ферменти стають неактивними при дуже високих температурах?
-
Фермент має оптимальний рН 7,4. Що найімовірніше трапиться з активністю ферменту, якщо рН впаде до 6,3? Поясніть.
-
Фермент має оптимальний рН 7,2. Що найімовірніше трапиться з активністю ферменту, якщо рН підвищиться до 8,5? Поясніть.
Відповіді
-
У реакції, каталізованої ферментом, субстрат зв'язується з ферментом, утворюючи ферментно-субстратний комплекс. Якщо присутній більше субстрату, ніж фермент, всі сайти зв'язування ферментів матимуть субстрат пов'язаний, і подальше збільшення концентрації субстрату не може збільшити швидкість.
-
Активність знизиться; рН 6,3 більш кислий, ніж 7,4, і одна або кілька ключових груп в активній ділянці можуть зв'язувати іон водню, змінюючи заряд на цій групі.