15.3: Властивості альдегідів і кетонів
- Page ID
- 22075
- Поясніть, чому температури кипіння альдегідів і кетонів вище, ніж у ефірів та алканів подібних молярних мас, але нижчі, ніж у порівнянних спиртів.
- Порівняйте розчинності у воді альдегідів і кетонів чотирьох або менше атомів вуглецю з розчинностями порівнянних алканів і спиртів.
- Назвіть типові реакції, що протікають з альдегідами і кетонами.
- Опишіть деякі види використання загальних альдегідів і кетонів.
Подвійний зв'язок вуглецево-кисневий досить полярний, більш полярний, ніж одиночний зв'язок вуглець-кисень. Електронегативний атом кисню має набагато більшу привабливість для зв'язкових електронних пар, ніж атом вуглецю. Атом вуглецю має частковий позитивний заряд, а атом кисню має частковий негативний заряд:
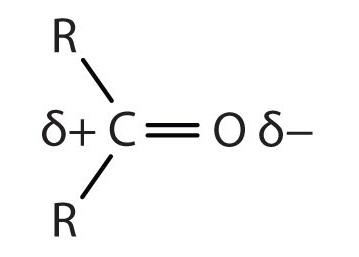
У альдегідів і кетонів це поділ заряду призводить до дипольно-дипольних взаємодій, які досить великі, щоб значно впливати на точки кипіння. Таблиця\(\PageIndex{1}\) показує, що полярні поодинокі зв'язки в ефірах мають незначний такий ефект, тоді як водневий зв'язок між молекулами спирту ще сильніше.
| З'єднання | Сім'я | Молярна маса | Тип міжмолекулярних сил | Температура кипіння (° C) |
|---|---|---|---|---|
| СН 3 СН 2 СН 2 СН 3 | алкан | 58 | лише дисперсія | —1 |
| СН 3 І 2 СН 3 | ефір | 60 | слабкий диполь | 6 |
| СН 3 СН 2 ЧО | альдегід | 58 | сильний диполь | 49 |
| СН 3 СН 2 СН 2 ОН | алкоголь | 60 | водневий зв'язок | 97 |
Формальдегід - це газ кімнатної температури. Ацетальдегід закипає при 20°C; у відкритій посудині він википає в теплому приміщенні. Більшість інших поширених альдегідів - це рідини кімнатної температури.
Хоча нижні члени гомологічного ряду мають різкі запахи, багато вищі альдегіди мають приємні запахи і використовуються в парфумерії та штучних ароматизаторів. Що стосується кетонів, то ацетон має приємний запах, але більшість вищих гомологів мають досить м'які запахи.
Атом кисню карбонільної групи вступає в взаємодію водню з молекулою води.

Тому розчинність альдегідів приблизно така ж, як у спиртів і ефірів. Формальдегід, ацетальдегід і ацетон розчинні у воді. Зі збільшенням вуглецевого ланцюга в довжину розчинність у воді зменшується. Межа розчинності відбувається приблизно при чотирьох атомах вуглецю на атом кисню. Всі альдегіди і кетони розчинні в органічних розчинниках і, в цілому, менш щільні, ніж вода.
Окислення альдегідів і кетонів
Альдегіди і кетони багато схожі в багатьох з їх реакцій, завдяки наявності карбонільної функціональної групи в обох. Вони сильно відрізняються, однак, одним найважливішим видом реакції: окисленням. Альдегіди легко окислюються до карбонових кислот, тоді як кетони протистоять окисленню.

Альдегіди, по суті, є одними з найбільш легко окислюються органічних сполук. Вони окислюються киснем (O 2) на повітрі до карбонових кислот.
\[2RCHO + O_2 \rightarrow 2RCOOH \label{14.10.1} \]
Легкість окислення допомагає хімікам виявити альдегіди. Досить м'який окислювач може відрізняти альдегіди не тільки від кетонів, але і від спиртів. Реагент Толленса, наприклад, являє собою лужний розчин іона срібла (Ag +) в комплексі з аміаком (NH 3), який утримує іон Ag + в розчині.
\[H_3N—Ag^+—NH_3 \label{14.10.2} \]
Коли реагент Толленса окислює альдегід, іон Ag + відновлюється до вільного срібла (Ag).
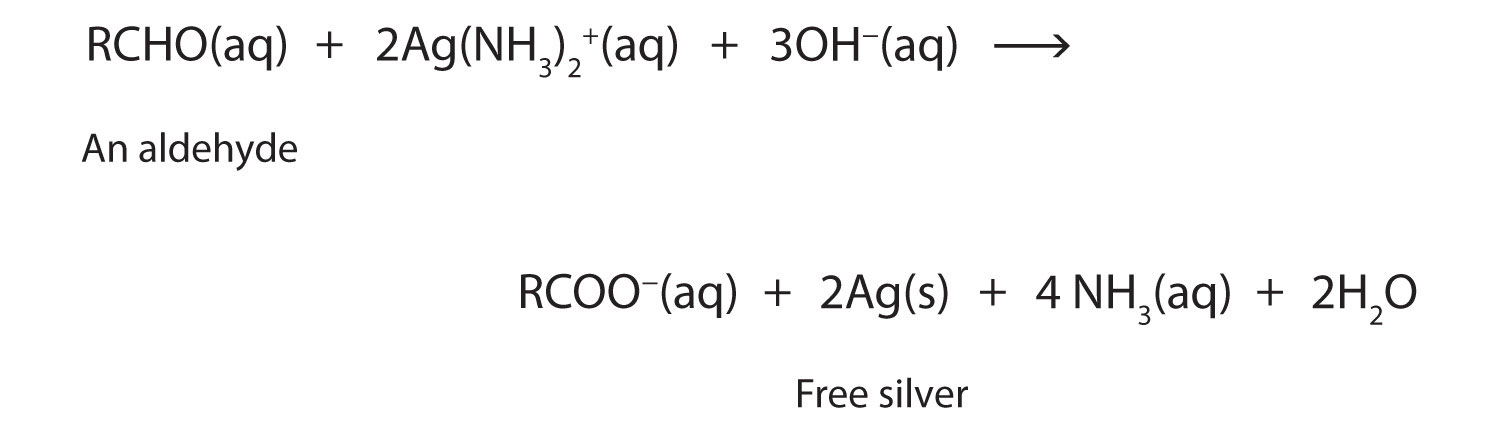
Відкинувшись на чисту скляну поверхню, срібло виробляє дзеркало (рис.\(\PageIndex{1}\)). Звичайні кетони не реагують з реагентом Толленса.

Хоча кетони протистоять окисленню звичайними лабораторними окислювачами, вони піддаються горінню, як і альдегіди.
Резюме
Полярний подвійний зв'язок вуглецю з киснем призводить до того, що альдегіди та кетони мають більш високі температури кипіння, ніж у ефірів та алканів подібних молярних мас, але нижчі, ніж у порівнянних спиртів, які беруть участь у міжмолекулярному водневому зв'язку. Альдегіди легко окислюються до карбонових кислот, тоді як кетони протистоять окисленню.