12.8: Реакції алканів
- Page ID
- 22017
- Зрозумійте реакції алканів: горіння і галогенування.
Алкани є відносно стабільними неполярними молекулами, які не вступають в реакцію з кислотами, основами або окислювальними або відновлювальними реагентами. Алкани зазнають настільки мало реакцій, що їх іноді називають парафінами, від латинського parum affinis, що означає «мало спорідненості».
Однак тепло або світло можуть ініціювати розрив одиночних зв'язків C—H або C—C в реакціях, які називаються горінням та галогенацією.
згоряння
Нічого не відбувається, коли алкани просто змішуються з киснем (\(O_2\)) при кімнатній температурі, але коли полум'я або іскра забезпечують енергію активації, сильно екзотермічна реакція горіння протікає енергійно. Для метану (СН 4) реакція горіння наступна:
\[CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O + \text{heat} \label{1} \]
Як наслідок, алкани є відмінним паливом. Наприклад, метан, CH 4, є основним компонентом природного газу. Бутан, С 4 Н 10, використовується в кемпінгових печах і запальничках є алкан. Бензин являє собою рідку суміш алканів з прямим і розгалуженим ланцюгом, кожен з яких містить від п'яти до дев'яти атомів вуглецю, плюс різні добавки для поліпшення його характеристик в якості палива. Гас, дизельне паливо і мазут - це перш за все суміші алканів з більш високими молекулярними масами. Основним джерелом цих рідких алканових палив є сира нафта, складна суміш, яка відокремлюється шляхом фракційної перегонки. Фракційна перегонка використовує відмінності в температурах кипіння компонентів суміші (рис.\(\PageIndex{1}\)). Ви можете згадати, що температура кипіння - це функція міжмолекулярних взаємодій, про яку йшлося в попередньому розділі.
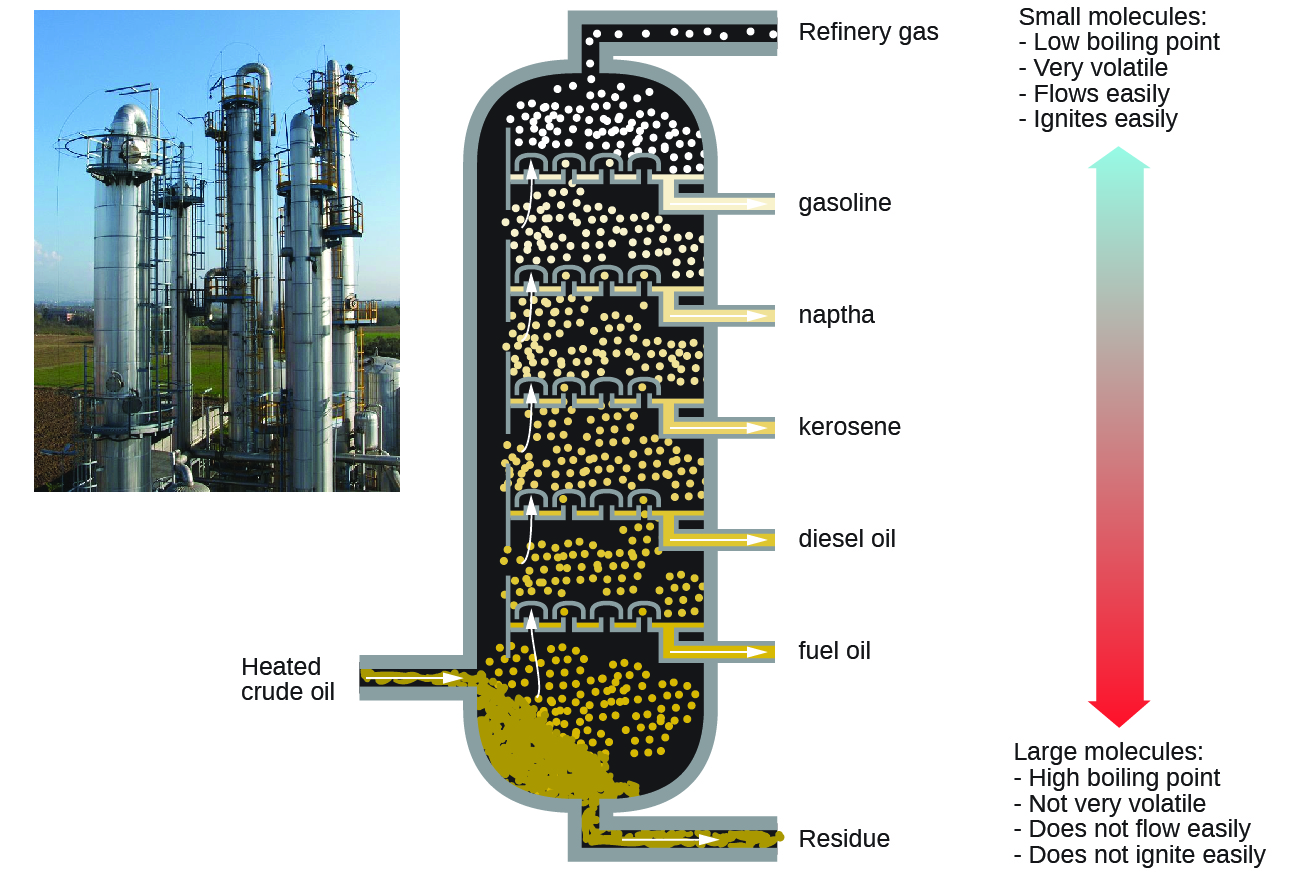
Якщо реагенти реакцій горіння адекватно перемішуються, а кисню достатньо, єдиними продуктами є вуглекислий газ (\(CO_2\)), вода (\(H_2O\)) та енергія-тепло для приготування їжі, опалення будинків та сушіння одягу. Оскільки умови рідко ідеальні, часто утворюються інші небажані побічні продукти. Коли подача кисню обмежена, чадний газ (\(CO\)) є побічним продуктом:
\[2CH_4 + 3O_2 \rightarrow 2CO + 4H_2O\label{2} \]
Ця реакція є причиною десятків смертей щороку від невентильованих або неправильно налаштованих газових обігрівачів. (Подібні реакції з подібними результатами відбуваються з гасовими нагрівачами.)
галогенація
У реакціях галогенування алкани вступають в реакцію з галогенами хлором (\(Cl_2\)) і бромом (\(Br_2\)) у присутності ультрафіолету або при високих температурах з отриманням хлорованих і бромованих алканів. Наприклад, хлор вступає в реакцію з надлишком метану (\(CH_4\)), щоб дати метилхлорид (\(CH_3Cl\)).
\[CH_4 + Cl_2 \rightarrow CH_3Cl + HCl\label{12.7.3} \]
При більшій кількості хлору виходить суміш продуктів: СН 3 Cl, CH 2 Cl 2, ChCl 3 і CCl 4. Фтор (\(F_2\)), найлегший галоген, вибухонебезпечно поєднується з більшістю вуглеводнів. Йод (\(I_2\)) відносно нереактивний. Фторовані і йодовані алкани отримують непрямими методами.
Найрізноманітніші цікаві і часто корисні сполуки мають один або кілька атомів галогену на молекулу. Наприклад, метан (CH 4) може вступати в реакцію з хлором (Cl 2), замінюючи один, два, три або всі чотири атоми водню атомами Cl. Кілька галогенізованих продуктів, отриманих з метану та етану (CH 3 CH 3)\(\PageIndex{1}\), перераховані в таблиці разом з деякими з їх застосувань.
| Формула | Загальна назва | Ім'я IUPAC | Деякі важливі використання |
|---|---|---|---|
| Похідний від CH 4 | |||
| СН 3 Кл | метил хлорид | хлорметан | холодоагент; виробництво силіконів, метилцелюлози та синтетичного каучуку |
| СН 2 Сл 2 | метилен хлорид | дихлорметан | лабораторний і промисловий розчинник |
| ЧКЛ 3 | хлороформ | трихлорметан | промисловий розчинник |
| ККл 4 | чотирихлористий вуглець | тетрахлорметан | розчинник для хімчистки і вогнегасники (але більше не рекомендовані до використання) |
| КбРФ 3 | галон-1301 | бромтрифторметан | системи вогнегасників |
| ККл 3 Ф | хлорфторуглерод-11 (ХФК-11) | трихлорфторметан | піноутворюючі пластмаси |
| ККл 2 Ф 2 | хлорфторуглерод-12 (ХФК-12) | дихлордифторметан | холодоагент |
| Похідний від СН 3 СН 3 | |||
| СН 3 СН 2 Кл | етил хлорид | хлоретан | місцевий анестетик |
| КЛЧ 2 СН 2 Кл | дихлорид етилену | 1,2-дихлоретан | розчинник для гуми |
| ККл 3 СН 3 | метилхлороформ | 1,1,1-трихлоретан | розчинник для очищення комп'ютерних чіпів і форм для формування пластмас |
Після широкого використання в споживчих продуктах багато хлорованих вуглеводнів підозрюють канцерогени (речовини, що викликають рак), а також, як відомо, спричиняють серйозні пошкодження печінки. Прикладом може служити чотирихлористий вуглець (CCl 4), який колись використовувався як розчинник для сухого очищення та у вогнегасниках, але більше не рекомендований для будь-якого використання. Навіть в невеликих кількостях його пари можуть викликати серйозні захворювання, якщо вплив тривалий. Більш того, він реагує з водою при високих температурах з утворенням смертельного фосгенного газу (CoCl 2), що робить використання CcL 4 у вогнегасниках особливо небезпечним.
Етилхлорид, навпаки, використовується як зовнішній місцевий анестетик. При розпилюванні на шкіру він швидко випаровується, досить охолоджуючи ділянку, щоб зробити його нечутливим до болю. Його також можна використовувати в якості екстреного загального знеболюючого засобу.
Бромсодержащие сполуки широко застосовуються в вогнегасниках і в якості антипіренів на одязі та інших матеріалах. Оскільки вони теж токсичні і мають несприятливий вплив на навколишнє середовище, вчені займаються розробкою більш безпечних замінників для них, як і для багатьох інших галогенізованих сполук.
Алкани, замінені атомами фтору (F) та хлору (Cl), використовувались як диспергуючі гази в аерозольних балончиках, як піноутворювачі для пластмас та як холодоагенти. Два найвідоміших з цих хлорфторуглеродів (ХФУ) перераховані в табл\(\PageIndex{2}\).
Хлорфторуглеці сприяють парниковому ефекту в нижній атмосфері. Вони також дифундують в стратосферу, де вони розщеплюються ультрафіолетовим (УФ) випромінюванням, щоб вивільнити атоми Cl. Вони, в свою чергу, руйнують молекули озону (O 3), які захищають Землю від шкідливого УФ-випромінювання. У всьому світі дії зменшили використання ХФУ та споріднених сполук. ХФУ та інші сполуки, що містять Cl- або бром (Br), що руйнують озон, замінюються більш доброякісними речовинами. Гідрофторуглеці (ГФУ), такі як CH 2 FCF 3, які не мають Cl або Br для утворення радикалів, є однією з альтернатив. Інший - гідрохлорфторуглероди (ГХФУ), такі як CHCl 2 CF 3. Молекули ГХФУ легше руйнуються в тропосфері, і менше озоноразрушающих молекул досягають стратосфери.
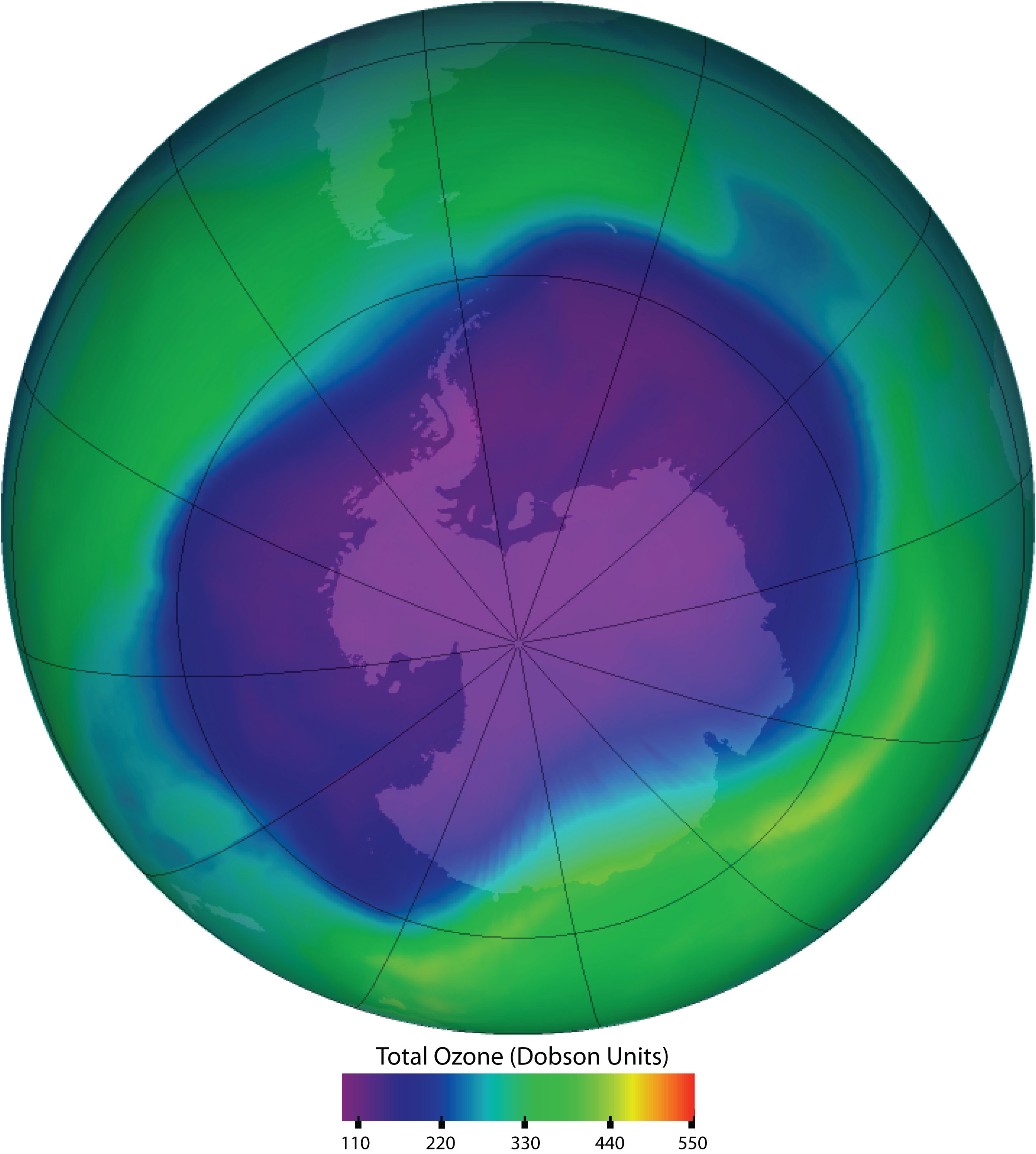
Малюнок\(\PageIndex{2}\): Озон у верхній атмосфері захищає поверхню Землі від ультрафіолетового випромінювання сонця, що може викликати рак шкіри у людини, а також шкідливий для інших тварин і для деяких рослин. Озонові «діри» у верхній атмосфері (сірі, рожеві та фіолетові області в центрі) є великими областями значного руйнування озонового шару. Вони трапляються в основному над Антарктидою з кінця серпня до початку жовтня і заповнюються приблизно в середині листопада. Виснаження озонового шару також було відзначено над арктичними регіонами. Найбільша озонова діра, яку коли-небудь спостерігали, відбулася 24 вересня 2006 року. Джерело: Зображення люб'язно надано NASA, http://ozonewatch.gsfc.nasa.gov/daily.php?date=2006-09-24.