8.11: Парціальний тиск і закон Далтона
Ідеальний закон газу також може бути перебудований, щоб показати, що тиск газу пропорційний кількості газу:
P=RTVn
Таким чином, коефіцієнт RT/V може бути використаний для перетворення кількості речовини та тиску в контейнері заданого об'єму та температури.
Рівняння також??? корисно в роботі з ситуацією, коли два або більше газів обмежені в одному контейнері (тобто однаковому об'ємі). Припустимо, наприклад, що у нас було 0,010 моль газу в 250-мл контейнері при температурі 32°С.
P=RTVn=0.0820 liter atm mol−1 K−1× 305 K0.250 liter× 0.010 mol=1.00 atm
Тепер припустимо, що ми наповнили ту ж ємність 0,004 моль Н 2 (г) при тій же температурі. Тиск був би
pH2=0.0820 liter atm mol−1 K−1× 305 K0.250 liter× 0.004 mol=0.40 atm
Якщо покласти 0,006 моль N 2 в ємність,
pN2=0.0820 liter atm mol−1 K−1× 305 K0.250 liter× 0.006 mol=0.60 atm
Тепер припустимо, що ми поміщаємо як 0,004 моль H 2, так і 0,006 моль N 2 в ту ж колбу разом. Яким би був тиск? Оскільки ідеальний закон газу залежить не від того, який газ у нас є, а лише від кількості будь-якого газу, тиск (0,004 + 0,006) моль, або 0,010 моль, було б саме тим, що ми отримали в нашому першому розрахунку. Але це лише сума тиску, яке H 2 чинив би, якби він зайняв один контейнер плюс тиск N 2, якби це був єдиний присутній газ. Тобто,
Ptotal=pH2+pN2
На малюнку нижче показано поняття парціального тиску більш конкретно, показуючи тиск кожного газу окремо в контейнері, а потім показуючи комбінований тиск газів після змішування.

Ми щойно розробили приклад закону Далтона парціального тиску (названий на честь Джона Далтона, його першовідкривача). Цей закон говорить, що в суміші двох і більше газів загальний тиск - це сума парціальних тисків всіх складових. Парціальний тиск газу - це тиск, який буде чинити газ, якби він зайняв контейнер сам по собі. Парціальний тиск представлено малої літерою р.
Закон Дальтона парціальних тисків найчастіше зустрічається, коли газ збирається шляхом витіснення води, як показано на малюнку 2.
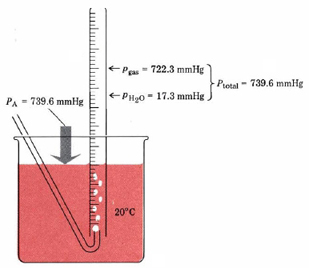
Оскільки газ прокинувся через воду, він містить деякі молекули води і, як кажуть, «мокрий». Загальний тиск цього мокрого газу - це сума парціального тиску самого газу і парціального тиску водяної пари, яку він містить. Останнє парціальний тиск називається тиском пари води. Це залежить тільки від температури експерименту і може бути отримано з довідника або з таблиці 1.
| Температура (°C) | Тиск пари (мм рт.ст.) | Тиск пари (кПа) |
|---|---|---|
| 0 | 4.6 | 0,61 |
| 5 | 6.5 | 0,87 |
| 10 | 9.2 | 1.23 |
| 15 | 12.8 | 1.71 |
| 20 | 17.5 | 2.33 |
| 25 | 23.8 | 3.17 |
| 30 | 31.8 | 4.24 |
| 50 | 92.5 | 12.33 |
| 70 | 233.7 | 31.16 |
| 75 | 289.1 | 38.63 |
| 80 | 355.1 | 47.34 |
| 85 | 433.6 | 57.81 |
| 90 | 525.8 | 70.10 |
| 95 | 633.9 | 84.51 |
| 100 | 760.0 | 101.32 |
Припустимо, 0,321 г металу цинку дозволяється вступати в реакцію з надлишком соляної кислоти (водний розчин газу HCl) за рівнянням
Zn(s)+2HCL(aq)→ZnCl2(aq)+H2(g)
Отриманий водневий газ збирається над водою при 25° C, тоді як барометричний тиск становить 745,4 мм рт.ст. Який обсяг вологого водню буде збиратися?
Розчин З табл. 1 знаходимо, що при 25°C тиск пари води становить 23,8 мм рт. ст. Відповідно
р Н 2 = р загальна — р Н 2 О = 754 мм рт.ст. — 23,8 мм рт.ст. = 721,6 мм рт. ст.
Це повинно бути перетворено на одиниці, сумісні R:
pH2=721.6 mmHg ×1 atm760 mmHg=0.949 atm
Дорожня карта для цієї проблеми є
mZnMZn→nZnS(H2/Zn)→nH2RT/P→VH2
Таким чином
VH2=0.321 g Zn ×1 mol Zn65.38 g Zn×1 mol H22 mol Zn×0.0820 liter atm1 K mol H2×2930.15 K0.987 atm=0.126 liter
