8.2: Міжмолекулярні сили
- Page ID
- 21966
На що припадає ця мінливість? Чому одні речовини стають рідинами при дуже низьких температурах, а інші вимагають дуже високих температур, перш ніж вони стануть рідинами? Все залежить від сили міжмолекулярних сил (МВФ) між частинками речовин і кінетичних енергій (КЕ) його молекул. (Хоча іонні сполуки не складаються з дискретних молекул, ми все одно будемо використовувати термін міжмолекулярний для включення взаємодії між іонами в таких сполуках.) Речовини, які відчувають сильні міжмолекулярні взаємодії, вимагають більш високих температур, щоб стати рідинами і, нарешті, газами. Речовини, які відчувають слабкі міжмолекулярні взаємодії, не потребують багато енергії (як вимірюється температурою), щоб стати рідинами та газами, і будуть демонструвати ці фази при більш низьких температурах.
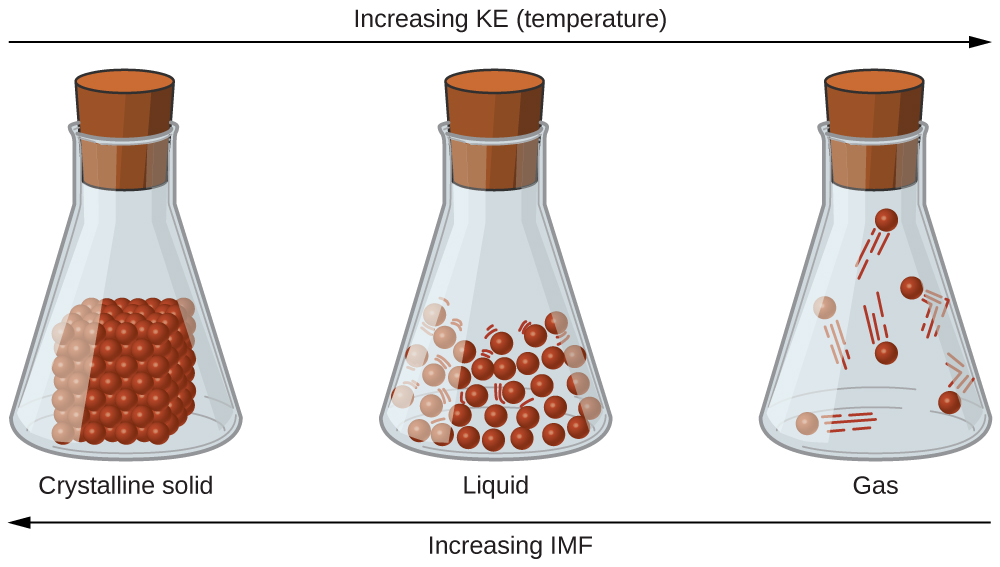
Ковалентні мережеві матеріали
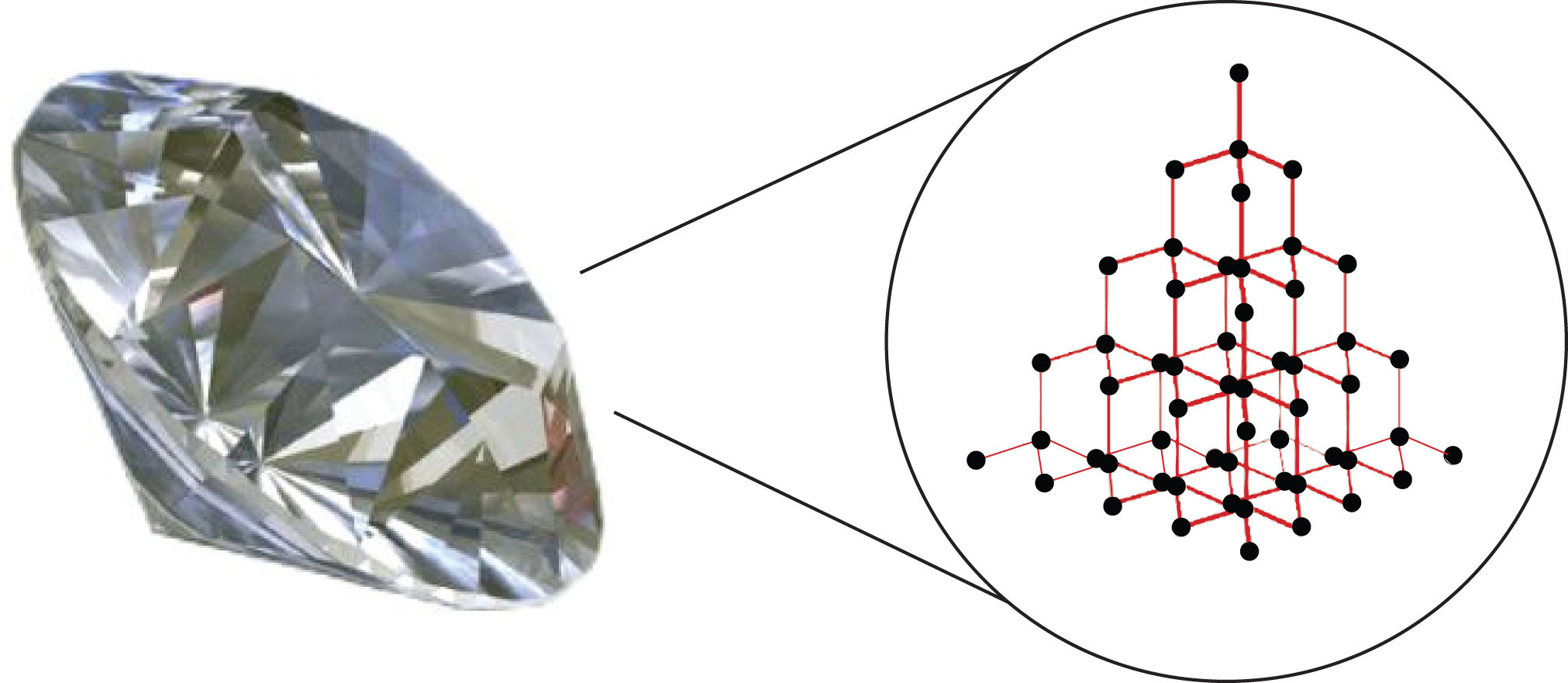
Речовини з найвищими температурами плавлення і кипіння мають ковалентне мережеве з'єднання. Цей тип міжмолекулярної взаємодії насправді є ковалентним зв'язком. У цих речовині всі атоми в зразку ковалентно пов'язані один з одним; по суті, весь зразок є по суті однією гігантською молекулою. Багато з цих речовин тверді в великому температурному діапазоні, тому що потрібно багато енергії, щоб порушити всі ковалентні зв'язки відразу. Одним із прикладів речовини, що показує ковалентне мережеве з'єднання, є алмаз (рис.\(\PageIndex{2}\)). Алмаз повністю складається з атомів вуглецю, кожен з яких пов'язаний з чотирма іншими атомами вуглецю в чотиригранній геометрії. Плавлення твердого тіла ковалентної мережі не здійснюється шляхом подолання відносно слабких міжмолекулярних сил. Швидше за все, всі ковалентні зв'язки повинні бути розірвані - процес, який вимагає надзвичайно високих температур. Алмаз, по суті, зовсім не плавиться. Натомість він випаровується до газу при температурі вище 3,500° C. алмаз надзвичайно твердий і є одним з небагатьох матеріалів, які можуть різати скло.
Іонні сполуки
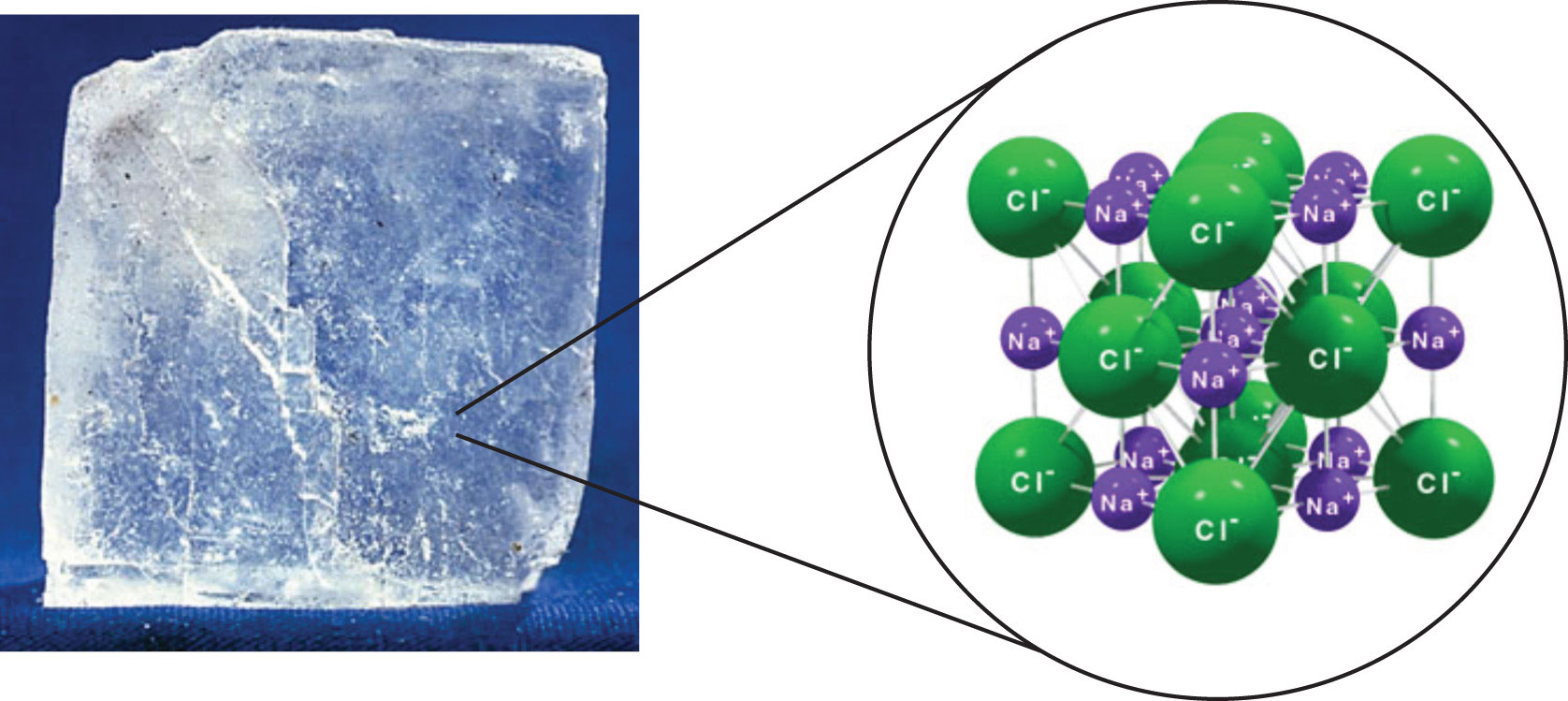
Найсильнішою силою між будь-якими двома частинками є іонна зв'язок, в якій два іони протилежного заряду притягуються один до одного. Таким чином, іонні взаємодії між частинками - ще один вид міжмолекулярної взаємодії. Речовини, що містять іонні взаємодії, відносно сильно тримаються разом, тому ці речовини, як правило, мають високі температури плавлення та кипіння. Хлорид натрію (рис.\(\PageIndex{3}\)) - приклад речовини, частинки якого відчувають іонні взаємодії (табл.\(\PageIndex{1}\)). Ці привабливі сили іноді називають іонно-іонними взаємодіями.
Ковалентні молекулярні сполуки
Існує дві різні ковалентні структури: молекулярна і мережева. Ковалентні мережеві сполуки, такі як SiO 2 (кварц), мають структури атомів у мережі, як алмаз, описаний раніше. У цьому розділі ми маємо справу з молекулярним типом, який містить окремі молекули. Зв'язок між атомами в окремій молекулі є ковалентним, але сили привабливості між молекулами називаються міжмолекулярними силами (МВФ).
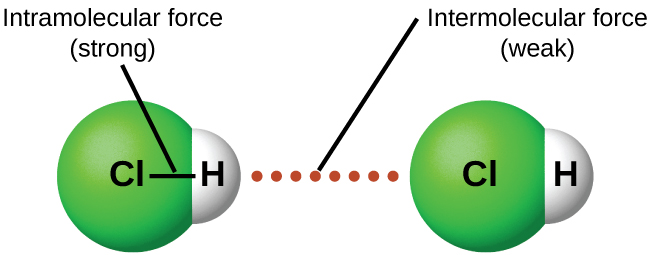
На відміну від внутрішньомолекулярних сил (див. Рис. 8.1.4), таких як ковалентні зв'язки, які утримують атоми разом в молекулах і багатоатомних іонів, міжмолекулярні сили утримують молекули разом в рідині або твердому тілі. Міжмолекулярні сили, як правило, набагато слабкіше ковалентних зв'язків. Наприклад, для подолання внутрішньомолекулярних сил і розриву обох O—H зв'язків в 1 моль води потрібно 927 кДж, але для подолання міжмолекулярних атракціонів і перетворення 1 моль рідкої води в водяну пару при 100° C (Незважаючи на це, здавалося б, низьке значення, міжмолекулярні сили в рідка вода є одними з найсильніших таких сил відомих!) З огляду на велику різницю в силах внутрішньо- і міжмолекулярних сил, зміни між твердим, рідким і газоподібним станами практично незмінно відбуваються для молекулярних речовин без розриву ковалентних зв'язків.
У цьому розділі ми обговоримо три типи МВФ в молекулярних сполуках: диполь-диполь, водневий зв'язок і лондонські сили дисперсії.
Диполь-дипольні міжмолекулярні сили
Як обговорювалося в розділі 4.4, ковалентний зв'язок, який має нерівний розподіл електронів, називається полярним ковалентним зв'язком. (Ковалентний зв'язок, який має рівний розподіл електронів, як і в ковалентному зв'язку з одним і тим же атомом з кожного боку, називається неполярної ковалентної зв'язком.) Молекула з чистим нерівномірним розподілом електронів в її ковалентних зв'язках - це полярна молекула. HF - приклад полярної молекули (див. Рис.
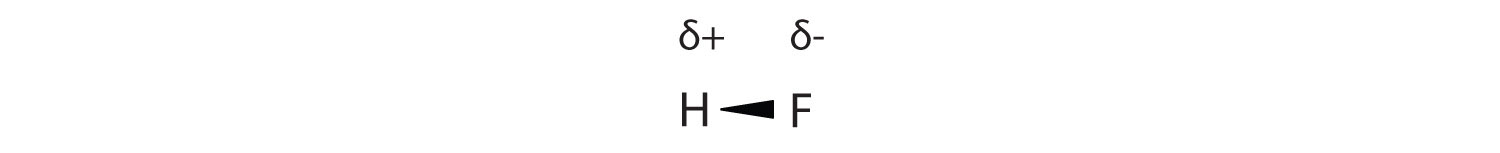
Поділ заряду в полярному ковалентному зв'язку не настільки екстремальний, як зустрічається в іонних сполуках, але є пов'язаний результат: протилежно заряджені кінці різних молекул будуть притягувати один одного. Цей тип міжмолекулярної взаємодії називається дипольно-дипольним взаємодією. Багато молекул з полярними ковалентними зв'язками відчувають дипольно-дипольні взаємодії.
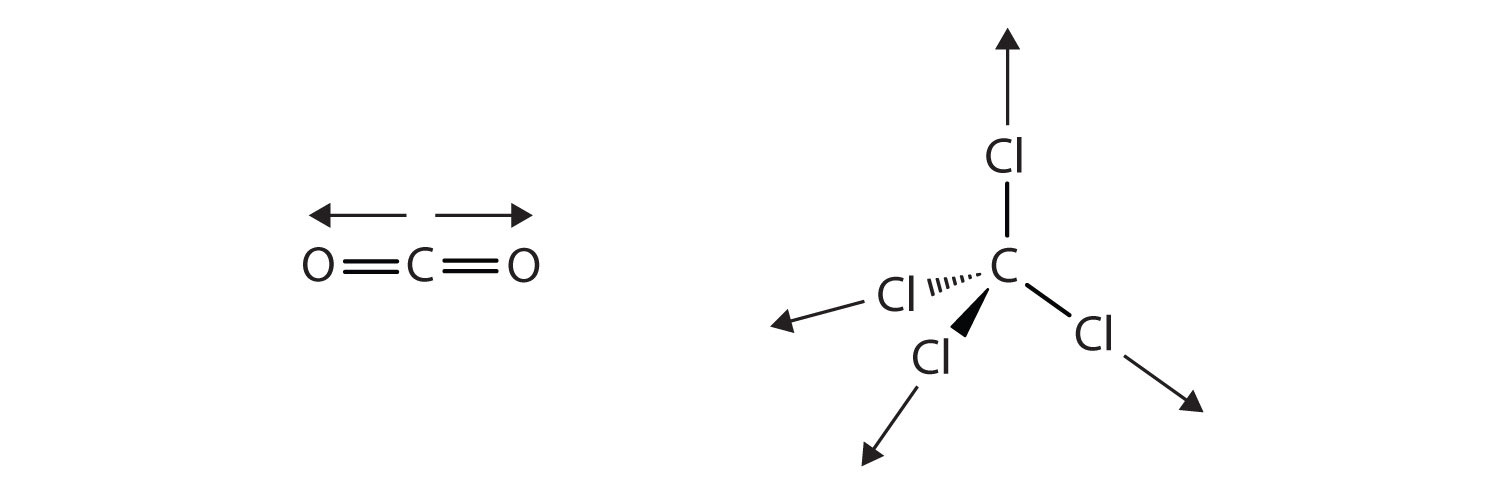
Ковалентні зв'язки в деяких молекулах орієнтовані в просторі таким чином, що зв'язки в молекулах скасовують один одного назовні. Окремі зв'язки полярні, але завдяки молекулярній симетрії загальна молекула не полярна; скоріше, молекула неполярна. Такі молекули відчувають мало або взагалі не мають дипольно-дипольних взаємодій. Вуглекислий газ (CO 2) і чотирихлористий вуглець (CcL 4) - приклади таких молекул (рис.\(\PageIndex{6}\)).
Нагадаємо з розділів 4.4 і 4.5, про хімічний зв'язок і молекулярну геометрію, що полярні молекули мають частковий позитивний заряд з одного боку і частковий негативний заряд з іншого боку молекули - поділ заряду, який називається диполем. Розглянемо полярну молекулу, таку як хлористий водень, HCl. У молекулі HCl більш електронегативний атом Cl несе частковий негативний заряд, тоді як менш електронегативний атом Н несе частковий позитивний заряд. Приваблива сила між молекулами HCl виникає внаслідок тяжіння між позитивним кінцем однієї молекули HCl та негативним кінцем іншої. Ця сила привабливості називається дипольно-дипольним притяганням - електростатичною силою між частково позитивним кінцем однієї полярної молекули та частково негативним кінцем іншої, як показано на малюнку\(\PageIndex{7}\).
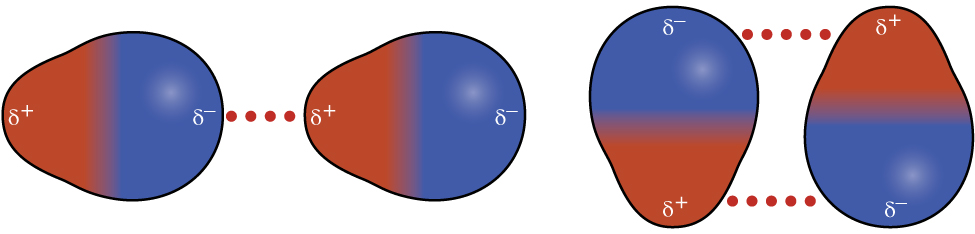
Ефект дипольно-дипольного тяжіння очевидний, коли ми порівнюємо властивості молекул HCl з неполярними молекулами F 2. І HCl, і F 2 складаються з однакової кількості атомів і мають приблизно однакову молекулярну масу. При температурі 150 К молекули обох речовин мали б однакову середню кінетичну енергію. Однак дипольно-дипольних атракціонів між молекулами HCl достатньо, щоб змусити їх «склеюватися», утворюючи рідину, тоді як відносно слабкі сили дисперсії між неполярними молекулами F 2 не є, і тому ця речовина газоподібна при цій температурі. Вища нормальна температура кипіння HCl (188 K) порівняно з F 2 (85 K) є відображенням більшої сили дипольно-дипольних атракціонів між молекулами HCl, порівняно з атракціонами між неполярними молекулами F 2. Ми часто будемо використовувати такі значення, як кипіння або точки замерзання, як показники відносної сили IMF тяжіння, присутніх у різних речовині.
Передбачте, яка буде мати більш високу температуру кипіння: N 2 або CO. Поясніть свої міркування.
Рішення
CO і N 2 є двоатомними молекулами з масою близько 28 ам, тому вони відчувають подібні лондонські сили дисперсії. Оскільки СО є полярною молекулою, вона відчуває дипольно-дипольні атракціони. Оскільки N 2 неполярний, його молекули не можуть демонструвати дипольно-дипольні атракціони. Дипольно-дипольні атракціони між молекулами СО порівняно сильніші, ніж сили дисперсії між неполярними молекулами N 2, тому CO, як очікується, матиме вищу температуру кипіння.
Вправа\(\PageIndex{1}\)
Передбачте, яка буде мати більш високу температуру кипіння:\(\ce{ICl}\) або\(\ce{Br2}\). Поясніть свої міркування.
- Відповідь
-
iCl. iCl і Br 2 мають подібні маси (~ 160 аму) і тому відчувають подібні лондонські сили розсіювання. iCl є полярним і, таким чином, також демонструє дипольно-дипольні атракціони; Br 2 неполярний і не має. Відносно сильніші дипольно-дипольні атракціони вимагають більше енергії для подолання, тому iCl матиме вищу температуру кипіння.
Міжмолекулярні сили зв'язку водню
Молекули з атомами водню, пов'язані з електронегативними атомами, такими як O, N і F, як правило, виявляють надзвичайно сильні міжмолекулярні взаємодії через особливо сильний тип дипольно-дипольного тяжіння, який називається водневим зв'язком. Дуже велика різниця в електронегативності між атомом H (2.1) і атомом, з яким він пов'язаний (4,0 для атома F, 3,5 для атома O або 3,0 для атома N), в поєднанні з дуже малим розміром атома H і відносно малими розмірами атомів F, O або N, призводить до висококонцентрованого часткові заряди з цими атомами. Оскільки атом водню не має ніяких електронів, крім тих, що знаходяться в ковалентному зв'язку, його позитивно заряджене ядро майже повністю піддається впливу, дозволяючи сильні притягання до інших сусідніх одиноких пар електронів.
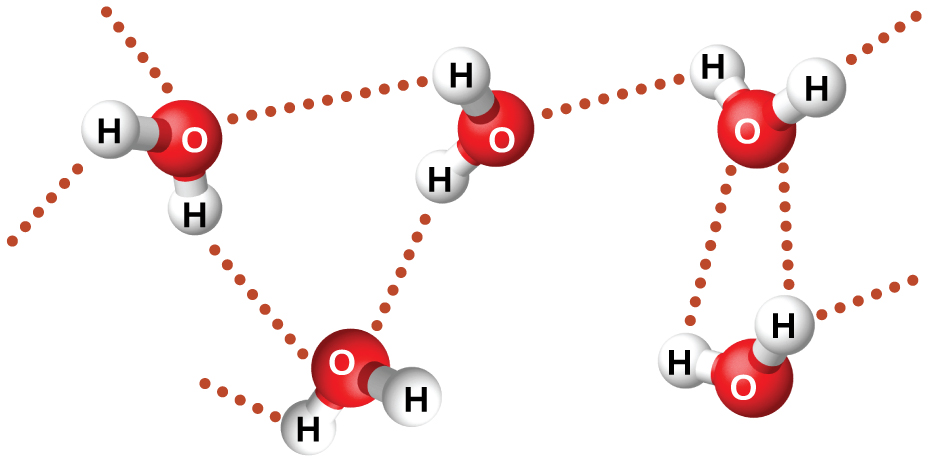
Приклади водневих зв'язків включають HFHF, H 2 OHOH і H 3 NHNH 2, в яких водневі зв'язки позначаються точками. Малюнок\(\PageIndex{8}\) ілюструє водневий зв'язок між молекулами води. На фізичні властивості води, яка має дві O—H зв'язку, сильно впливає наявність водневого зв'язку між молекулами води. Більшість молекулярних сполук, які мають масу, подібну до води, є газами кімнатної температури. Однак через міцних водневих зв'язків молекули води здатні залишатися конденсованими в рідкому стані.
Водневий зв'язок - це міжмолекулярна сила притягання, в якій атом водню, ковалентно пов'язаний з малим, високоелектронегативним атомом, притягується до самотньої пари електронів на атом в сусідній молекулі. На малюнку\(\PageIndex{9}\) показано, як молекули метанолу (CH 3 OH) відчувають водневий зв'язок. Метанол містить як атом водню, приєднаний до O; метанол може таким чином утворювати водневі зв'язки, виступаючи або донором водневих зв'язків, або акцептором водневих зв'язків (одиночна пара). Водень зв'язана структура метанолу виглядає наступним чином:
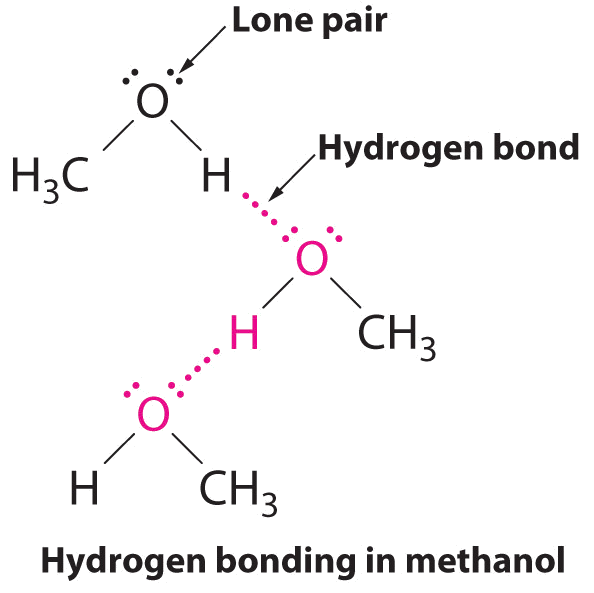
Незважаючи на використання слова «зв'язок», майте на увазі, що водневі зв'язки - це міжмолекулярні сили привабливості, а не внутрішньомолекулярні сили притягання (ковалентні зв'язки). Водневі зв'язки набагато слабкіше ковалентних зв'язків, але, як правило, набагато сильніші, ніж інші дипольно-дипольні атракціони та сили дисперсії.
Розглянемо сполуки диметилеефіру (СН 3 ОСН 3), етанолу (СН 3 СН 2 ОН) і пропану (СН 3 СН 2 СН 3). Їх температури кипіння, не обов'язково в порядку, складають −42,1° C, −24,8° C і 78,4° C. Поясніть свої міркування.
Рішення
Форми СН 3 ОЧ 3, СН 3 СН 2 ОН і СН 3 СН 2 СН 3 схожі, як і їх молярні маси (46 г/моль, 46 г/моль і 44 г/моль відповідно), тому вони будуть проявляти подібні сили дисперсії. Оскільки CH 3 CH 2 CH 3 є неполярним, він може проявляти лише сили розсіювання. Оскільки CH 3 OCH 3 є полярним, він також відчує дипольно-дипольні атракціони. Нарешті, CH 3 CH 2 OH має групу −OH, і тому він відчує унікальне сильне дипольно-дипольне притягання, відоме як водневе з'єднання. Отже, впорядкування з точки зору міцності ІМФ і, отже, температури кипіння, становить СН 3 СН 2 СН 3 < СН 3 ОЧ 3 < СН 3 СН 2 ОН. Температура кипіння пропану становить -42,1° C, температура кипіння диметилеефіру - −24,8° C, а температура кипіння етанолу - 78,5° C.
Етан (CH 3 CH 3) має температуру плавлення −183 °C і температуру кипіння −89 °С, прогнозують температуру плавлення та кипіння метиламіну (CH 3 NH 2). Поясніть свої міркування.
- Відповідь
-
Прогнозується, що температура плавлення та температура кипіння метиламіну будуть значно більшими, ніж температура плавлення етану. CH 3 CH 3 і CH 3 NH 2 схожі за розміром і масою, але метиламін має групу −NH і тому може проявляти водневий зв'язок. Це значно збільшує його IMF, а отже, і температури плавлення і кипіння. Важко передбачити значення, але відомі значення - температура плавлення −93° C і температура кипіння −6° C.
Водневий зв'язок і ДНК
Дезоксирибонуклеїнова кислота (ДНК) міститься в кожному живому організмі і містить генетичну інформацію, яка визначає особливості організму, забезпечує план виготовлення білків, необхідних для життя, і служить шаблоном для передачі цієї інформації потомству організму. Молекула ДНК складається з двох (анти-) паралельних ланцюгів повторюваних нуклеотидів, які утворюють її добре відому подвійну спіральну структуру, як показано на малюнку\(\PageIndex{10}\).
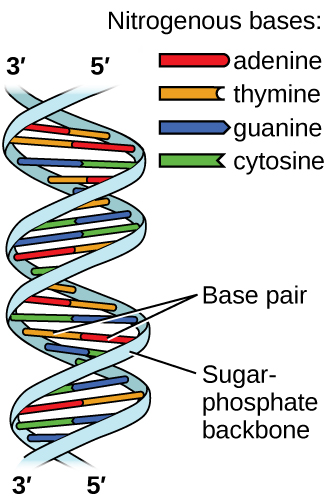
Кожен нуклеотид містить (дезоксирибозу) цукор, пов'язаний з фосфатною групою з одного боку, і один з чотирьох азотистих підстав з іншого. Дві основи, цитозин (С) і тимін (Т), є однокільцевими структурами, відомими як піримідини. Інші два, аденін (А) і гуанін (G), є двокільцевими структурами, які називаються пуринами. Ці основи утворюють комплементарні пари основ, що складаються з одного пурину і одного піримідину, з аденіном спаровування з тиміном, і цитозин з гуаніном. Кожна базова пара скріплюється водневим зв'язком. А і Т поділяють дві водневі зв'язки, C і G поділяють три, і обидві пари мають аналогічну форму і структуру (рис.\(\PageIndex{11}\)
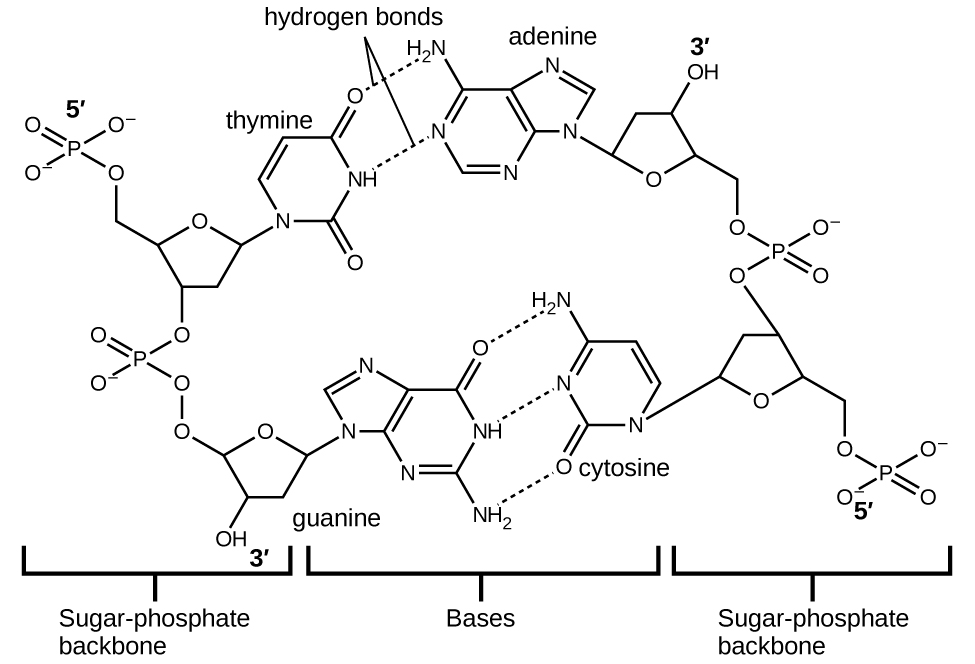
Сукупний ефект мільйонів водневих зв'язків ефективно утримує дві нитки ДНК разом. Важливо, що дві нитки ДНК можуть відносно легко «розпакувати» вниз по середині, оскільки водневі зв'язки відносно слабкі порівняно з ковалентними зв'язками, які утримують атоми окремих молекул ДНК разом. Це дозволяє обом пасмам функціонувати як шаблон для реплікації.
Лондон Дисперсійні сили
Нарешті, між усіма молекулами є сили, викликані електронами, що знаходяться в різних місцях молекули в будь-який час, що встановлює тимчасове відділення заряду, яке зникає майже як тільки він з'являється. Це дуже слабкі міжмолекулярні взаємодії і називаються силами дисперсії (або лондонськими силами). (Альтернативна назва - лондонські сили розсіювання.) Молекули, які не відчувають іншого типу міжмолекулярної взаємодії, принаймні відчують сили дисперсії. Речовини, які відчувають лише сили дисперсії, зазвичай м'які в твердій фазі і мають відносно низькі температури плавлення. Приклади включають воски, які є довгими вуглеводневими ланцюгами, які є твердими речовинами при кімнатній температурі, оскільки молекули мають стільки електронів. Отримані сили дисперсії між цими молекулами змушують їх приймати тверду фазу при нормальних температурах.
Сили дисперсії, що розвиваються між атомами в різних молекулах, можуть притягувати дві молекули один до одного. Однак сили відносно слабкі і стають значними лише тоді, коли молекули знаходяться дуже близько. Більші та важчі атоми та молекули виявляють сильніші сили дисперсії, ніж менші та легші атоми та молекули. F 2 і Cl 2 - гази кімнатної температури (відображають слабші сили притягання); Br 2 - рідина, а I 2 - тверда речовина (відображає більш сильні сили тяжіння). Тенденції спостережуваних температур плавлення і кипіння галогенів наочно демонструють цей ефект, як видно з таблиці 8.1.2.
| Галогенні | Молярна маса | Атомний радіус | Точка плавлення | Точка кипіння |
|---|---|---|---|---|
| фтор, F 2 | 38 г/моль | 72 вечора | 53 КМ | 85 КМ |
| хлор, Cl 2 | 71 г/моль | 9 вечора | 172 КМ | 238 КМ |
| бром, Br 2 | 160 г/моль | 114 вечора | 266 КМ | 332 КМ |
| йод, I 2 | 254 г/моль | 133 вечора | 387 КМ | 457 КМ |
| астатину, В 2 | 420 г/моль | 150 вечора | 575 КМ | 610 КМ |
Збільшення температури плавлення та кипіння зі збільшенням атомного/молекулярного розміру може бути раціоналізовано, враховуючи, як на силу сил дисперсії впливає електронна структура атомів або молекул речовини. У більшому атомі валентні електрони знаходяться, в середньому, далі від ядер, ніж в меншому атомі. Таким чином, вони менш міцно утримуються і можуть легше утворювати тимчасові диполі, які виробляють тяжіння. Міра того, наскільки легко або важко інший електростатичний заряд (наприклад, сусідній іон або полярна молекула) спотворює розподіл заряду молекули (її електронна хмара), відома як поляризуваність. Молекула, яка має хмару заряду, яка легко спотворюється, вважається дуже поляризованою і матиме великі сили дисперсії; одна з хмарою заряду, яку важко спотворювати, не дуже поляризується і матиме малі сили дисперсії.
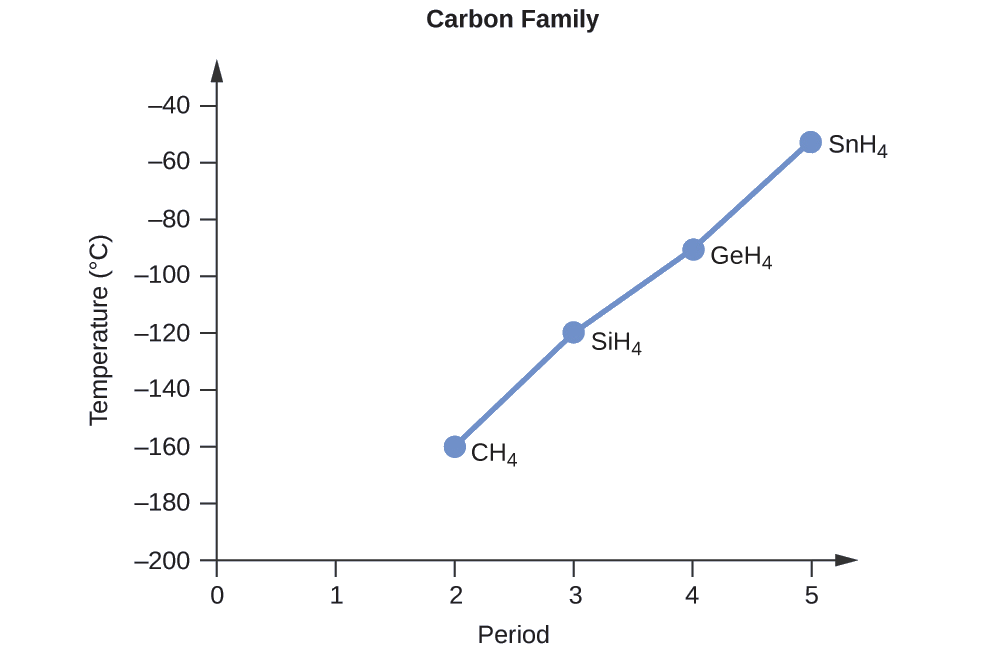
Замовте наступні сполуки елемента 14 групи та водню від найнижчої до найвищої температури кипіння: CH 4, SiH 4, GeH 4 та SnH 4. Поясніть свої міркування.
Рішення
Застосовуючи навички, набуті в розділі про хімічне зв'язування та молекулярну геометрію, всі ці сполуки прогнозуються як неполярні, тому вони можуть відчувати лише сили дисперсії: чим менше молекула, тим менше поляризуються і слабкіші сили дисперсії; чим більше молекула, тим більше сили розсіювання. Молярні маси СН 4, SiH 4, GeH 4 і SnH 4 складають приблизно 16 г/моль, 32 г/моль, 77 г/моль і 123 г/моль відповідно. Тому очікується, що CH 4 матиме найнижчу температуру кипіння, а SnH 4 - найвищу температуру кипіння. Очікується, що замовлення від найнижчої до найвищої температури кипіння буде
СН 4 < SiH 4 < ГеГ 4 < SnH 4
Графік фактичних температур кипіння цих сполук у порівнянні з періодом групи 14 елементів показує, що це прогноз є правильним:
Вправа\(\PageIndex{3}\)
Замовте наступні вуглеводні від найнижчої до найвищої температури кипіння: C 2 H 6, C 3 H 8, і C 4 H 10.
- Відповідь
-
Всі ці сполуки неполярні і мають лише лондонські сили дисперсії: чим більше молекула, тим більші сили дисперсії і тим вище температура кипіння. Тому замовлення від найнижчої до найвищої температури кипіння
С 2 Н 6 < С 3 Н 8 < С 4 Н 10.
Гекони мають дивовижну здатність прилипати до більшості поверхонь. Вони можуть швидко розбігатися по гладких стінам і поперек стель, які не мають ніжок, і вони роблять це, не маючи присосок або липкої речовини на пальцях ніг. І хоча гекон може легко піднімати ноги, коли він ходить по поверхні, якщо ви намагаєтеся підняти його, він прилипає до поверхні. Як гекони (а також павуки і деякі інші комахи) здатні це зробити? Хоча це явище досліджувалося протягом сотень років, вчені лише нещодавно розкрили деталі процесу, який дозволяє ногам гекона вести себе таким чином.

Пальці ніг Геккоса покриті сотнями тисяч крихітних волосків, відомих як щетинки, з кожною сіткою, в свою чергу, розгалужується на сотні крихітних, плоских, трикутних кінчиків, які називаються шпателями. Величезна кількість шпателей на його щетинках забезпечують гекон, показаний на малюнку 8.1.12, з великою загальною площею поверхні для прилипання до поверхні. У 2000 році Келлар Осінь, який очолює багатоінституційну дослідницьку групу геконів, виявив, що гекони однаково добре дотримувалися як полярного діоксиду кремнію, так і неполярного арсеніду галію. Це довело, що гекони прилипають до поверхонь через сили дисперсії — слабкі міжмолекулярні атракціони, що виникають внаслідок тимчасових синхронізованих розподілів зарядів між сусідніми молекулами. Хоча сили розсіювання дуже слабкі, загальна привабливість понад мільйони шпателей досить велика, щоб підтримувати багато разів вагу геккона.
У 2014 році двоє вчених розробили модель, щоб пояснити, як гекони можуть швидко переходити від «липкого» до «нелипкого». Алекс Гріні та Конгконг Ху з Університету штату Орегон описали, як гекони можуть досягти цього, змінюючи кут між шпателями та поверхнею. Ноги Геккоса, які зазвичай не липкі, стають липкими, коли застосовується невелика сила зсуву. Завиваючи і розкручуючи пальці ніг, гекони можуть чергувати прилипання і відклеювання від поверхні, і, таким чином, легко переміщатися по ній. Подальші дослідження можуть врешті-решт призвести до розробки кращих клеїв та інших застосувань.
Точки кипіння та типи склеювання
Для того щоб речовина увійшло в газову фазу, його частинки повинні повністю подолати міжмолекулярні сили, що утримують їх разом. Тому порівняння точок кипіння по суті еквівалентно порівнянню сильних сторін привабливих міжмолекулярних сил, що виявляються окремими молекулами. Для малих молекулярних сполук лондонські сили дисперсії є найслабшими міжмолекулярними силами. Диполь-дипольні сили дещо сильніші, а водневий зв'язок є особливо сильною формою дипольно-дипольної взаємодії. Однак, коли маса неполярної молекули досить велика, її сили дисперсії можуть бути сильнішими, ніж дипольно-дипольні сили в більш легкій полярній молекулі. Таким чином, неполярний Cl 2 має більш високу температуру кипіння, ніж полярний HCl.
| Речовина | Найсильніша міжмолекулярна сила | Точка кипіння\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|
| \(\ce{H_2}\) | дисперсія | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-253 |
| \(\ce{Ne}\) | дисперсія | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-246 |
| \(\ce{O_2}\) | дисперсія | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-183 |
| \(\ce{Cl_2}\) | дисперсія | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-34 |
| \(\ce{HCl}\) | диполь-диполь | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-85 |
| \(\ce{HBr}\) | диполь-диполь | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-66 |
| \(\ce{H_2S}\) | диполь-диполь | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-61 |
| \(\ce{NH_3}\) | водневий зв'язок | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-33 |
| \(\ce{HF}\) | водневий зв'язок | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">20 |
| \(\ce{H_2O}\) | водневий зв'язок | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 100 |
Які міжмолекулярні сили крім сил дисперсії, якщо такі є, існують в кожній речовині? Чи є які-небудь з цих речовин тверді речовини при кімнатній температурі?
- хлорид калію (KCl)
- етанол (С 2 Н 5 ОН)
- бром (Br 2)
Рішення
- Хлорид калію складається з іонів, тому міжмолекулярна взаємодія в хлориді калію є іонними силами. Оскільки іонні взаємодії є сильними, можна очікувати, що хлорид калію є твердою речовиною при кімнатній температурі.
- Етанол має атом водню, прикріплений до атома кисню, тому він зазнає водневого зв'язку. Якщо водневе з'єднання досить міцне, етанол може бути твердим речовиною при кімнатній температурі, але це важко знати напевно. (Етанол насправді є рідиною кімнатної температури.)
- Елементарний бром має два атоми брому, ковалентно пов'язані один з одним. Оскільки атоми по обидва боки ковалентного зв'язку однакові, електрони в ковалентному зв'язку поділяються порівну, а зв'язок - неполярний ковалентний зв'язок. Таким чином, двоатомний бром не має ніяких міжмолекулярних сил, крім сил дисперсії. Навряд чи буде твердим речовиною при кімнатній температурі, якщо сили розсіювання не будуть досить сильними. Бром - рідина кімнатної температури.
Які міжмолекулярні сили крім сил дисперсії, якщо такі є, існують в кожній речовині? Чи є які-небудь з цих речовин тверді речовини при кімнатній температурі?
- метиламін (СН 3 NH 2)
- сульфат кальцію (CaSO 4)
- чадний газ (СО)
- Відповідь
-
а. диполь-дипольний, водневий зв'язок
б. іонні сили (тверде тіло при кімнатній температурі)
c. диполь-диполь
Концепція Огляд вправи
1. Які типи міжмолекулярних взаємодій можуть існувати в сполуках?
2. У чому різниця між ковалентною мережею і ковалентними молекулярними сполуками?
Відповідь
1. іонний зв'язок, мережевий ковалент, сили дисперсії, дипольно-дипольні взаємодії та водневий зв'язок.
2. Ковалентні мережеві сполуки містять атоми, ковалентно пов'язані з іншими окремими атомами в гігантській тривимірній мережі. Ковалентні молекулярні сполуки містять окремі молекули, які притягуються один до одного за допомогою дисперсії, диполь-дипольного або водневого зв'язку.
Ключові виноси
- Фаза - це форма матерії, яка має однакові фізичні властивості у всьому.
- Молекули взаємодіють між собою за допомогою різних сил: дипольно-дипольних взаємодій, водневого зв'язку та сил дисперсії.
- Диполь-дипольні атракціони є результатом електростатичного тяжіння часткового негативного кінця однієї диполярної молекули для часткового позитивного кінця іншої.
- Водневі зв'язки - це особливий тип дипольно-дипольного тяжіння, який виникає, коли водень пов'язаний з одним з трьох найбільш електронегативних елементів: F, O або N.
- Тимчасовий диполь, що виникає в результаті руху електронів в атомі, може викликати диполь у сусідньому атомі і породжувати лондонську силу дисперсії. Лондонські сили збільшуються зі збільшенням молекулярних розмірів.
Вправи
-
Перелічіть три загальні фази в тому порядку, в якому ви, ймовірно, їх знайдете - від найнижчої температури до найвищої температури.
-
Перерахуйте три загальні фази в тому порядку, в якому вони існують від найнижчої енергії до найвищої енергії.
-
Перерахуйте ці міжмолекулярні взаємодії від найслабших до найсильніших: лондонські сили, водневий зв'язок та іонні взаємодії.
-
Перелічіть ці міжмолекулярні взаємодії від найслабших до найсильніших: зв'язок ковалентної мережі, дипольно-дипольні взаємодії та сили дисперсії.
-
Який тип міжмолекулярної взаємодії переважає в кожній речовині?
- вода (Н 2 О)
- сульфат натрію (Na 2 SO 4)
- декан (С 10 Н 22)
-
Який тип міжмолекулярної взаємодії переважає в кожній речовині?
- алмаз (С, кристал)
- гелій (He)
- аміак (NH 3)
-
Поясніть, як молекула, як вуглекислий газ (CO 2), може мати полярні ковалентні зв'язки, але бути неполярною в цілому.
-
Діоксид сірки (SO 2) має формулу, подібну до формули вуглекислого газу (див. Вправа 7), але в цілому є полярною молекулою. Що можна зробити висновок про форму молекули SO 2?
-
Які фізичні властивості речовин, які відчувають ковалентне мережеве з'єднання?
-
Які фізичні властивості речовин, які відчувають лише сили дисперсії?
Відповіді
-
тверді, рідкі та газові
-
Лондонські сили, водневі зв'язки та іонні взаємодії
-
- водневий зв'язок
- іонні взаємодії
- сили розсіювання
-
Дві ковалентні зв'язки орієнтовані таким чином, що їх диполі скасовуються.
9. дуже твердий, висока температура плавлення
10. дуже м'яка, дуже низька температура плавлення