8.1: Стани матерії та їх зміни
- Огляд станів речовини та їх властивостей
- Опишіть, як зміна температури вплине на стан речовини.
Раніше вас познайомили з трьома станами, які також називаються фазами, речовини; тверде, рідке та газове. Фаза - це певна форма матерії, яка включає в себе певний набір фізичних властивостей. Тобто атоми, молекули або іони, що складають фазу, роблять це послідовно протягом всієї фази. Наука визнає три стабільні фази: тверду фазу, в якій окремі частинки можна вважати контактними і утримувати на місці; рідку фазу, в якій окремі частинки контактують, але рухаються відносно один одного; і газова фаза, при якій окремі частинки відокремлені один від одного відносно великими відстанями (див.8.1.1 Рис.
Стан речовини залежить від балансу між кінетичною енергією окремих частинок (молекул або атомів) і силами притягання між молекулами, званими міжмолекулярними силами. Кінетична енергія тримає молекули окремо і рухаються навколо, і є функцією температури речовини. Міжмолекулярні сили втягують частинки разом. Як обговорювалося раніше, гази дуже чутливі до температур і тиску. Однак вони також впливають на рідини та тверді речовини. Нагрівання та охолодження можуть змінювати кінетичну енергію частинок у речовині, і тому ми можемо змінити фізичний стан речовини, нагріваючи або охолоджуючи її. Підвищення тиску на речовину змушує молекули зближуватися, що збільшує силу міжмолекулярних сил.
 |
 |
 |
| (а) в газоподібному стані | (б) як рідина | (c) в твердому вигляді |
Ми використовуємо зміни між газом, рідким та твердим станами, щоб охолодити напій кубиками льоду (твердий до рідкого), охолодити наше тіло потовиділенням (від рідини до газу) та охолодити їжу всередині холодильника (газ до рідини і навпаки). Ми використовуємо сухий лід, який є твердим CO 2, як холодоагент (твердий до газу), і робимо штучний сніг для катання на лижах і сноуборді, перетворюючи рідину в тверду речовину. У цьому розділі ми розглянемо, що відбувається, коли будь-яка з трьох форм матерії перетворюється на будь-яку з двох інших. Ці зміни стану часто називають фазовими змінами. Шість найпоширеніших фазових змін показані на малюнку8.1.2.
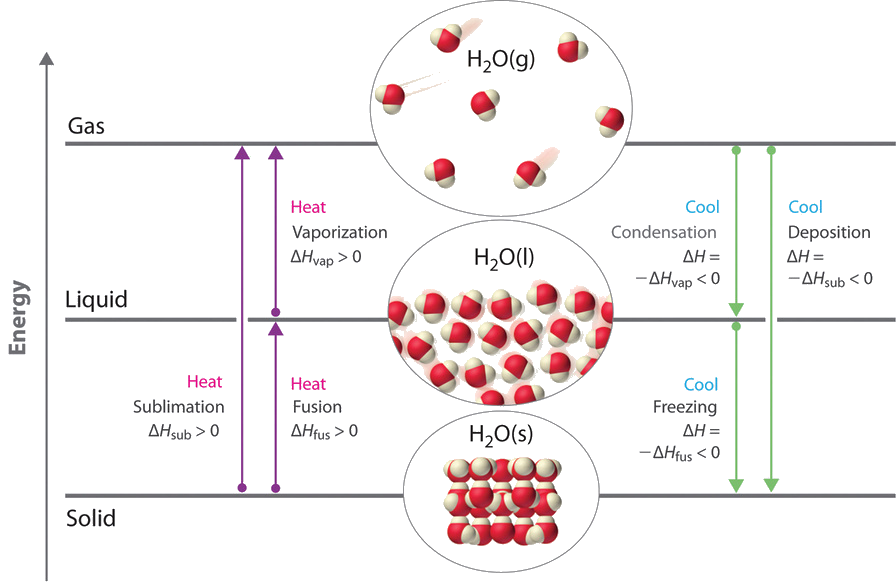
Енергетичні зміни, які супроводжують фазові зміни
Фазові зміни завжди супроводжуються зміною ентальпії системи.ΔH Наприклад, перетворення рідини, в якій молекули знаходяться близько один до одного, в газ, в якому молекули знаходяться, в середньому, далеко один від одного, вимагає введення енергії (тепла), щоб дати молекулам достатньо кінетичної енергії, щоб дозволити їм подолати міжмолекулярні сили притягання. Чим сильніше привабливі сили, тим більше енергії потрібно для їх подолання. Тверді речовини, які дуже впорядковані, мають найсильніші міжмолекулярні взаємодії, тоді як гази, які дуже невпорядковані, мають найслабші. Таким чином, будь-який перехід від більш впорядкованого стану до менш впорядкованого стану (тверде до рідкого, від рідини до газу або твердого до газу) вимагає введення енергії;ΔH є позитивним (ендотермічним). І навпаки, будь-який перехід від менш впорядкованого стану в більш впорядкований стан (рідина до твердого, газ до рідини або газ до твердого) вивільняє енергію;ΔH є негативним (екзотермічним). Зміна енергії, пов'язана з кожним загальним зміною фази, показана на малюнку8.1.2.
ΔHє позитивним для будь-якого переходу від більш впорядкованого стану до менш впорядкованого стану і негативним для переходу від менш впорядкованого стану до більш впорядкованого стану.
Раніше ми визначали зміни ентальпії, пов'язані з різними хімічними і фізичними процесами. Точки плавлення та молярні ентальпії плавлення (ΔHfus), енергія, необхідна для перетворення з твердої речовини в рідину, процес, відомий як плавлення (або плавлення), а також нормальні температури кипіння та ентальпії випаровування (ΔHvap) обраних сполук наведені в табл8.1.1.
| Речовина | Температура плавлення (° C) | ΔH фус (кДж/моль) | Температура кипіння (° C) | ΔH вап (кДж/моль) |
|---|---|---|---|---|
| N 2 | −210.0 | 0,71 | −195,8 | 5.6 |
| HCl | −114.2 | 2.00 | −85.1 | 16.2 |
| Бр 2 | −7.2 | 10.6 | 58.8 | 30.0 |
| ККл 4 | −22,6 | 2.56 | 76.8 | 29.8 |
| СН 3 СН 2 ОН (етанол) | −114.1 | 4.93 | 78.3 | 38.6 |
| СН 3 (СН 2) 4 СН 3 (н-гексан) | −95.4 | 13.1 | 68.7 | 28.9 |
| Н 2 О | 0 | 6.01 | 100 | 40.7 |
| Na | 97.8 | 2.6 | 883 | 97.4 |
| NaF | 996 | 33.4 | 1704 | 176.1 |
Речовини з найвищими температурами плавлення зазвичай мають найвищі ентальпії плавлення; вони, як правило, є іонними сполуками, які утримуються разом дуже сильними електростатичними взаємодіями. Речовини з високими температурами кипіння - це речовини з сильними міжмолекулярними взаємодіями, які необхідно подолати, щоб перетворити рідину в газ, що призводить до високих ентальпій випаровування. Ентальпія випаровування даної речовини набагато більше, ніж її ентальпія злиття, оскільки для повного відділення молекул (перетворення з рідини в газ) потрібно більше енергії, ніж для того, щоб дозволити їм лише вільно рухатися повз один одного (перетворення з твердої речовини в рідину).