4.4: Координатні ковалентні зв'язки
- Page ID
- 21520
- Опишіть різницю між ковалентним зв'язком і координатним ковалентним зв'язком.
- Визначити молекули, які утворюють координатні ковалентні зв'язки.
Пам'ятайте, коли ви були молодшими, і вам сказали поділитися улюбленою іграшкою з братом, сестрою чи другом? Ви, напевно, не хотіли ділитися, але все одно зробили. Швидше за все виявилося, що вам було веселіше грати з іграшкою разом, ніж якби ви зберігали її при собі. Атоми часто діляться електронами з іншими атомами, які не мають нічого, щоб сприяти ситуації, утворюючи координатний ковалентний зв'язок; кінцевим результатом є нова структура.
Координатні ковалентні зв'язки
Кожна з ковалентних зв'язків, яку ми розглядали до цих пір, включала кожен з атомів, які зв'язуються, сприяючи одному з електронів у спільну пару. Існує альтернативний тип ковалентного зв'язку, в якому один з атомів забезпечує обидва електрони в спільній парі. Окис вуглецю - це токсичний газ\(\ce{CO}\), який виділяється як побічний продукт під час спалювання викопного палива. Про зв'язок між\(\ce{C}\) атомом і\(\ce{O}\) атомом можна подумати в наступній процесії:
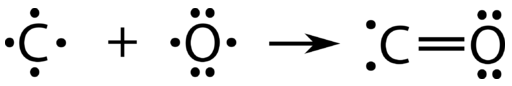
У цей момент між двома атомами утворився подвійний зв'язок, причому кожен атом забезпечує один з електронів кожному зв'язку. Атом кисню тепер має стабільний октет електронів, але атом вуглецю має лише шість електронів і нестабільний. Ця ситуація вирішується, якщо атом кисню вносить одну зі своїх одиноких пар, щоб зробити третю зв'язок з атомом вуглецю.
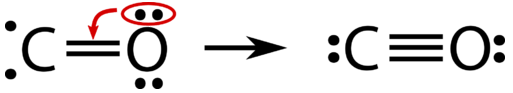
Молекула чадного газу правильно представлена потрійним ковалентним зв'язком між атомами вуглецю і кисню. Однією з утворених зв'язків є координатна ковалентна зв'язок, ковалентна зв'язок, в якій один з атомів вносить обидва електрони в спільній парі. Після формування координатний ковалентний зв'язок такий же, як і будь-який інший ковалентний зв'язок. Це не так, як якщо б дві умовні зв'язки в\(\ce{CO}\) молекулі сильніші або відрізняються будь-яким іншим способом, ніж координатний ковалентний зв'язок.
Електронно-дефіцитні молекули, як\(\ce{BF3}\), дуже реактивні і часто поєднуються з іншими молекулами, утворюючи координатні ковалентні зв'язки. Центральний атом бору в\(\ce{BF3}\) не має восьми електронів, і тому дуже реактивний. Він може легко поєднуватися з молекулою, що містить центральний атом з самотньою парою електронів. Наприклад,\(\ce{NH3}\) реагує з\(\ce{BF3}\) тим, що самотня пара на азоті може бути розділена з атомом бору:
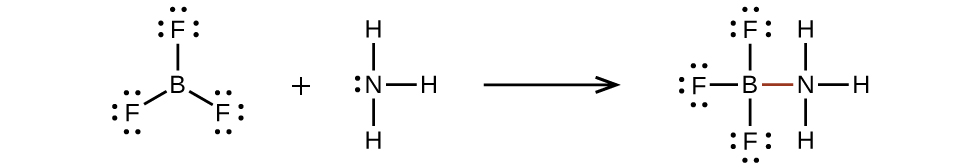
Резюме
- Координатні ковалентні зв'язки можуть утворюватися, коли один атом забезпечує зв'язок самотньою парою електронів.
- Координатні ковалентні зв'язки такі ж міцні, як і інші ковалентні зв'язки.
Рецензія
- Звідки береться третя ковалентна зв'язок в молекулі СО?
- Чому неправильна структура для СО вище неправильна?
- Чи є координатні ковалентні зв'язки сильніше або слабкіше звичайних ковалентних зв'язків?