4.2: Ковалентні зв'язки та Періодична таблиця
- Page ID
- 21494
Цілі навчання
- Прогнозуйте кількість ковалентних зв'язків, що утворилися на основі задіяних елементів і їх положення на таблиці Менделєєва.
- Опишіть важливі винятки з правила октету.
Двоатомні молекули, такі як водень (\(\ce{H2}\)\(\ce{Cl2}\)), хлор (), фтор (\(\ce{F2}\)) тощо, що містять ковалентні зв'язки між двома однотипними атомами, є лише кількома прикладами величезної кількості молекул, які можуть утворюватися. Два різних атома також можуть ділитися електронами і утворювати ковалентні зв'язки. Наприклад, вода, (\(\ce{H2O}\)), має дві ковалентні зв'язку між одним атомом кисню і двома атомами водню. Аміак, (\(\ce{NH3}\),, являє собою центральний атом азоту, пов'язаний з трьома атомами водню. Метан - це єдиний атом вуглецю\(\ce{CH4}\), ковалентно пов'язаний з чотирма атомами водню. У цих прикладах центральні атоми утворюють різну кількість зв'язків з атомами водню, щоб завершити їх валентну підоболонку та сформувати октети.
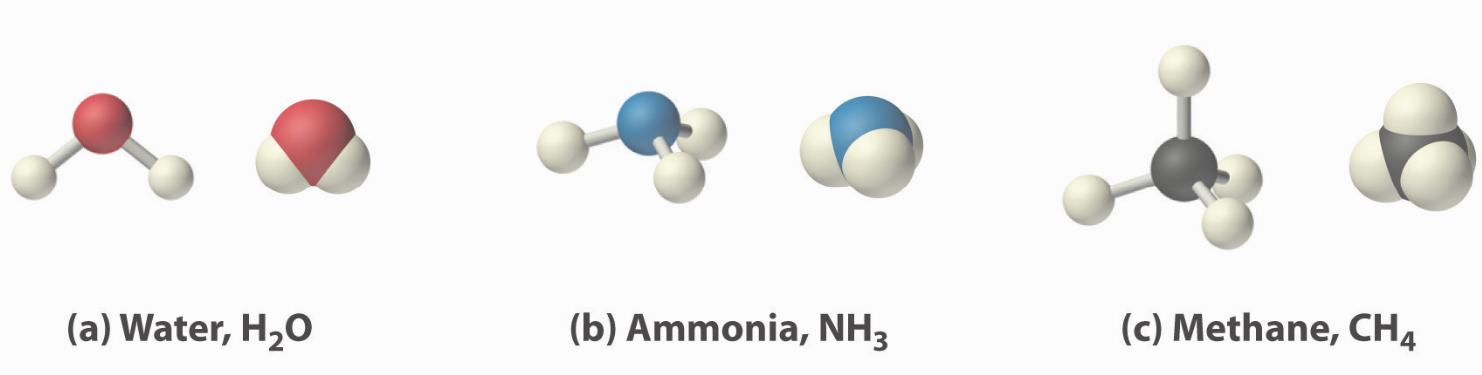
Скільки формуються ковалентні зв'язки?
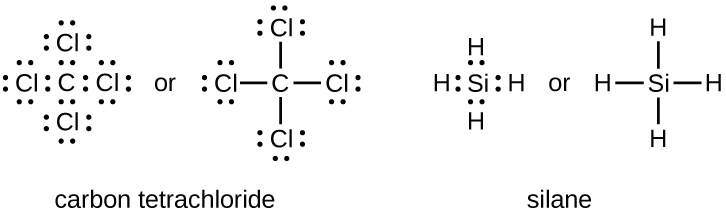
Кількість зв'язків, які може утворити атом, часто можна передбачити за кількістю електронів, необхідних для досягнення октету (вісім валентних електронів); особливо це стосується неметалів другого періоду періодичної таблиці (C, N, O і F). Наприклад, кожен атом елемента групи 14 має чотири електрони у своїй зовнішній оболонці і тому вимагає ще чотирьох електронів, щоб досягти октету. Ці чотири електрони можна отримати шляхом формування чотирьох ковалентних зв'язків, як показано тут для вуглецю в CcL 4 (тетрахлорид вуглецю) та кремнію в SiH 4 (силан). Оскільки водню потрібні лише два електрони, щоб заповнити свою валентну оболонку, це виняток із правила октету і повинен сформувати лише один зв'язок. Перехідні елементи і внутрішні перехідні елементи також не дотримуються правила октета, оскільки в їх валентних оболонках беруть участь електрони d і f.
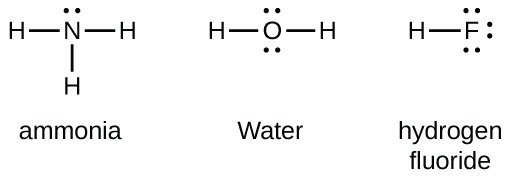
Елементи групи 15, такі як азот, мають п'ять валентних електронів в атомному символі Льюїса: одна одинока пара і три непарних електронів. Для отримання октету ці атоми утворюють три ковалентні зв'язку, як у NH 3 (аміак). Кисень і інші атоми групи 16 отримують октет шляхом формування двох ковалентних зв'язків:
Кількість електронів, необхідних для отримання октету, визначає кількість ковалентних зв'язків, які може утворити атом. Це підсумовано в таблиці нижче. У кожному випадку сума кількості зв'язків і кількості одиноких пар дорівнює 4, що еквівалентно восьми (октетам) електронів.
| Атом (номер групи) | Кількість облігацій | Кількість самотніх пар |
|---|---|---|
| Вуглець (група 14) | 4 | 0 |
| Азот (група 15) | 3 | 1 |
| Кисень (група 16) | 2 | 2 |
| Фтор (17 група) | 1 | 3 |
Оскільки водню потрібно лише два електрони, щоб заповнити його валентну оболонку, він дотримується правила дуету. Водень потрібно лише сформувати один зв'язок, щоб завершити дует електронів. Це причина, чому H завжди є кінцевим атомом і ніколи не центральним атомом.
Приклад\(\PageIndex{1}\)
Вивчіть структуру Льюїса з ОФ 2 нижче. Підрахуйте кількість зв'язків, утворених кожним елементом. Виходячи з розташування елемента в таблиці Менделєєва, чи відповідає він очікуваній кількості зв'язків, показаних у таблиці 4.1? Чи відповідає наведена нижче структура Льюїса правилу октету?
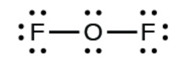
Рішення
Так. F (група 7А) утворює один зв'язок, а О (група 6А) утворює 2 зв'язку. Кожен атом оточений 8 електронами. Така будова задовольняє правилу октета.
Вправа\(\PageIndex{1}\)
Вивчіть структуру Льюїса NCl 3 нижче. Підрахуйте кількість зв'язків, утворених кожним елементом. Виходячи з розташування елемента в таблиці Менделєєва, чи відповідає він очікуваній кількості зв'язків, показаних у таблиці 4.1? Чи відповідає наведена нижче структура Льюїса правилу октету?
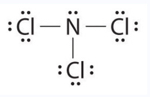
- Відповідь
-
І Cl, і N утворюють очікувану кількість облігацій. Cl (група 7A) має одну зв'язок і 3 одинокі пари. Центральний атом N (група 5А) має 3 зв'язку і одну одиночну пару. Так, структура Льюїса NCl 3 слідує правилу октету.
Винятки правила октету
Настільки ж важливим і корисним, як правило октету в хімічному зв'язку, існує багато ковалентних молекул з центральними атомами, які не мають восьми електронів у своїх структурах Льюїса. Це не означає, що правило октету марне - зовсім навпаки. Як і у багатьох правилах, є винятки, або порушення. Ці молекули діляться на три категорії:
- Молекули непарних електронів мають непарну кількість валентних електронів, а тому мають непарний електрон.
- Електронно-дефіцитні (зменшений октет) молекули мають центральний атом, який має менше електронів, ніж потрібно для конфігурації благородного газу.
- Розширені октетні (гіпервалентні) молекули мають центральний атом, який має більше електронів, ніж потрібно для конфігурації благородного газу.
Молекули непарних електронів
Хоча їх мало, деякі стабільні сполуки, часто звані вільними радикалами, мають непарну кількість електронів в своїх валентних оболонках. При непарній кількості електронів хоча б одному атому в молекулі доведеться порушувати правило октета. Прикладами стабільних, непарних електронів молекул є\(\ce{NO}\)\(\ce{NO2}\),, і\(\ce{ClO2}\). Електронна точкова діаграма Льюїса для\(\ce{NO}\), з'єднання, виробленого в двигунів внутрішнього згоряння, коли кисень і азот реагують при високих температурах, виглядає наступним чином:
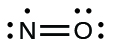
Як бачите, азот і кисень поділяють між собою чотири електрони. Атом кисню має октет електронів, але атом азоту має лише сім валентних електронів, два електрони в подвійному зв'язку, одну одиночну пару та один додатковий одиночний електрон. Хоча\(\ce{NO}\) is a stable compound, it is very chemically reactive, as are most other odd-electron compounds.
Electron-deficient molecules
These stable compounds have less than eight electrons around an atom in the molecule, i.e. they have less than an octet. The most common examples are the covalent compounds of beryllium and boron. For example, beryllium can form two covalent bonds, resulting in only four electrons in its valence shell:
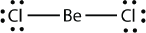
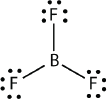
Boron commonly makes only three covalent bonds, resulting in only six valence electrons around the \(\ce{B}\) atom. A well-known example is \(\ce{BF3}\):
Expanded Octet Molecules
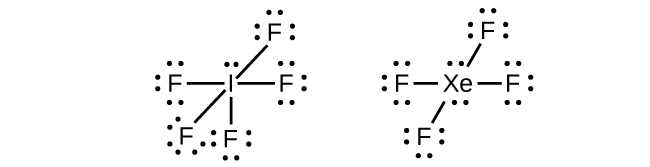
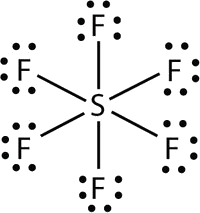
Elements in the second period of the periodic table (n = 2) can accommodate only eight electrons in their valence shell orbitals because they have only four valence orbitals (one 2s and three 2p orbitals). Elements in the third and higher periods (n ≥ 3) have more than four valence orbitals and can share more than four pairs of electrons with other atoms because they have empty d orbitals in the same shell. Molecules formed from these elements have expanded octets and are sometimes called hypervalent molecules. Phosphorous pentachloride shares five pairs of electrons for a total of ten electrons in the valence shell.

In some expanded octet molecules, such as IF5 and XeF4, some of the electrons in the outer shell of the central atom are lone pairs:
Identify each violation to the octet rule by drawing a Lewis electron dot diagram.
- \(\ce{ClO}\)
- \(\ce{SF6}\)
Solution
- With one Cl atom and one O atom, this molecule has 6 + 7 = 13 valence electrons, so it is an odd-electron molecule. A Lewis electron dot diagram for this molecule is as follows:
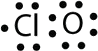
- In \(\ce{SF6}\), the central \(\ce{S}\) atom makes six covalent bonds to the six surrounding F atoms, so it is an expanded valence shell molecule. Its Lewis electron dot diagram is as follows:
Identify the violation to the octet rule in \(\ce{XeF2}\) by drawing a Lewis electron dot diagram.
- Answer
-
The Xe atom has an expanded valence shell with more than eight electrons around it.

Concept Review Exercises
-
How is a covalent bond formed between two atoms?
-
How does covalent bonding allow atoms in group 6A to satisfy the octet rule?
Answers
-
Covalent bonds are formed by two atoms sharing electrons.
-
The atoms in group 6A make two covalent bonds.