4.1: Ковалентні облігації
- Page ID
- 21493
Цілі навчання
- Опишіть, як утворюються ковалентні зв'язки за допомогою правила октета.
В іонних сполуках електрони переносяться між атомами різних елементів з утворенням іонів. Але це не єдиний спосіб, яким можуть утворюватися сполуки. Атоми також можуть створювати хімічні зв'язки, обмінюючись електронами між собою, щоб завершити свою зовнішню підоболонку вісьмома валентними електронами, дотримуючись правила октету. Такі зв'язки називаються ковалентними зв'язками, а атоми, утримувані ковалентними зв'язками, складають те, що називається молекулою.
Формування ковалентних зв'язків
Неметалеві атоми часто утворюють ковалентні зв'язки з іншими неметалевими атомами. Ковалентні зв'язки утворюються між двома атомами, коли обидва мають схожі тенденції до залучення електронів до себе (тобто коли обидва атоми мають однакові або досить схожі енергії іонізації та електронну спорідненість). Наприклад, два атоми водню ковалентно зв'язуються, утворюючи молекулу H 2; кожен атом водню в молекулі H 2 має два електрони, що стабілізують його, даючи кожному атому таку ж кількість валентних електронів, як благородний газ He.
Зв'язок у молекулі водню, виміряна як відстань між двома ядрами, становить близько 7,4 × 10 −11 м, або 74 пікометри (пм; 1 пм = 1 × 10 −12 м). Ця конкретна довжина зв'язку являє собою найменший потенційний енергетичний стан двох атомів водню і являє собою баланс між декількома силами: атракціони між протилежно зарядженими електронами і ядрами, відштовхування між двома негативно зарядженими електронами, і відштовхування між двома позитивно зарядженими ядрами.
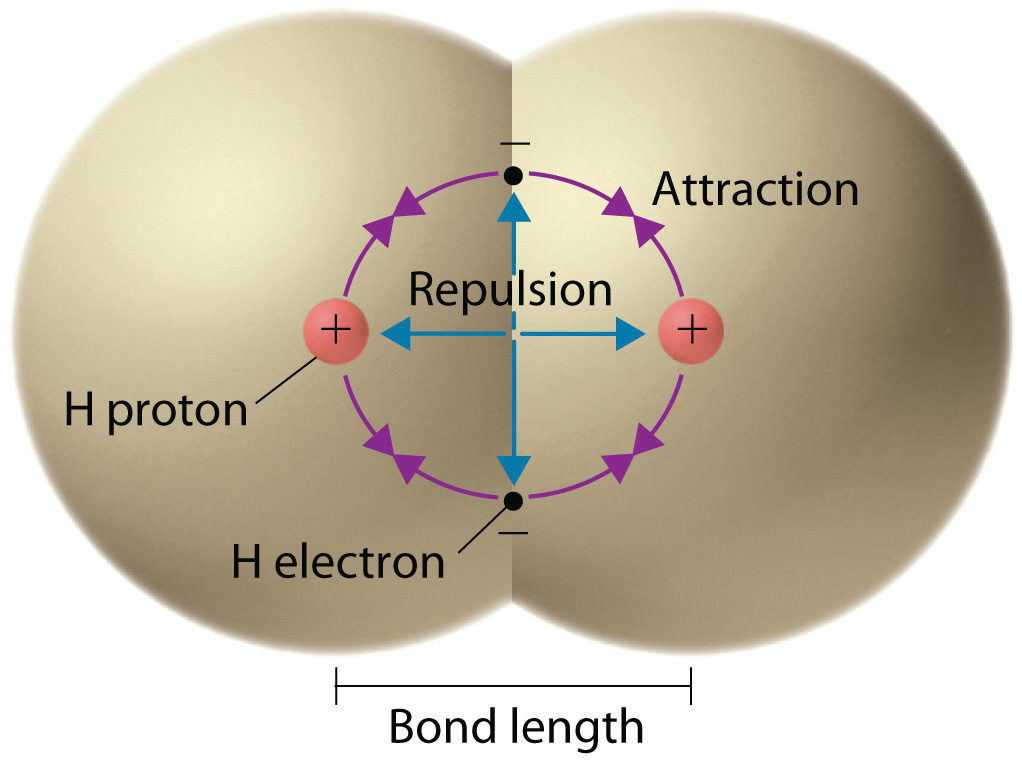
Графік потенційної енергії системи в залежності від міжядерної відстані (рис.\(\PageIndex{2}\)) показує, що енергія зменшується, коли два атоми водню рухаються назустріч один одному. Починаючи з крайнього правого краю, ми маємо два окремих атома водню з певною потенційною енергією, позначені червоною лінією. Уздовж осі x - відстань між двома атомами. Коли два атоми наближаються один до одного (рухаючись вліво вздовж осі х), їх валентні орбіталі (1 с) починають перекриватися. Поодинокі електрони на кожному атомі водню потім взаємодіють з обома атомними ядрами, займаючи простір навколо обох атомів. Сильне тяжіння кожного спільного електрона до обох ядер стабілізує систему, а потенційна енергія зменшується у міру зменшення відстані зв'язку. Якщо атоми продовжують наближатися один до одного, позитивні заряди в двох ядрах починають відштовхуватися один одного, а потенційна енергія збільшується.
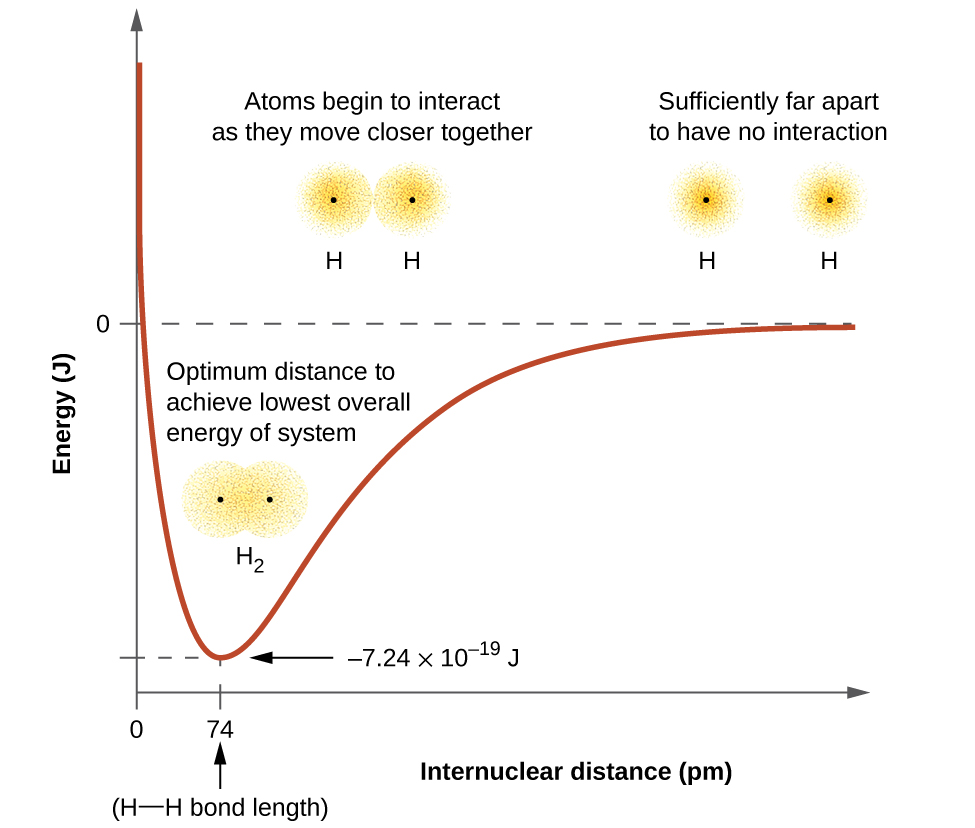
Малюнок\(\PageIndex{2}\): Взаємодія двох атомів водню змінюється в залежності від відстані. Енергія системи змінюється в міру взаємодії атомів. Найнижча (найбільш стабільна) енергія відбувається на відстані 74 вечора, що є довжиною зв'язку, що спостерігається для молекули Н 2.
Льюїс Структури
Хіміки часто використовують структури Льюїса для представлення ковалентного зв'язку в молекулярних речовині. Наприклад, символи Льюїса двох окремих атомів водню такі:

Структури Льюїса двох атомів водню, що діляться електронами, виглядають так:

Ми можемо використовувати кола, щоб показати, що кожен атом H має два електрони навколо ядра, повністю заповнюючи валентну оболонку кожного атома:
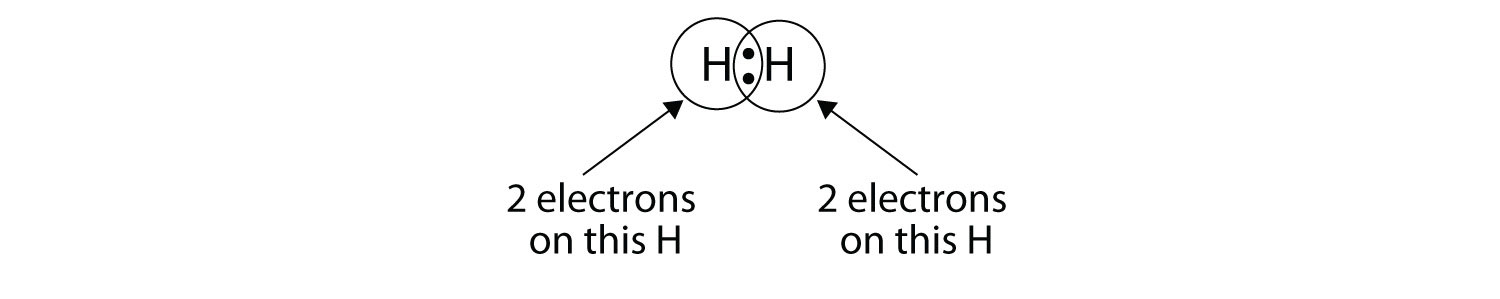
Оскільки кожен атом Н має заповнену валентну оболонку, цей зв'язок стабільний, і ми створили двоатомну молекулу водню. Заради простоти прийнято представляти ковалентний зв'язок тире, а не двома крапками:
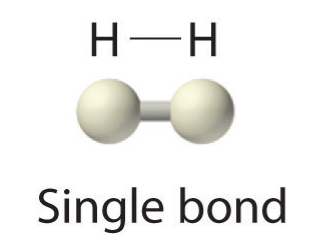
Оскільки два атоми поділяють одну пару електронів, цей ковалентний зв'язок називається єдиним зв'язком. Як інший приклад розглянемо фтор. Атоми F мають сім електронів в валентній оболонці:
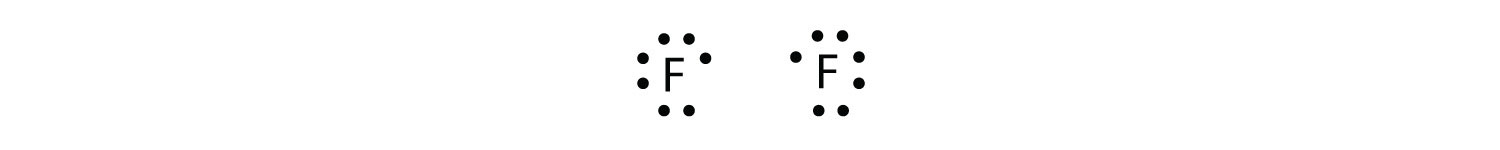
Ці два атоми можуть робити те саме, що і атоми Н; вони поділяють свої непарні електрони, щоб створити ковалентний зв'язок.

Зверніть увагу, що кожен атом F має повний октет навколо нього зараз:
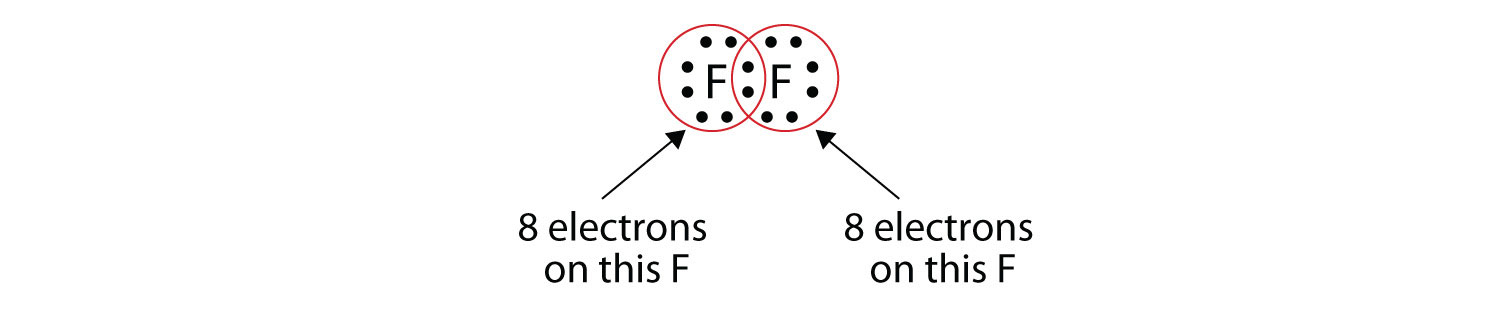
Ми також можемо написати це за допомогою тире для представлення спільної електронної пари:
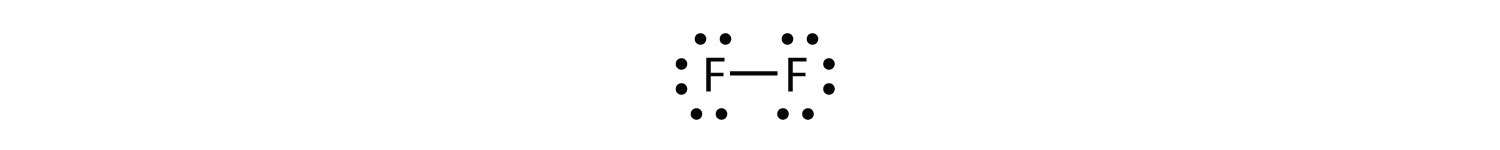
Ви помітите, що в двоатомній молекулі фтору є два різних типи електронів. Зв'язуюча електронна пара робить ковалентний зв'язок. Кожен атом F має три інші пари електронів, які не беруть участі в зв'язку; вони називаються одинокими парними електронами. Кожен атом F має одну сполучну пару і три одинокі пари електронів.
Двоатомні молекули
Водень (\(\ce{H2}\)) і фтор (\(\ce{F2}\)) обидва описані як двоатомні молекули. Ці елементи та інші (див. Таблицю\(\PageIndex{1}\)) існують природним шляхом як молекули, а не як окремі атоми. Важливо відзначити, що назви цих елементів представляють молекули, а не окремі атоми. При описі одного атома, а не молекули, використовується слово атом.
| Водень (1\(\ce{H2}\)) | Кисень (\(\ce{O2}\)) | Азот (\(\ce{N2}\)) | Фтор (1\(\ce{F2}\)) |
|---|---|---|---|
| \ (\ ce {H2}\)) ">Хлор (\(\ce{Cl2}\)) | \ (\ ce {O2}\)) ">Бром (\(\ce{Br2}\)) | \ (\ ce {N2}\)) ">Йод (\(\ce{I2}\)) | \ (\ ce {F2}\)) "> |