3.4: Періодичні властивості та утворення іонів
- Page ID
- 21580
Цілі навчання
- Опишіть енергію іонізації та спорідненість електронів та те, як це стосується тенденцій утворення іонів.
Ми бачили, що елементи часто набирають або втрачають достатню кількість електронів для досягнення валентної електронної конфігурації найближчого благородного газу. Чому це так? У цьому розділі розроблено більш кількісний підхід до прогнозування таких реакцій шляхом дослідження періодичних тенденцій енергетичних змін, які супроводжують іонноутворення.
Енергія іонізації
Оскільки атоми не спонтанно втрачають електрони, потрібна енергія для видалення електрона з атома, щоб утворити катіон. Хіміки визначають енергію іонізації (\(IE\)) елемента як кількість енергії, необхідної для видалення електрона з газоподібного атома\(A\) в його основному стані. \(IE\)тому енергія, необхідна для реакції:
\[ A(g) \rightarrow A^+(g) + e^- \;\;\ \text{energy required=IE } \label{3.4.1}\]
Оскільки потрібно введення енергії, енергія іонізації завжди позитивна (\(IE > 0\)) для реакції, як написано в Рівнянні\(\PageIndex{1}\). Більші значення (\(IE\)) означають, що електрон більш щільно пов'язаний з атомом і, таким чином, важче видаляється. Типовими одиницями енергії іонізації є кілоджоуль/моль (кДж/моль) або електронвольт (еВ):
\[1\; eV / atom = 96.49\; kJ/mol\]
Коли ви рухаєтеся по ряду в таблиці Менделєєва, енергії іонізації, як правило, збільшуються. Це означає, що елементи з лівого боку таблиці Менделєєва втрачають електрони легше (для видалення електрона потрібно менше енергії), ніж ті, що знаходяться в правій частині таблиці Менделєєва. Тенденцію в енергії іонізації можна пояснити, розглянувши тенденцію в атомному радіусі (пояснено в попередньому розділі). У міру переміщення зліва направо по таблиці Менделєєва, розмір атома зменшується і електростатичні взаємодії між ядром і валентними електронами збільшується, що збільшує енергію, необхідну для видалення електронів, таким чином (\(IE\)) збільшується.
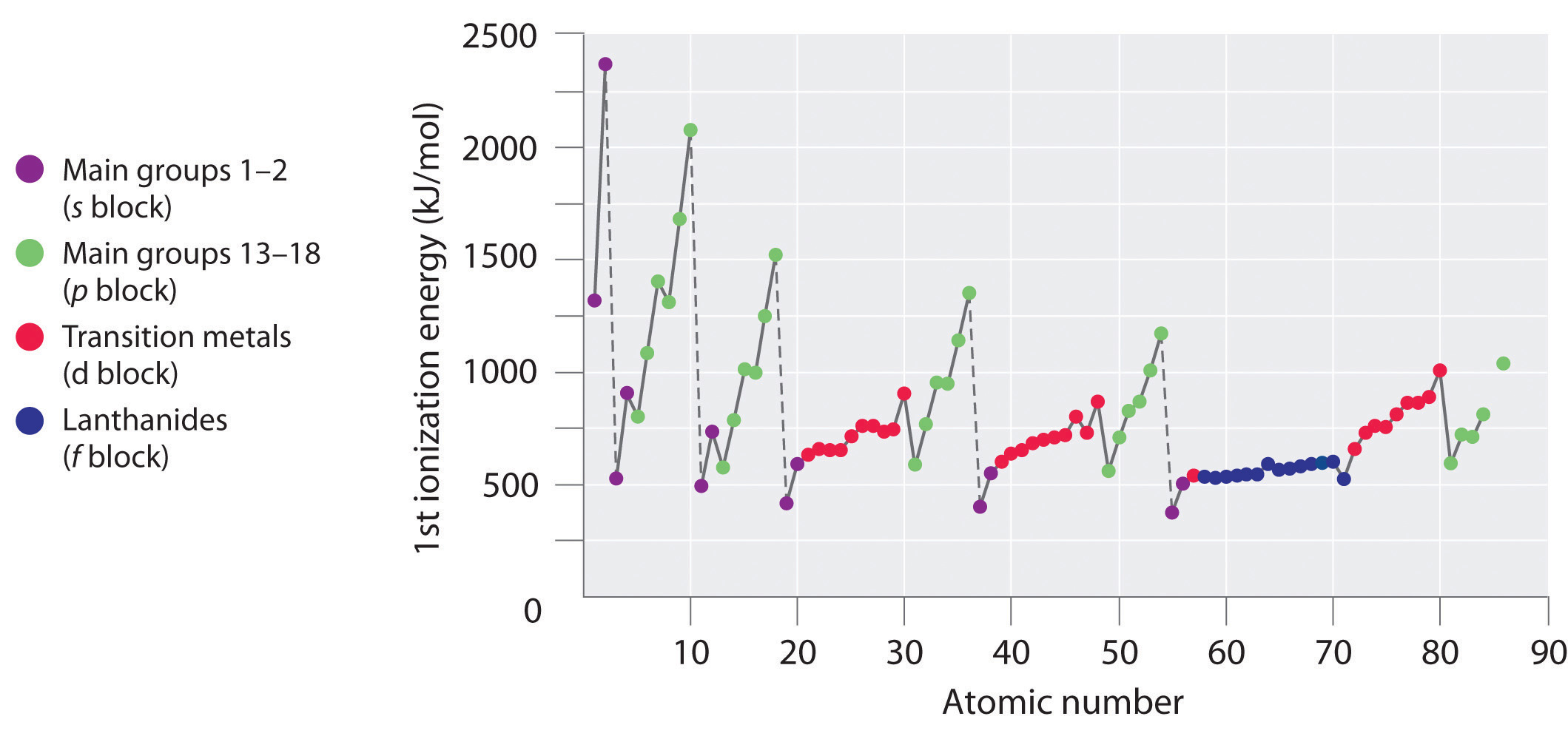
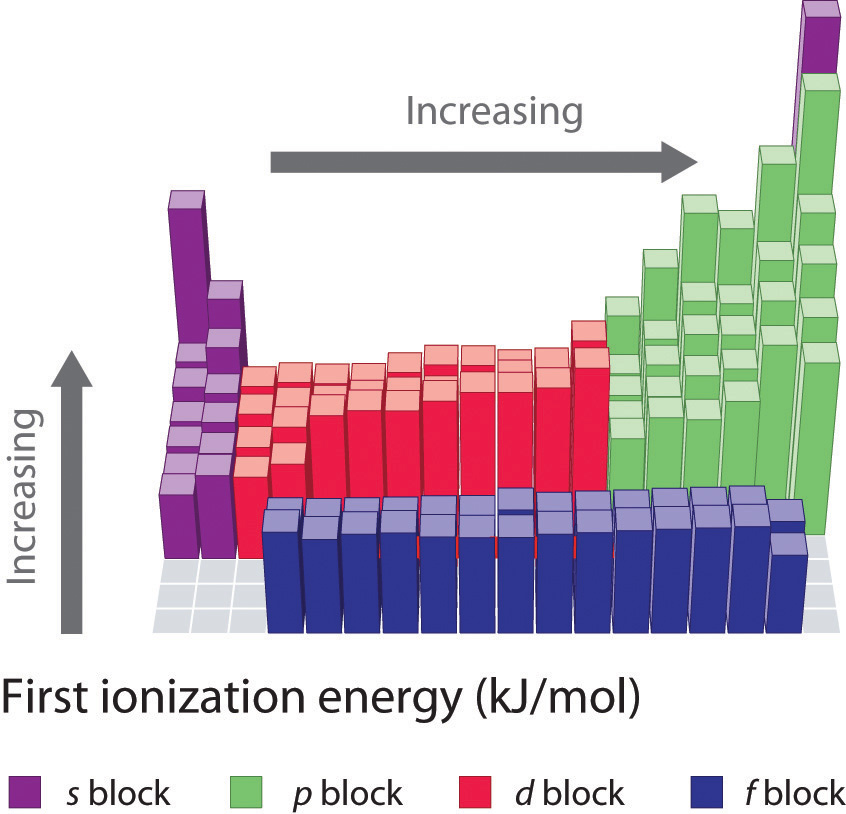
Якщо ви уважно подивитеся на тенденції в енергії іонізації, ви помітите, що є деякі «винятки», де ви бачите зниження енергії, а не збільшення. У періодах 1 та 2 ви можете побачити це зменшення (\(IE\)) між групами 2 та 3 і знову між групами 5 та 6. Ці зміни в тренді можна додатково пояснити, уважно розглядаючи електронні конфігурації розглянутих атомів. У міру переходу від магнію до алюмінію до підоболонки 3 р додається один електрон. Цей електрон 3 р знаходиться трохи далі від ядра (вище за енергією) і, отже, легше видалити порівняно з електронами 3 s. Зниження між фосфором і сіркою відбувається тому, що доданий електрон в сірці є першим, хто парний в p підоболонці. Ці два електрони в одній орбіталі p відштовхуються один від одного, роблячи атом сірки трохи менш стабільним, ніж можна було б очікувати інакше, як це стосується всіх елементів групи 16. Цей електрон легше видалити, оскільки це призведе до більшої стабільності.
Приклад\(\PageIndex{1}\): Найнижча перша енергія іонізації
Використовуйте їх розташування в таблиці Менделєєва, щоб передбачити, який елемент має найнижчу першу енергію іонізації: Ca, K, Mg, Na, Rb або Sr.
Дано: шість елементів
Запитано: елемент з найменшою першою енергією іонізації
Стратегія:
Знайдіть елементи в таблиці Менделєєва. Виходячи з тенденцій енергій іонізації по ряду і вниз по колонці, визначити елемент з найменшою першою енергією іонізації.
Рішення:
Ці шість елементів утворюють прямокутник у двох крайніх лівих стовпцях таблиці Менделєєва. Оскільки ми знаємо, що енергії іонізації збільшуються зліва направо поспіль і знизу вгору стовпця, ми можемо передбачити, що елемент у нижній лівій частині прямокутника матиме найнижчу першу енергію іонізації: Rb.
Вправа\(\PageIndex{1}\): Найвища перша енергія іонізації
Використовуйте їх розташування в таблиці Менделєєва, щоб передбачити, який елемент має найвищу першу енергію іонізації: As, Bi, Ge, Pb, Sb або Sn.
- Відповідь
-
\(\ce{As}\)
спорідненість до електронів
Електронна спорідненість (\(EA\)) елемента\(A\) визначається як зміна енергії, що відбувається при додаванні електрона до газоподібного атома або іона:
\[ A(g)+e^- \rightarrow A^-(g) \;\;\; \text{energy change=}EA \label{7.5.1}\]
На відміну від енергій іонізації, які завжди є позитивними для нейтрального атома, оскільки енергія потрібна для видалення електрона, спорідненість електронів може бути негативною (енергія виділяється при додаванні електрона), позитивною (енергія повинна бути додана до системи для отримання аніону) або нульовим (процес енергетично нейтральний). Цей знак умовності узгоджується з негативним значенням, відповідним зміні енергії для екзотермічного процесу, який є таким, при якому виділяється тепло (рис.\(\PageIndex{2}\)).
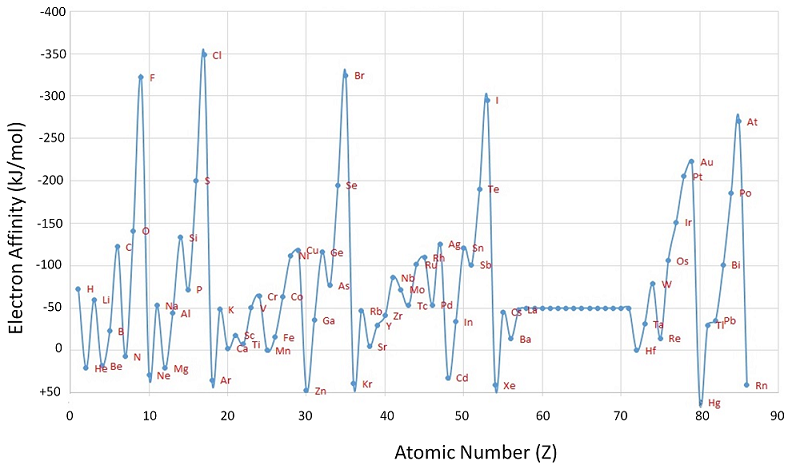
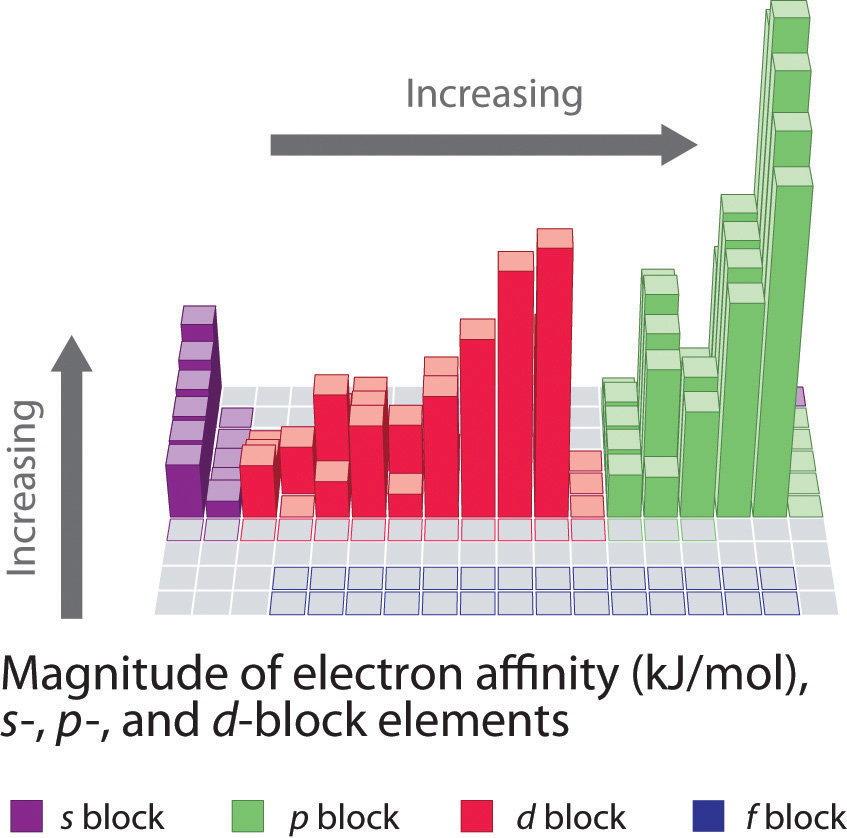
Атом хлору має найбільш негативну електронну спорідненість будь-якого елемента, а це означає, що при додаванні електрона до газоподібного атома хлору виділяється більше енергії, ніж до атома будь-якого іншого елемента:
\[ \ce{ Cl(g) + e^- \rightarrow Cl^- (g)} \;\;\; EA=-346\; kJ/mol \label{7.5.2}\]
На відміну від цього, берилій не утворює стійкого аніону, тому його ефективна електронна спорідненість
\[ \ce{ Be(g) + e^- \rightarrow Be^- (g)} \;\;\; EA \ge 0 \label{7.5.3}\]
Загалом, електронні спорідненості елементів основної групи стають менш негативними, коли ми йдемо вниз по колонці. Це пов'язано з тим, що зі збільшенням енергетичного рівня зайві електрони потрапляють на орбіталі, які все більш далекі від ядра, і отримати зайві електрони, що утворюють аніони, менш легко.
Приклад\(\PageIndex{2}\): Контрастні електронні спорідненості Sb, Se та Te
Виходячи з їхніх позицій у періодичній таблиці, який із Sb, Se або Te ви передбачили б мати найбільш негативну спорідненість електронів?
Дано: три елементи
Запитано: елемент з найбільшою негативною спорідненістю електронів
Стратегія:
- Знайдіть елементи в таблиці Менделєєва. Використовуйте тенденції електронної спорідненості, що спускаються вниз по колонці для елементів тієї ж групи. Аналогічно використовуйте тенденції спорідненості електронів зліва направо для елементів у тому ж рядку.
- Помістіть елементи в порядку, перерахувавши спочатку елемент з найбільш негативною спорідненістю електронів.
Рішення:
Ми знаємо, що спорідненість електронів стає менш негативною, спускаючись вниз по стовпчику (за винятком аномально низької електронної спорідненості елементів другого ряду), тому ми можемо передбачити, що електронна спорідненість Se є більш негативною, ніж Te. Ми також знаємо, що спорідненість електронів стає більш негативною зліва направо в рядку, і що елементи групи 15, як правило, мають значення, які є менш негативними, ніж очікувалося. Оскільки Sb розташований зліва від Te і належить до групи 15, ми прогнозуємо, що електронна спорідненість Te є більш негативною, ніж Sb. Загальний порядок Se < Te < Sb, тому Se має найбільш негативну спорідненість електронів серед трьох елементів.
Вправа\(\PageIndex{2}\): Контрастні електронні спорідненості Rb, Sr та Xe
Виходячи з їхніх позицій у періодичній таблиці, які з Rb, Sr або Xe ви передбачили б, швидше за все, сформувати газоподібний аніон?
- Відповідь
-
Рб