7.7: Ідеальний закон газу
- Page ID
- 25525
Комбіновані співвідношення між тиском, об'ємом, температурою та кількістю газів
Описані вище газові закони дають наступні співвідношення між об'ємом\(V\)\(P\), тиском, температурою в\(T\) кельвіні і кількістю газу в молі\(n\):
\(V \propto 1 / {P}\), при постійному\(T\) і\(n\),
\(V\propto T\), при постійному\(P\) і\(n\), і
\(V \propto n\), при постійному\(T\) і\(P\).
Три пропорції поєднуються, щоб дати наступне співвідношення ідеального газу:
\[V \propto \frac{nT}{P}\nonumber\]
пропорційність змінюється до рівняння шляхом введення константи пропорційності:
\[V=\frac{n R T}{P}\nonumber\], що переставляє туди,\[P V=n R T \nonumber\]
де\(R\) знаходиться постійною пропорційності називають константу газу.
Рівняння:\(PV=n R T\) називається законом ідеального газу.
Значення\(R\) можна розрахувати по:\(R=\frac{P V}{n T}\), де\(n\) кількість газу в моль,\(T\) це температура в кельвіні, це тиск,\(P\) який може бути в різних одиницях, і\(V\) це обсяг, який може бути в різних одиницях. Значення\(R\) в різних одиницях\(P\)\(V\), а\(PV\) вироби наведені в таблиці 1. Якщо значення будь-яких трьох серед\(P, V, n\), і\(T\) відомі, то значення четвертого можна обчислити, використовуючи закон ідеального газу.
У цих розрахунках одиниці\(R\) повинні бути узгоджені з одиницями\(P, V, n\), і\(T\). Якщо вони не узгоджені, дана одиниця і\(T\) повинна бути перетворена для узгодження з одиницями\(R\).\(P, V, n\)
|
Значення |
Одиниці |
|---|---|
|
0.08206 |
L-атм/мол-К |
|
8.314 |
Дж/моль-к |
|
1,987 |
Кал/моль-К |
|
8.314 |
м 3 -Па/мол-К |
|
62.36 |
L-торр/мол-К |
Ідеальне рівняння газу в перебудованій формі\(\frac{P V}{n T}=R\) є постійною, що означає, що:
\[\frac{P_{1} V_{1}}{n_{1} T_{1}}=\frac{P_{2} V_{2}}{n_{2} T_{2}}=R\nonumber\]
Якщо один або два параметри в\(\frac{P_{1} V_{1}}{n_{1} T_{1}}=\frac{P_{2} V_{2}}{n_{2} T_{2}}\) рівнянні ідеального газу є постійними; вони скасовуються, залишаючи зв'язок між іншими параметрами, напр.
якщо\(n\) і\(T\) є постійними:\(P_{1} V_{1}=P_{2} V_{2}\), це закон Бойля,
якщо\(P\) і\(n\) є постійними:\(\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}\), це закон Чарльза,
якщо\(P\) і\(T\) є постійними:\(\frac{V_{1}}{n_{1}}=\frac{V_{2}}{n_{2}}\), це закон Авогадро,
якщо\(V\) і\(n\) є постійними:\(\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}\), це закон Гея Люссака,
якщо\(V\) і\(T\) є постійними:\(\frac{P_{1}}{n_{1}}=\frac{P_{2}}{n_{2}}\), тобто відношення тиску до кротів,
і якщо\(n\) постійний:\(\frac{P_{1} V_{1}}{T_{1}}=\frac{P_{2} V_{2}}{T_{2}}\), тобто комбінований закон газу.
Розрахувати обсяг 1.000 моль газу в літрах (л) при 0.000 о С і 1.000 атм?
Рішення: Дано\(n\) = 1.000 моль,\(T\) = 0 o C+273,15 = 273,15 К,\(P\) = 1.000 атм, і\(R\) = 0,08206 L-атм/моль-К
Рішення
Дано\(n\) = 1.000 моль,\(T\) = 0 о С+273,15 = 273,15 К,\(P\) =1.000 атм, і\(R\) = 0,08206 л атм/моль-К
Формула:\(PV=nRT\), змінити формулу на:\(V=\frac{n R T}{P}\).
Підключіть значення і розрахуйте:\(V=\frac{1.000 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-\mathrm{K}} \times 273.15 \mathrm{~K}}{1.000 \mathrm{~atm}}=22.41 \mathrm{~L}\)
Обсяг 1 моль ідеального газу становить 22,41 л при 0 о С і тиску 1 атм, як розраховано в наведеному вище прикладі
Розрахувати обсяг контейнера, який має 1,50 моль газу He при 7,2 атм і 25 о С?
Рішення
\(P\)=7,2 атм,\(V\) =? \(n\)= 1,50 моль,\(T\) = 25 о С} +273=298 К, R=0.08206\(\mathrm{~L}-\mathrm{atm} / \mathrm{mol}-\mathrm{K}\)
Формула:\(PV=nRT\), змінити формулу на:\(V=\frac{n R T}{P}\)
Підключіть значення і розрахуйте:\(V=\frac{1.50 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}{7.2 \mathrm{~atm}}=5.1 \mathrm{~L}\)
Розрахувати тиск в ємності 5.1 л, яка має 0,60 моль He при 25 o C?
Рішення
\(P\)=? ,\(V\) =5,1 л,\(n\) = 0,60 моль,\(T\) =25 о С+273=298 К,\(R=0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K}\)
Формула:\(PV=nRT\), переставляємо формулу, включаємо значення і обчислюємо:\(P=\frac{n R T}{V}=\frac{0.60 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L-atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}{5.1 \mathrm{~L}}=2.9 \mathrm{~atm}\)
Обчисліть тиск 0,60 моль He в прикладі 3 змішаного з 1,50 моль He в прикладі 2 в ємності об'ємом 5,1 л при 25 o С? Рішення
\(P_{total}\)=? ,\(n_{total}\) = 1,5 моль + 0,60 моль = 2,1 моль,\(V\) = 5,1 л, Т = 25 о С + 273 = 298 К, а\(R=0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K}\)
Формула:\(P_{\text {total }} V=n_{\text {total }} R T\), переставляємо, вставляємо значення і обчислюємо:\(P_{\text {total }}=\frac{n_{\text {total }} R T}{V}=\frac{2.1 \mathrm{~mol} \times 0.08206 \frac{L-a t m}{m o l-K} \times 298 \mathrm{~K}}{5.1 \mathrm{~L}}=10.1 \mathrm{~atm}\)
The\(P_{\text {total }}\) 2.1 моль Він у прикладі 4 дорівнює\(P\) 1,50 моль Він в прикладі 2+\(P\) 0,6 моль Він в прикладі 3, тобто 7,2 атм +2,9 атм = 10,1 атм. Цей розрахунок демонструє, що при змішуванні газів загальний тиск - це сума тисків, які буде чинити кожна фракція, якщо вона була одна в цьому просторі. Це демонструється змішуванням одного і того ж газу, тобто Він з Ним, але він залишається вірним, коли різні гази змішуються, доки всі задіяні гази підкоряються закону ідеального газу.
Молярний об'єм газів при стандартній температурі і тиску
Температура 0 о С і тиск 1 атм називається стандартною температурою і тиском (STP) для газів.
В даний час прийнятий STP становить 0 o C і 1 бар. Молярний обсяг ідеального газу при 0 о С і 1 бар дорівнює 22,71 л, але для більшості практичних цілей використовується більш старе визначення СТП 0 о С і 1 атм.
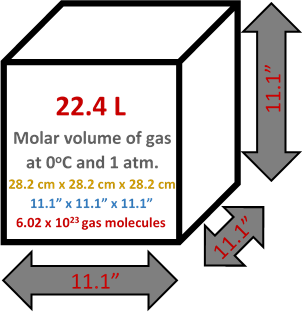
Розрахунки в прикладі 1 попереднього розділу показують, що молярний об'єм ідеального газу становить 22,41 л при СТП. Рис. 7.7.1 ілюструє молярний об'єм ідеального газу при STP.

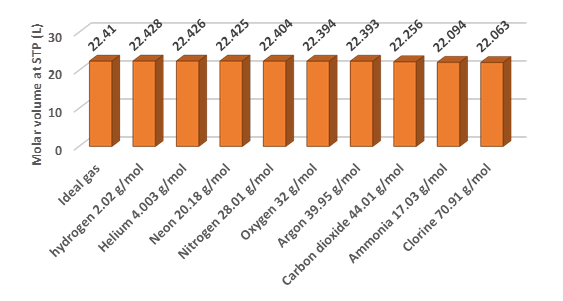
На рис. 7.7.2 показано, що молярний обсяг реальних газів дуже близький до обсягу ідеального газу. Невеликі відмінності між молярним об'ємом реальних газів та ідеальним газом полягають у тому, що ідеальні молекули газу мають незначний об'єм та незначні міжмолекулярні взаємодії. Справжні молекули газу мають певний обсяг і деякі міжмолекулярні взаємодії, які викликають відхилення реальних газів від ідеальної поведінки. Однак для практичних цілей розрахунки, засновані на законі ідеального газу, залишаються застосовними для більшості реальних газів в умовах навколишнього середовища.
Молярний обсяг газів при СТП - це рівність між числом молів і обсягом газу при СТП, тобто:
\[1 \text { mol gas }=22.4 \mathrm{~L} \text { gas at STP }\nonumber\]
Рівність дає два коефіцієнта перетворення, т. Е.
\[\frac{1 \text { mol gas }}{22.4 \mathrm{~L} \text { gas }}\text {, and }\frac{22.4 \mathrm{~L} \text { gas }}{1 \text { mol gas }} \text {.}\nonumber\]
Коефіцієнти перетворення використовуються для перетворення об'єму в молі і моль в об'єм газу відповідно при STP.
Розрахувати обсяг 64,0 г кисню при СТП?
Рішення
Дано: маса кисню = 55,2 м Необхідний: обсяг кисню =?
Стратегія: 1st перетворити грами кисню в молі кисню, використовуючи зворотну молярну масу як коефіцієнт перетворення, а потім перетворити молі кисню в об'єм кисню, використовуючи 2-й коефіцієнт перетворення, описаний вище:
\[\text { volume of oxygen }=64.0 \cancel{\mathrm{~g} \text { oxygen }} \times \frac{1 \cancel{\text { mol oxygen }}}{32 \cancel{\mathrm{~g} \text { of oxygen }}} \times \frac{22.41 \mathrm{~L}}{1 \cancel{\text { mol oxygen }}}=44.82 \mathrm{~L} \text { oxygen }\nonumber\]
