7.6: Співвідношення обсяг-сума
Малюнок7.6.1 ілюструє вплив кількості газу на обсяг. Додавання більшої кількості молекул газу збільшує частоту зіткнення молекул зі стінками, збільшуючи тиск газу. Газ розширюється для зниження тиску до тих пір, поки тиск газу в камері не буде дорівнює зовнішньому тиску.
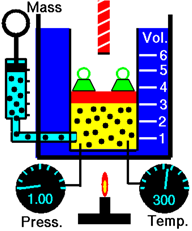
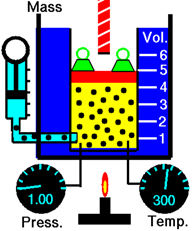
Закон Авогадро стверджує, що обсяг газу прямо пропорційний кількості газу в молі за умови, що температура і тиск газу не змінюються.
Математичні форми закону Авогадро наступні.
V∝n
або
V=kn
або
Vn=k
деV - обсяг,n - кількість молів, іk є постійною для газу в умовах постійної температури і тиску. ОскількиV/n є постійною, вона має на увазі, що:
V1n1=V2n2=k
деV1 іn1 є початковим об'ємом і початковим обсягом газу, відповідно іV2 іn2 є кінцевий обсяг і кінцева кількість газу в моль, за умови, що температура і тиск не змінюються.
Погодний балон, що містить3.0 родимки гелію, має обсяг66 L. Який кінцевий обсяг, якщо в нього додають2.0 родимки гелію. Тиск і температура газу не змінюються?
Рішення
ВраховуєтьсяV1=66L,n1=3.0 mol,V2=?,n2=3.0+2.0=5.0 mol
Формула:
V1n1=V2n2,
переставити формулу для виділення потрібної змінної:
V2=V1n2n1.
Підключіть значення і розрахуйте:
V2=66 L××5.0 mol3.0 mol=110 L.
