7.8: Закон Дальтона парціального тиску
- Page ID
- 25534
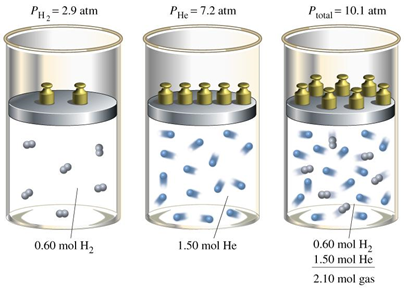
Розрахунки в прикладах 2 і 3 розділу 7.7 доводять, що 1,50 моль Він в камері 5.1 л чинить тиск 7,2 атм; 0,6 моль Він в тій же камері чинить тиск 2,9 атм, а суміш двох в одній камері при однаковій температурі надає тиск, рівний сумі тисків, які кожен фракція чинить, якщо вона одна в камері, т. Е\(P_{total} = 7.2 { atm} + 2.9 { atm} = 10.1 { atm}\). Що робити, якщо один з газів був водень, а інший гелій? Відповідь така: що розрахунки з використанням закону ідеального газу залишаються незмінними, оскільки це кількість молекул, а не тип молекул, які беруть участь у розрахунках. Властивості газів залежать від кількості молів газу\(n\), а не від характеру газу, як показано на рис.7.8.1.
Загальний тиск суміші газів дорівнює сумі тиску, яке чинив би кожен компонент газу в суміші, якби він був присутній окремо.
Математична форма закону Дальтона така:
\[P_{\text {tatal }}=P_{\text {He }}+P_{\text {exygen }}=9.3 \mathrm{~atm}+2.4 \mathrm{~atm}=11.5 \mathrm{~atm}\nonumber\]
, де\(P_{1}\)\(P_{2}\),\(P_{3}\) є парціальними тисками окремих газів #1, #2, #3 в суміші.
Атмосферне повітря являє собою суміш азоту, кисню, аргону, вуглекислого газу, водяних парів та трансової кількості деяких інших газів. Атмосферний тиск - це сума парціальних тисків компонентів повітря, як показано на рис.7.8.2.

Зразок 46 L He та 12 L O 2, як при 1.0 атм, так і 25 o C, були закачані в резервуар для підводного плавання 5.0 л при 25 o C. Обчисліть парціальний тиск кожного газу та загальний тиск у резервуарі?
Рішення
Для Він перед змішуванням:\(V\) = 46 л,\(T\) = 25 о С + 273 = 298 К,\(P\) = 1,0 атм,\(n_{He}\) =? ,\(R=0.08206 \frac{L-\mathrm{atm}}{\mathrm{mol}-K}\)
Формула і розрахунки:\(n_{\mathrm{He}}=\mathrm{PV} / \mathrm{RT}=\frac{1.0 \mathrm{~atm} \times 46 \mathrm{~L}}{0.08206 \frac{\mathrm{Latm}}{\mathrm{mol}-\mathrm{K}} \times 298 \mathrm{~K}}=1.9 \mathrm{~mol}\)
Для\(O_{2}\) перед змішуванням:\(V\) =12 л,\(T\) =25 о С + 273 =298 К,\(P\) =1,0 атм,\(n_{O_{2}}\) =? ,\(R=0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-\mathrm{K}}\)
Формула і розрахунки:\(n_{H_{2}}=\mathrm{PV} / \mathrm{RT}=\frac{1.0 \mathrm{~atm} \times 12 \mathrm{~L}}{0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}=0.49 \mathrm{~mol}\)
Після змішування:\(V\) =5 л,\(T\) =25 о С+273 = 298 К,\(n_{He}\) =1,9 моль,\(n_{O_{2}}\) =0,49 моль,\(R=0.08206 \frac{L-\mathrm{atm}}{\mathrm{mol}-K}\).
Потрібно:\(P_{He }\) =? ,\(P_{O_{2}}\) =? , а\(P_{\text {total }}\) =?
Формула:\(P_{H e}=\frac{n_{H e} R T}{V}\) =\(\frac{1.9 \mathrm{~mol} \times 0.08206 \frac{L-a t m}{\mathrm{~mol}-K} \times 298 \mathrm{~K}}{5.0 \mathrm{~L}}=9.3 \mathrm{~atm}\),\(P_{O_{2}}=\frac{n_{\text {oxygen } R T}}{V}\) =\(\frac{0.49 \mathrm{~mol} \times 0.08206 \frac{\mathrm{L}-\mathrm{atm}}{\mathrm{mol}-K} \times 298 \mathrm{~K}}{5.0 \mathrm{~L}}=2.4 \mathrm{~atm}\),
\[P_{\text {total }}=P_{He }+P_{O_{2}}=9.3 \mathrm{~atm}+2.4 \mathrm{~atm}=11.5 \mathrm{~atm.}\nonumber\]
Гіпербарична камера являє собою повітряну камеру, яка знаходиться під двома-трьома атмосферними тиском, як показано на рис.7.8.3. Розчинність газів збільшується зі збільшенням тиску. Пацієнт, поміщений в гіпербаричну камеру, має більш високу концентрацію кисню, розчиненого в крові, оскільки парціальний тиск кисню в два-три рази вище, ніж в атмосферному повітрі. Більш висока концентрація кисню токсична для багатьох штамів бактерій. Тому гіпербаричні камери використовуються для лікування опікових пацієнтів, в операціях та для лікування деяких видів раку.
Гіпербаричні камери також використовуються для лікування отруєння чадним газом (СО), оскільки більша концентрація кисню в камері може витіснити СО, пов'язаний з гемоглобіном, швидше, ніж атмосферний кисень. Іншим використанням гіпербаричних камер є лікування аквалангістів, які страждають від вигинів. Якщо дайвер піднімається занадто швидко, азот, розчинений у крові, утворює бульбашки в судині, які блокують кровотік - стан, який називається вигинами. Водолази, які страждають від вигинів, поміщаються в гіпербаричну камеру під високим тиском, а потім тиск повільно знижується до атмосферного. Азот розчиняється в крові під більш високим тиском і повільно дифундує через легені, оскільки тиск поступово знижується.

