6.6: рН
- Page ID
- 25527
Що таке рН?
Кислотність водного розчину відноситься до концентрації іонів Н 3 О +, але з нею є дві проблеми. Перша проблема полягає в тому, що молярна концентрація іона гідронію [H 3 O +] змінюється в широкому діапазоні, як правило, від 1-до 0.0000000000000001, що нелегко зрозуміти. Шкала журналу вирішує проблему, наприклад, якщо число збільшується з 1 до 1000, воно збільшується від 0 до 3 за шкалою журналу до основи 10. Друга проблема полягає в тому, що [H 3 O +] зазвичай є невеликим числом від 0 до 1. Журнал числа, що знаходиться між 0 і 1, є від'ємним числом, яке нелегко зрозуміти подумки. Якщо число знаходиться в межах від 0 до 1, його зворотне більше 1, а його журнал - число +ve.
РН визначається як журнал зворотної молярної концентрації іонів гідронію [H 3 O +]. Також можна констатувати, що рН є негативним журналом молярної концентрації іона гідронію [H 3 O +]. Математична форма рН наступна.
\ begin {рівняння}
p =\ log\ frac {1} {\ left [\ mathrm {H} _ {3}\ mathrm {O} ^ {+}\ праворуч]} =-\ log\ left [\ mathrm {H} _ {3}\ mathrm {O} ^ {+}\ праворуч]\ nonumber
\ end {рівняння}
РН зазвичай є позитивним числом від 0 до 14.
Розрахунок рН
Спочатку визначають молярну концентрацію іона гідронію [H 3 O +]. Чим взяти журнал бази 10 з [H 3 O +] і змінити знак відповіді, тобто:
\ begin {рівняння}
p H=-\ log\ left [\ mathrm {H} _ {3}\ mathrm {O} ^ {+}\ праворуч]\ nonumber
\ end {рівняння}
Обчисліть рН нейтральної води, яка має [H 3 O +] = 10 -7 М?
Рішення
З огляду на [H 3 O +] = 10 -7 М, бажаний рН =?
Формула:\(p H=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\)
Підключіть значення та розрахуйте:\(p H=-\log \left(10^{-7}\right)=7.0\)
Послідовність клавіш для обчислення на науковому калькуляторі Microsoft Window (останнє поле - це висновок послідовності ключів):

Задане число в науковому позначенні становить 1 х 10 -7, що має одну значну цифру, показану коефіцієнтом частини числа жирним шрифтом. Число знаків після коми в числі рН показує значущі цифри, т. Е. 0 має один десятковий знак, показаний жирним шрифтом, що означає, що він має одну значну цифру.
Розрахувати рН розчину 0,010 М HCl?
Рішення
З огляду на [HCl] = 0,010 М = [H 3 O +], бажаний рН =?
Формула:\(p H=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\)
Підключіть значення та розрахуйте:\(p H=-\log (0.010)=2.00\)
Послідовність клавіш для обчислення на науковому калькуляторі Microsoft Window (останнє поле - це висновок послідовності ключів):

Зауважте, що дане число 0.0 10 M має дві значні цифри, показані жирним шрифтом. Отже, відповідь pH 2. 00 також має дві значні цифри, показані жирним шрифтом.
Розрахувати рН 0,10 М розчину HCl?
Рішення
З огляду на [HCl] = 0,10 М = [H 3 O +], бажаний рН =?
Формула:\(p H=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\)
Розрахунки:\(p H=-\log (0.10)=1.00\)
Оскільки кислоти 0.01M і 0.10M поступово додають для збільшення кислоти з нейтральної води в прикладі 1 до 0,01 М в прикладі 2 до 0,10 М в прикладі 3, рН поступово зменшувався з 7 до 2 до 1.
Показник рН кислого розчину менше 7. Чим кислотніше розчин, тим нижче рН.
РН зменшується зі збільшенням [H3O+], оскільки зворотний показник [H3O +] використовується при розрахунку рН. Чим більше дане число, тим менше зворотне; це перекладається як «чим кислотніше розчин, тим нижче рН.
Розрахувати рН 0,010 М розчину NaOH?
Рішення
З огляду на [NaOH] = 0,010 М = [ОН -], бажаний рН =?
Спочатку обчисліть [Н 3 О +] з даного [ОН -]:\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=10^{-14} /\left[\mathrm{OH}^{-}\right]=10^{-14} / 0.010=1.0 \times 10^{-12}\)
Чим розрахувати рН:\(p H=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=-\log \left(1.0 \times 10^{-12}\right)=12.00\)
Зауважте, що дане число 0.0 10 M має дві значні цифри, показані жирним шрифтом. Отже, відповідь pH 12. 00 також має дві значні цифри, показані жирним шрифтом.
Розрахувати рН 0,10 М розчину NaOH?
Рішення
З огляду на [NaOH] = 0,10 М = [ОН -], бажаний рН =?
Спочатку обчисліть [Н 3 О +] з даного [ОН -]:\(10^{-14} /\left[\mathrm{OH}^{-}\right]=10^{-14} / 0.10=1.0 \times 10^{-13}\)
Формула: [Н 3 О +] = 10 -14/[ОН -] = 10 -14 /0,10 = 1,0 х 10 -13.
Чим розрахувати рН:\(p H=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=-\log \left(1.0 \times 10^{-13}\right)=13.00\)
В якості основи 0.010M і 0.10M поступово додаються в попередніх двох іспитах до нейтральної води при рН 7, рН збільшується з 7 до 12 до 13.
Показник рН основного розчину більше 7. Чим основніше розчин, тим вище рН.
Вимірювання рН
РН зазвичай вимірюється в лабораторіях цифровими рН-метрами. Електрод рН-метра спочатку калібрують розчинами відомих значень рН, а потім електрод занурюють у досліджуваний розчин, щоб прочитати його значення рН. Доступні універсальні папери з індикатором рН, які перетворюються на певний колір при розміщенні в розчині. Показник рН зчитується шляхом зіставлення кольору тестового паперу з кольором на графіку. На рис. 6.6.1 показаний цифровий рН-метр і два універсальних pH, що вказують документи, які зазвичай використовуються для вимірювання рН в лабораторіях.



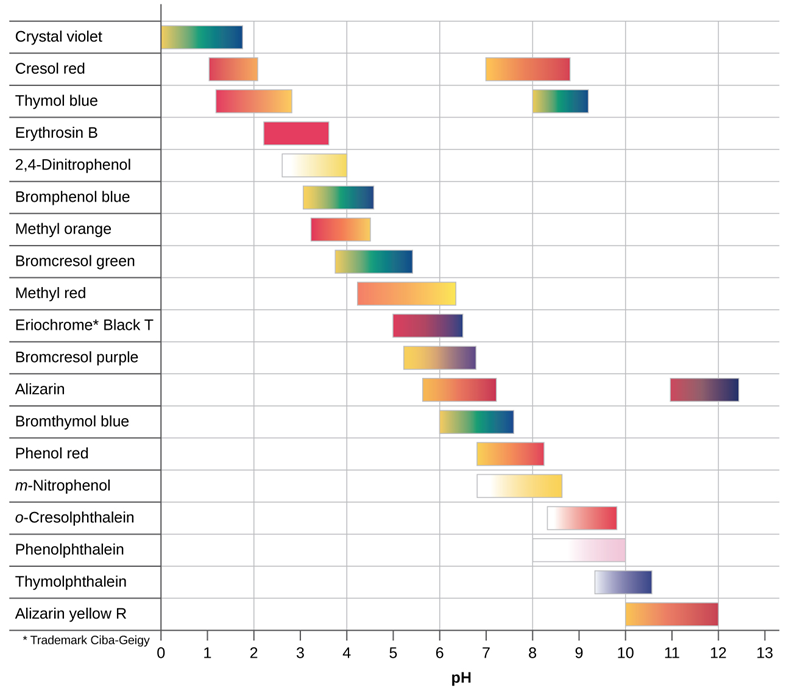
Показники рН - це слабкі кислоти або слабкі підстави, які змінюють колір в певному діапазоні рН. Кілька крапель розчину індикаторного паперу pH додають в досліджуваний розчин, в якому pH змінюють шляхом додавання кислоти або основи. Зміна кольору розчину вказує на діапазон рН, в якому індикатор змінює колір. На малюнку 6.6.2 показані кольори та діапазони переходу кольорів деяких загальних показників рН.
Розрахунок концентрації іонів гідронію від рН
Формулу розрахунку молярної концентрації іонів гідронію [H 3 O +] отримують шляхом перестановки формули рН. \(p H=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\), Перевлаштовує на:\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\operatorname{antilog}(-p H)=10^{-p H}\).
Обчисліть [H 3 O +] зразка сечі, який має рН 7,56?
Рішення
Дано: рН = 7,56, Бажано: [H 3 O +] =?
Формула:\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=10^{-p H}\).
Підключіть значення і розрахуйте:\(\left[H_{3} O^{+}\right]=10^{-p H}=10^{-(7.56)}=2.8 \times 10^{-8} M\)
Послідовність клавіш для обчислення на науковому калькуляторі Microsoft Window (останнє поле - це висновок послідовності ключів):

Розрахункова відповідь у наведеному вище прикладі являє собою довге число, але воно округляється до двох значущих цифр, показаних жирним шрифтом в 2.8\(\times 10^{-8} M\), тому що дане число pH 7. 56 має дві значні цифри, показані жирним шрифтом.
Значення шкали рН
Шкала рН варіюється від ~0 до ~14. РН 7 нейтральний, рН більше 7 - основний, а рН менше 7 - кислий, як показано на рис. 6.6.3. Різні продукти харчування мають різні значення рН, як показано на рис.6.1.1. Аналогічно, кілька кислот і основ в побутовому використанні мають специфічний діапазон рН, як показано на рис. 6.6.3.
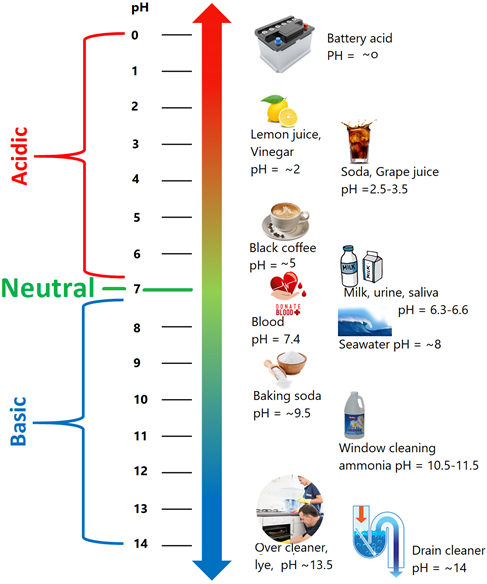
Контроль рН має важливе значення для правильного функціонування біологічних систем. Рослини процвітають, якщо грунт не має занадто кислого або занадто основного рН. Недоліки та реверси мають певний діапазон рН, в якому водні мешканці можуть вижити. Природна вода США має рН в діапазоні від 6,5 до 8,5. Морська вода має специфічний вузький діапазон рН 7,5 до рН 8,4, в якому життя в морі може функціонувати правильно.
РН рідин організму
Рідини організму людини змінюються по рН, як показано на рис. 6.6.4. Слина в роті слабо кисла, але шлунок має найнижчий рН в організмі. Сильно кислий рН у шлунку допомагає перетравлювати деякі продукти, а також допомагає вбивати бактерії, які можуть потрапляти в шлунок через продукти. Коли їжа потрапляє в товсту кишку, рН змінюється на основний, що допомагає перетравлювати продукти, які не могли бути перетравлені в кислому середовищі шлунка. РН змінюється на більш основний в тонкому кишечнику.
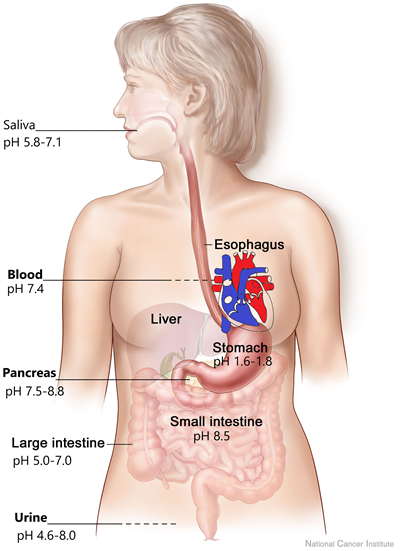
Кров має рН 7,4, і він може варіюватися в невеликому діапазоні від 7,35 до 7,45. Якщо рН крові виходить за межі діапазону від 7,35 до 7,45, це може призвести до медичних проблем. Ферменти в організмі потребують певного діапазону рН, оскільки водневий зв'язок відіграє життєво важливу роль у структурах, необхідних для правильного функціонування. Зміни рН впливають на водневий зв'язок і можуть зробити ферменти менш активними або можуть інактивувати їх. РН крові підтримується комплексною дією буферів, які описані в більш пізніх розділах. РН сечі може варіюватися в широкому діапазоні від 4,6 до 8, залежно від недавньої дієти і вправ.
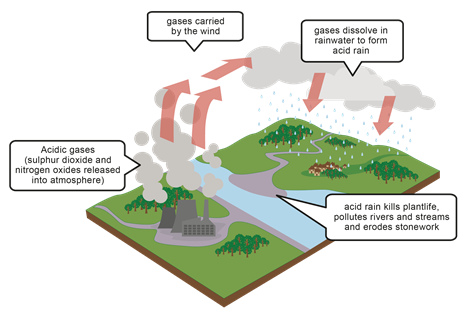
Кислотний дощ
Кислі гази, такі як NO, NO 2, N 2 O 4, SO 2, виділяються в навколишнє середовище переважно під час спалювання викопного палива. Ці гази розчиняються в дощовій воді і роблять дощ кислим. Наприклад, діоксид сірки розчиняється у воді і робить сірчану кислоту:
\[\mathrm{SO}_{2}(\mathrm{~g})+\mathrm{H}_{2} \mathrm{O}(\mathrm{I}) \rightleftarrows \mathrm{H}_{2} \mathrm{SO}_{3}(\mathrm{aq})\nonumber\]
Кислотний дощ завдає шкоди навколишньому середовищу, роблячи грунт, річкову воду та брак води кислими. Кислий грунт і вода, в свою чергу, впливають на рослини і водне життя. Кисла вода також вступає в реакцію з карбонатом кальцію і роз'їдає метали, які відповідають за пошкодження скульптури та інших конструкцій, як показано на рис. 6.6.5, рис. 6.6.6, і рис.6.7.