6.3: Міцність кислот і підстав
- Page ID
- 25547
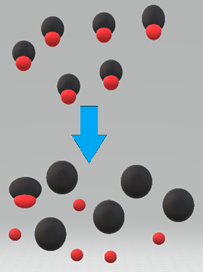
Сила кислоти ГК - це ступінь дисоціації кислоти на Н + і А - іони, як показано на рис. 6.3.1.
Сильні кислоти
Сильні кислоти, як HCl, майже 100% дисоціюють на іони, коли вони розчиняються у воді.
\ begin {рівняння}
\ математика {HCl} (\ mathrm {g}) +\ математика {H} _ {2}\ математика {O} (\ mathrm {l})\ стрілка вправо\ математика {H} _ {3}\ mathrm {O} ^ {+} (\ mathrm {q}) +\ mathrm {Cl} {-} (\ mathrm {aq})\ числове число\ кінець {рівняння}
Одна стрілка використовується для позначення того, що реакція майже на 100% завершена.
Сильні кислоти включають HClO 4, H 2 SO 4, HI, HBr, HCl та HNO 3
слабкі кислоти
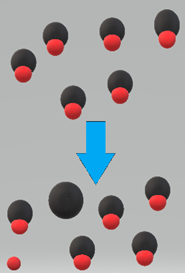
Слабкі кислоти розчиняються у воді, але частково дисоціюються на іони.
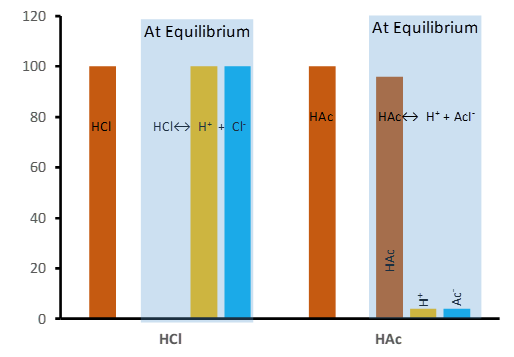
Наприклад, оцтова кислота (СН 3 СООН) - слабка кислота, 1 М оцтова кислота розчиняється у воді, але тільки 0,4% розчинених молекул дисоціюють на іони, решта 99,6% залишаються нероз'єднаними, як показано на рис. 6.3.2. і рівняння дисоціаційної рівноваги нижче.
\ begin {рівняння}
\ математика {CH} _ {3}\ математика {COOH} (\ математика {aq}) +\ математика {H} _ {2}\ mathrm {O} (\ mathrm {I})\ stackerl {\ rightarrow} {\ longleftarrow}\ mathrm {O} ^ {+} (\ математика {aq}) +\ математика {CH} _ {3}\ математика {COO} ^ {-} (\ математика {aq})\ числове число
\ кінець {рівняння}
Дві стрілки, що вказують в протилежні сторони, використовуються для дисоціації слабких кислот, щоб вказати на те, що реакція є рівновагою, т. Е.
Часто стрілки не рівні за розміром -довша стрілка вказує на кислотно-лужну пару, яка слабша і присутня в більшій концентрації при рівновазі, ніж їх сполучена пара.
Міцні підстави
Сильні основи майже 100% дисоціюють на іони при розчиненні у воді. Наприклад, NaOH є сильною основою, і вона дисоціює майже 100% на іони у воді.
Сильні основи майже 100% дисоціюють на іони при розчиненні у воді. Наприклад, NaOH є сильною основою, і вона дисоціює майже 100% на іони у воді.
\ begin {рівняння}
\ математика {NaOH} (\ mathrm {s})\ stackrel {\ text {Вода}} {\ longrightarrow}\ mathrm {Na} ^ {Na} ^ {aq})\ nonumber
\ кінець {рівняння}
Одна стрілка використовується для розчинення сильних підстав, щоб вказати на те, що реакція майже завершена.
До сильних основ відносяться гідроксиди лужних металів, тобто LiOH, NaOH, KOH, RBoH, CSOH, і гідроксиди важких лужноземельних металів, тобто Ca (OH) 2, Sr (OH) 2 і Ba (OH) 2.
Останні три, тобто гідроксиди важких лужноземельних металів, мають низьку розчинність у воді, але розчинена фракція існує у вигляді іонів.
слабкі підстави
Слабкі підстави частково дисоціюються на іони при розчиненні у воді.
Наприклад, аміак є слабкою основою - лише 0,42% розчинених молекул аміаку дисоціюють на іони амонію та гідроксидні іони у воді з 1 М розчину аміаку.
\ begin {рівняння}
\ математика {NH} _ {3} (\ mathrm {aq}) +\ математика {H} _ {2}\ математика {O} (\ mathrm {I})\ stackerl {\ стрілка вправо} {\ longleftarrow}\ математика {NH} _ {4} {} ^ {+} (\ mathrm {q}) +\ математика {OH} ^ {-} (\ mathrm {aq})\ номер
\ кінець {рівняння}
Слабкі основи в побутовому використанні включають аміак (NH 3) в очищувачі вікон, NaClO в відбілювачі, Na 2 CO 3 і Na 3 PO 4 в пральному порошку, NaHCO 3 в зубному минулому, Na 2 CO 3 в розпушувачі, CaCO 3 для використання на газоні, Mg (OH) 2 і Al (OH) 3 в антацидах і проносних.
Згадані вище слабкі підстави - це все іонні сполуки, крім аміаку. Іонні сполуки є сильними електролітами, тобто вони дисоціюються на іони майже 100% при розчиненні у воді. Здається, суперечить тому, що ці іонні сполуки є слабкими підставами. Це насправді не суперечить, тому що базові властивості не відносяться до цих іонних сполук, базові властивості відносяться до реакцій їх багатоатомних аніонів, тобто ClO -, CO 3 2 -, а PO 4 3 - з водою, як показані в реакціях нижче:
\ begin {рівняння}
\ почати {вирівняний}
&\ mathrm {ClO} ^ {-} +\ математика {H} _ {2}\ математика {O}\ stackerl {\ стрілка вправо} {\ longleftarrow}\ mathrm {HCo} +\ mathrm {ON} ^ {-}\\
&\ mathrm {CO} _ {3} ^ {2-} +2\ математика {H} _ {2}\ mathrm {O}\ stackerl {\ стрілка вправо} {\ довга ліва стрілка}\ mathrm {H} _ {2}\ mathrm { CO} _ {3} +2\ mathrm {OH} ^ {-}\ текст {, і}\\
&\ mathrm {PO} _ {4} {3-} +3\ mathrm {H} _ {2}\ mathrm {O}\ stackerl {\ праворуч} {\ longleftarrow}\ mathrm {H} _ {3}\ маркер thrm {PO} _ {4} +3\ mathrm {OH} ^ {-}
\ кінець {вирівняний}\ номер
\ кінець {рівняння}
Перераховані вище реакції - це реакції рівноваги, які є більш сприятливими в реверсах, ніж у прямому напрямку, виробляючи невелику кількість OH - іонів порівняно з аніоном на боках реагентів. Останні два приклади, тобто Mg (OH) 2 і Al (OH) 2 класифікуються як слабкі основи, оскільки вони вважаються нерозчинними у воді. Розчинність Mg (OH) 2 становить 0,00064 г/100 мл (25° C), а розчинність Al (OH) 3 становить 0,0001 г/100 мл, які знаходяться в діапазоні нерозчинних іонних сполук.
Розчинність і міцність кислот і підстав - це дві різні речі. Міцна основа може бути менш розчинною, а слабка основа може бути більш розчинною або навпаки, але розчинена сильна основа існує тільки як іони, а розчинена слабка основа існує як у вигляді молекул, так і іонів.
Відносна сила кислотно-кон'югатної пари основи
Загальне правило полягає в тому, що чим сильніше кислота, тим слабкіше сполучена основа, і навпаки.
Кон'югатні основи сильних кислот мають незначну міцність основи, а кон'югатні кислоти сильних басів мають незначну кислотну міцність. Рис. 6.3.3. ілюструє відносні сили деяких кислот і їх кон'югованих підстав.
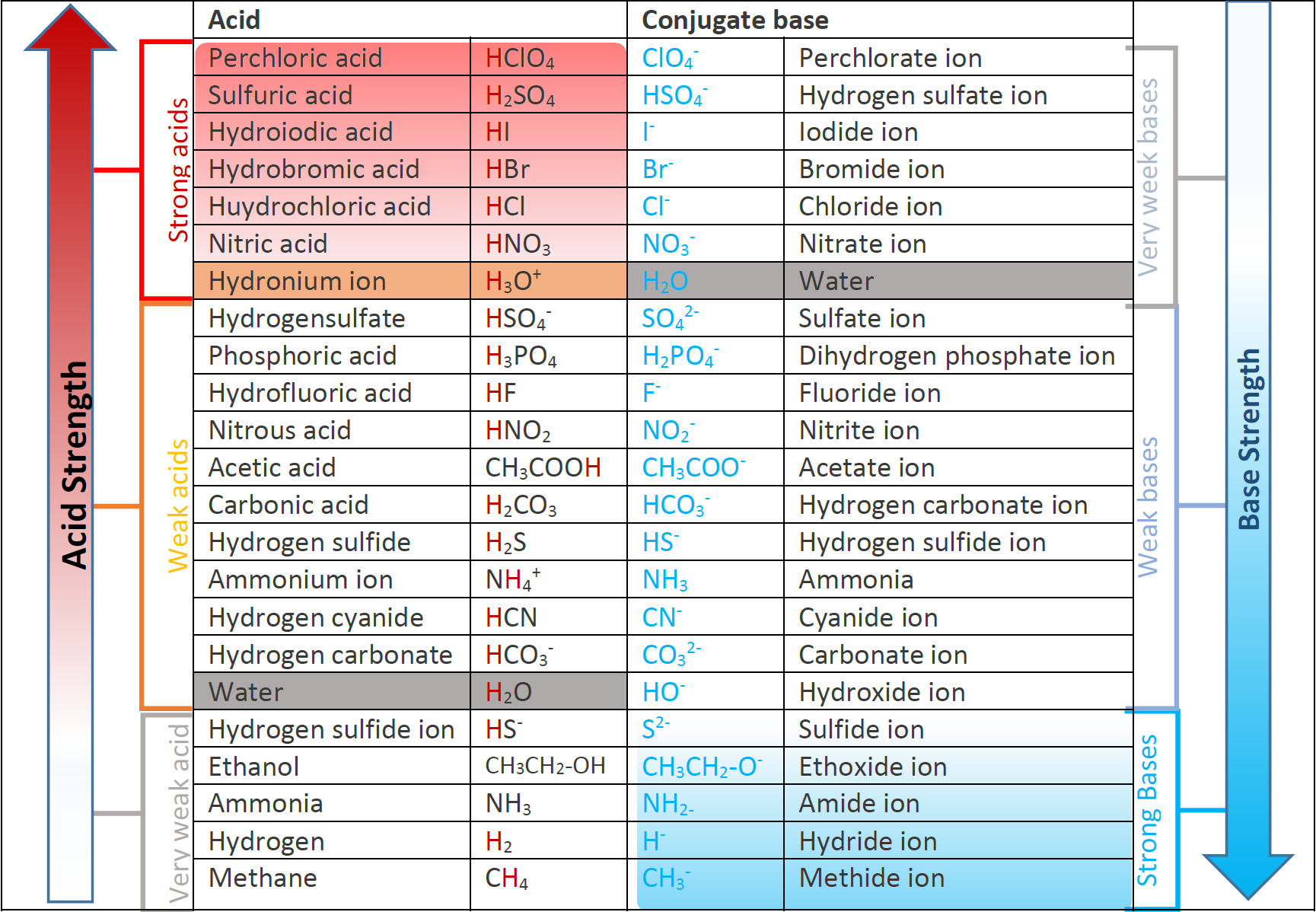
У будь-якій кислотно-лужній реакції Бронстеда - Лоурі загальне правило полягає в тому, що сильніша кислота і сильніша основа, як правило, утворюють слабшу кислоту і слабшу основу.
Наприклад, реакція дисоціації між HCl і H 2 O майже на 100% повна, оскільки HCl є сильнішою кислотою, ніж H 3 O +, а H 2 O є сильнішою основою, ніж Cl -:
\ begin {рівняння}
\ математика {HCl} +\ математика {H} _ {2}\ математика {O}\ стрілка вправо\ математика {H} _ {3}\ mathrm {O} ^ {+} +\ mathrm {Cl} ^ {-}\ nonumber
\ кінець {рівняння}
Розчинення оцтової кислоти (СН 3 СООН) та аміаку (NH 3) є реакціями рівноваги, оскільки всі кислоти, основи та їх кон'югати знаходяться в категорії слабких кислот або слабких підстав. Однак оцтова кислота і вода переважають над їх кон'югатами Н 3 О + і СН 3 СОО - на 99. 6:0 ,4 співвідношення (в 1 М розчину оцтової кислоти), оскільки кон'югатна кислота Н 3 О + є більш сильною кислотою, ніж СН 3 СООН, і сполучена основа СН 3 СОО - є більш міцною основою, ніж Н 2 О.
\ begin {рівняння}
\ математика {CH} _ {3}\ математика {COOH} (\ математика {aq}) +\ математика {H} _ {2}\ mathrm {O} (\ mathrm {l})\ stackerl {\ rightarrow} {\ longleftarrow}\ mathrm {O} ^ {+} (\ математика {aq}) +\ математика {CH} _ {3}\ математика {COO} ^ {-} (\ математика {aq})\ числове число
\ кінець {рівняння}
Довша стрілка, в неврівноважених стрілках рівноваги, вказує на кислотно-лужну пару в реакції, яка існує в більш високій концентрації щодо їх кон'югатів.
Аналогічно аміак (NH 3) і вода (H 2 O) домінують над їх кон'югатами NH 4 + і OH - по ~ 99. 6:0 ,4 співвідношення (1М розчин аміаку), оскільки кон'югатна кислота NH 4 + є сильнішою кислотою, ніж H 2 O і сполучена основа OH - є більш міцною основою, ніж NH 3.
\ begin {рівняння}
\ ліворуч. \ mathrm {NH} _ {3} (\ mathrm {q}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I})\ праворуч)\ stackrel {\ стрілка вправо} {\ longleftarrow}\ mathrm {H} _ {4} ^ {+} (\ mathrm {q}) +\ математика {OH} ^ {-} (\ mathrm {aq})\ числове число
\ кінець {рівняння}
