6.2: Бронстед-низькі кислоти і основи
- Page ID
- 25537
Деякі основи не мають в своїй формулі гідроксидних іонів, але вони діють як основи і нейтралізують кислоти. Наприклад, аміак (NH 3) і карбонат кальцію (CaCo 3) не містять гідроксид-іонів, але нейтралізують кислоти. Далі визначення Арренія обмежує кислотно-лужні реакції у водному середовищі. Кислотно-лужні реакції можуть відбуватися і в інших середовищах, наприклад, HCl - кислота, а NH 3 - основа може реагувати і нейтралізувати один з одним у газовій фазі. Brønsted-Lowry межує з визначенням кислот і підстав, включивши згадані вище основи, а також шляхом включення кислотно-лужних реакцій у неводному середовищі.
Визначення кислот і підстав Бронстеда - Лоурі
Визначення Бронстеда - Лоурі стверджує, що:
- Кислота є донором протонів, і
- Основа - це протонний акцептор.
Наприклад, HCl - це кислота, оскільки вона дарує протон водному розчиннику.
\[\mathrm{HCl}(\mathrm{g})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{Cl}^{-}(\mathrm{aq})+\mathrm{H}_{3} \mathrm{O}^{+}(\mathrm{aq})\nonumber\]
Вода є основою у вищезгаданій реакції, оскільки вона приймає протон з кислоти. У реакції між HCl і NH 3:
\[\mathrm{HCl}(\mathrm{g})+\mathrm{NH}_{3}(\mathrm{~g}) \rightarrow \mathrm{NH}_{4} \mathrm{Cl}(\mathrm{s})\nonumber\]
HCl - це кислота, оскільки вона дарує свій протон NH 3, а NH 3 є основою, оскільки приймає протон, як показано на рис. 6.2.1.

Кислоти Бронстеда-Лоурі мають іонізуючі протони, які вони жертвують основам. Тому кислота Бронстеда-Лоурі, як правило, пишеться як HA, де H + - це донорський протон, а А - аніон кислоти. Прикладами кислот є HCl, H 2 SO 4, HNO 3 та CH 3 COOH. Зверніть увагу, що оцтова кислота має лише один кислий протон, який приєднується до атома О в групі карбонових кислот (—СООН). Решта протонів, прикріплених до атомів вуглецю, не є кислими. Всі органічні кислоти мають групу карбонових кислот (—СООН). Бронстед-Лоурі кислота може мати чистий+ve заряд, без заряду, або чистий -ve заряду на ньому. Наприклад, H 3 O +, HCl та HSO 4 - це всі кислоти, оскільки вони можуть пожертвувати протон на основу.
Моно-, ді- і трипронова кислоти
Кислоти, які мають лише один кислий протон, є моно- протонними, наприклад, H Cl, H NO 3, CH 3 COO H, є моно- протоновими кислотами, де кислотний протон показаний жирним шрифтом. Деякі кислоти мають два кислотних протони - вони є di- protic, наприклад, H 2 SO 4 і H 2 CO 3 є di- protic. Кислоти з трьома кислотними протонами трипротонні, наприклад, H 3 PO 3 є трипротоновою кислотою. Наприклад, фосфорна кислота (H 3 PO 4) може дисоціювати і здавати три протони, як показано в хімічних реакціях нижче:
\ begin {вирівняний}
&\ математика {H} _ {3}\ mathrm {PO} _ {4} +\ математика {H} _ {2}\ математика {O}\ матрм {H} _ {3}\ mathrm {O} ^ {+} +\ mathrm {H} _ {2}\ mathrm {P} _ {4} {} ^ {-}\\
&\ mathrm {H} _ {2}\ mathrm {P} _ {4} {-} +\ математика {H} _ {2}\ mathrm {O}\ правий лівий тарпуни\ математика {H} _ {3}\ mathrm {O} ^ {+ } +\ mathrm {HPO} _ {4} {} ^ {2-}\\
&\ mathrm {HPO} _ {4} {2-} +\ математика {H} _ {2}\ матрм {O}\ правий лівий гамарони {H} _ {3}\ mathrm {O} ^ {+} +\ mathrum m {PO} _ {4} {} ^ {3-}
\ кінець {вирівняний}
База приймає протон, роблячи з ним зв'язок. Зв'язок являє собою пару зв'язаних електронів. Оскільки протон є атомом водню без електрона, обидва електрони в зв'язку надходять від основи. База повинна мати на ньому самотню пару електронів. Основа зазвичай представлена як підкреслити на ньому самотню пару електронів, яка показана у вигляді пари точок. Наприклад, аміак, вода та гідроксид-іон (
підкреслити на ньому самотню пару електронів, яка показана у вигляді пари точок. Наприклад, аміак, вода та гідроксид-іон (
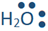 ,, і
,, і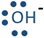 ) є основами Бронстеда - Лоурі, тому що кожен з них має атом з однією парою або самотніми парами електронів на них.
) є основами Бронстеда - Лоурі, тому що кожен з них має атом з однією парою або самотніми парами електронів на них.
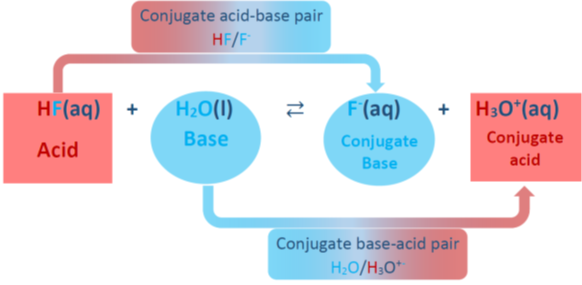
Сполучених кислотно-лужних пар
Описані вище кислотно-лужні реакції є односторонніми реакціями, тобто реагенти йдуть до продуктів майже 100%. Однак більшість кислотно-лужних реакцій є двома шляхами, тобто реагенти утворюють продукти і продукти реагують один з одним і повторно утворюють реагенти. Подвійні стрілки між реагентами і продуктами представляють собою два способи реакції. Наприклад, плавикова кислота (ВЧ) є слабким електролітом; вона частково дисоціює у воді з утворенням F - і H 3 O +, а продукти реагують на повторне утворення реагентів, як показано на рис.6.2.2. У зворотній реакції Н 3 О + виступає в якості кислоти, а F - виступає в якості основи. Кислота і основа в продуктах називаються кон'югатной кислотою і кон'югатної основою відповідно. Кислота HF стає кон'югатною основою F - після видалення протона, а основа Н 2 О стає кон'югатною кислотою Н 3 О + після прийому протона.
Кон'югатна кислотно-лужна пара пов'язана з втратою і посиленням Н +. Наприклад, ВЧ/Ф - це сполужена кислотно-лужна пара, а H 3 O + /H 2 O - також сполужена кислотно-лужна пара.
Іншими словами, видаліть кислий протон з кислоти, щоб отримати його кон'югатну основу, і додайте протон до основи, щоб отримати його кон'югатну кислоту.
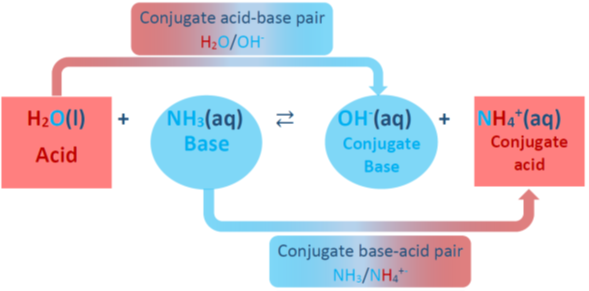
Іншим прикладом є аміак NH 3, який розчиняється у воді і приймає протон для утворення його кон'югатної кислоти NH 4 +, як показано на рис. 6.2.3. Вода Н 2 О діє як кислота, даруючи протон і утворюючи його кон'югатну основу ОН -. Дві спряжені кислотно-лужні пари в цій реакції - це NH 4 +/NH 3 та H 2 O/OH - які пов'язані втратами та посиленням або H +.
Визначити сполучені кислотно-лужні пари в наступній реакції?
\[\mathrm{H}_{3} \mathrm{PO}_{4}(\mathrm{aq})+\mathrm{NH}_{3}(\mathrm{aq}) \rightleftarrows \mathrm{H}_{2} \mathrm{PO}_{4}^{-}+\mathrm{NH}_{4}^{+}\nonumber\]
Рішення
- Визначте речовину, яка пожертвувала протон у реагентах - це кислота.
- Видаліть протон з кислоти, щоб сформувати його кон'югатну основу: H 3 PO 4 /H 2 PO 4 -.
- Визначте речовину, яка прийняла протон у реагентах - це основа.
- Додайте протон до основи, щоб сформувати його кон'югатну кислоту: NH 3/NH 4 +.
Зверніть увагу, що втрата протона з кислоти утворює його кон'юговану основу з зарядом зменшеним на одиницю, наприклад, H 3 PO 4 /H 2 PO 4 -, HSO 4 - /SO 4 2 - і NH 4 +/ NH 3. Аналогічно, посилення протона основою утворює його кон'югатну кислоту з зарядом, збільшеним на одиницю, наприклад, HPO 4 2 - /H 2 PO 4 -, HCO 3 - /H 2 CO 3, і NH 3 /NH 4 +.
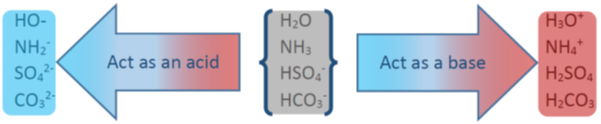
амфотерні речовини
Вода діє як основа в деяких реакціях, наприклад, з HF, і як кислота в деяких реакціях, наприклад, з NH 3.
Такі речовини, як вода, які можуть діяти як кислота, а також як основа, називаються амфотерними речовинами.
Інші приклади амфотерних речовин включають HSO 4 -, HCO 3 - і NH 3, як показано на рис. 6.2.4.