6.4: Кислотно-лужна рівновага
- Page ID
- 25528
Більшість кислотно-лужних реакцій є рівноважними реакціями, тобто реагенти утворюють продукти, а продукти реагують на повторне утворення реагентів. Реакція показана подвійними стрілками, щоб вказати на те, що і пряма, і зворотна реакції відбуваються одночасно.
Попередня рівновага і рівновага
Спочатку присутні тільки реагенти. Концентрація реагентів зменшується з часом, коли вони перетворюються на продукти. Швидкість реакції пропорційна концентрації реагентів. Так, швидкість прямої реакції з часом зменшується. Продукти накопичуються з часом. Продукти вступають в реакцію один з одним для повторного утворення реагентів, тобто зворотної реакції. Швидкість зворотної реакції збільшується з плином часу в міру збільшення концентрації продуктів, поки швидкість зворотної реакції не стане рівною швидкості прямої реакції, як показано на рис. 6.4.1
- На початку рівноваги, коли швидкість зворотної реакції повільніше швидкості прямої реакції, знаходиться передрівноважна фаза.
- Фази рівноваги починаються в тій точці, коли швидкість зворотної реакції стає рівною швидкості прямої реакції
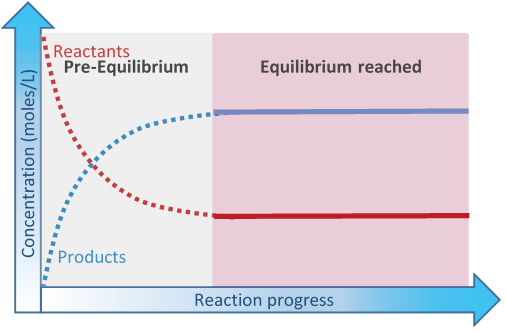
У точці, коли швидкість зворотної реакції стає рівною швидкості прямої реакції, досягла рівноваги. Концентрація реагентів і продуктів не змінюється при рівновазі, оскільки вони споживаються і повторно формуються з однаковою швидкістю — це динамічна рівновага.
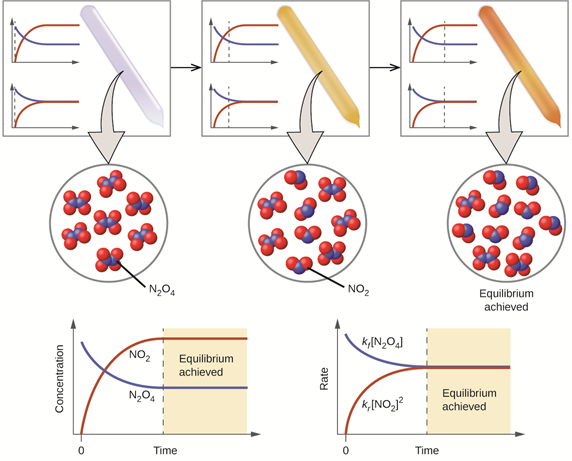
Реакції рівноваги не обмежуються кислотно-лужними реакціями; вони поширені у всіх типах хімічних реакцій. Рис. 6.4.2 ілюструє концентрації і швидкості змін реакцій в дорівноважних і рівноважних фазах за допомогою фактичної хімічної рівноважної реакції між реакцією розкладання безбарвного газу N 2 O 4 і його зворотною реакцією, т. Е. коричневий колір газу NO 2.
Що відбувається при порушенні хімічної рівноваги?
Концентрація реагентів і продуктів не змінюється в суміші, коли реакція знаходиться в рівновазі, оскільки швидкість прямої реакції дорівнює швидкості зворотної реакції. Будь-яка зміна, зроблена при рівновазі, додає напругу рівновазі. Система рухається таким чином, щоб зняти стрес. Наприклад, якщо в суміш додати один з реагентів, швидкість прямої реакції збільшується, видаляючи доданий реагент, поки не встановиться нова рівновага, тобто система знімає напругу шляхом видалення доданого реагенту.
При порушенні хімічної рівноваги швидкості прямих і зворотних реакцій змінюються, щоб зняти напругу і відновити рівновагу.
Напруженнями можуть бути зміни концентрації, тиску або температури, як пояснюється в наступному розділі.
Вплив концентрації на хімічну рівновагу
Нижче наведені наслідки зміни концентрації на хімічній реакції при рівновазі.
- Якщо додати реагент, реакція вперед збільшується для видалення реагенту.
- Якщо реагент видаляється, пряма реакція зменшується; отже, зворотна реакція додає реагент.
- Якщо додається продукт, то зворотна реакція посилюється на видалення продукту.
- Якщо продукт видаляється, зворотна реакція зменшується; отже, пряма реакція додає продукт.
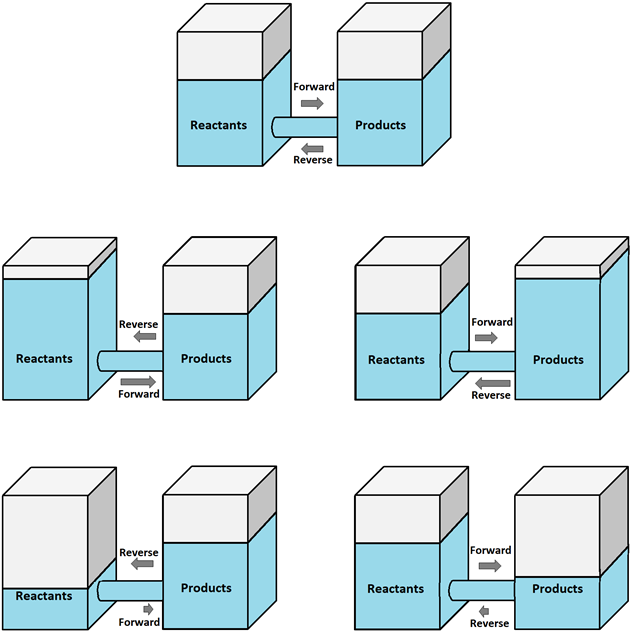
Рис. 6.4.3 ілюструє ефекти за допомогою рівня води в двох резервуарах, з'єднаних через трубопровід в лівому резервуарі, що представляє реагенти, і в правому резервуарі, що представляє продукти.
На рис. 6.4.4 демонструється вплив зміни концентрації на хімічну рівновагу між бурими іонами біхромату та іонами жовтого хромату:



\ begin {рівняння}
\ математика {Cr} _ {2}\ mathrm {O} _ {7} ^ {2-} (\ mathrm {aq},\ текст {коричневий}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I})\ правий лівий стрілки 2\ mathrm {CRo} _ {4} ^ {2-} (\ mathrm {aq}\ текст {, жовтий}) +2\ mathrm {H} ^ {+} (\ mathrm {aq})\ номер
\ кінець {рівняння}
Додавання кислоти в пробірку зліва збільшує Н + в системі, посилюючи зворотну реакцію, яку можна спостерігати по збільшенню коричневого кольору в середній пробірці. Потім додавання основи видаляє Н + з системи кислотно-лужною реакцією:\(\mathrm{H}^{+}+\mathrm{OH}^{-} \rightarrow \mathrm{H}_{2} \mathrm{O}\). Зниження Н + зміщує рівновагу в сторону продукту, що можна спостерігати за збільшеним жовтим кольором в пробірці справа.
Практичним прикладом впливу концентрації на хімічну рівновагу є зв'язування кисню (O 2) з гемоглобіном (Hb) в процесі дихання.
\ begin {рівняння}
\ математика {Hb} (\ mathrm {aq}) +\ mathrm {O} _ {2} (\ mathrm {~g})\ праволіві стрілки\ математика {bO} _ {2} (\ mathrm {aq})\ nonumber
\ end {рівняння}
Концентрація кисню вище в випадах, які зміщують рівновагу в сторону продукту, зв'язуючи більше кисню з гемоглобіном. Коли кров надходить в тканини, концентрація кисню в тканині нижча, змушуючи рівновагу зміщуватися в сторону реагенту, вивільняючи кисень.
Концентрація кисню зменшується зі збільшенням висоти. Гірські альпіністи можуть відчувати гіпоксію, тобто недостатнє надходження кисню в організм через те, що нижній рівень кисню на великій висоті може змістити рівновагу вправо, в результаті чого відбувається менша зв'язування кисню з гемоглобіном в легенях. Організм реагує виробленням більшої кількості гемоглобіну, але для того, щоб організм знову відрегулював рівень гемоглобіну в крові, потрібно близько 10 днів. У людей, що живуть на більших висотах, зазвичай підвищений рівень гемоглобіну в крові з причин, описаних вище.
Вплив тиску на хімічну рівновагу
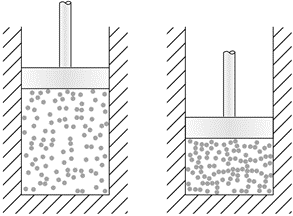
Зміни тиску не впливають на концентрацію твердих речовин і рідини. Однак при збільшенні тиску зменшується обсяг, а, отже, збільшується концентрація газів, як показано на рис.6.4.5.
Якщо хімічна рівновага включає гази, збільшення тиску має такий же ефект, як збільшення газоподібного реагенту або продукту - рівновага зміщується в напрямку, де менше молів газів.
Рис. 6.4.6 продемонстрував цей ефект для рівноваги між безбарвним газом N 2 O 4 та газом коричневого кольору NO 2:
\ begin {рівняння}
\ mathrm {N} _ {2}\ mathrm {O} _ {4} (\ mathrm {~g},\ текст {безбарвний})\ праволіві стрілки 2\ mathrm {NO} _ {2} (\ mathrm {~g},\ текст {коричневий})\ номер
\ кінець {рівняння}
Колір стає світлим у переході від шприца праворуч до шприца посередині. Його можна пояснити виходячи з того, що концентрація газів зменшувалася при збільшенні обсягу в результаті зниження тиску. Потім колір з часом стає темніше, як показано шприцом праворуч. Більш темний колір вказує на те, що рівновага змістилася в сторону продукту, де більше родимок газу, щоб зняти стрес.



Вплив температури на хімічну рівновагу
Екзотермічна реакція виділяє тепло, тобто тепло є одним з продуктів. Якщо пряма реакція екзотермічна, зворотна реакція повинна бути ендотермічної на ту ж величину і навпаки.
Коли оборотна реакція при рівновазі порушується підвищенням температури, рівновага зміщується в ендотермічному напрямку реакції на видалення тепла і навпаки.
У рівновазі між безбарвними N 2 O 4 і газами коричневого кольору NO 2 реакція ендотермічна в прямому напрямку:
\ begin {рівняння}
\ mathrm {N} _ {2}\ mathrm {O} _ {4} (g,\ текст {безбарвний}) +\ текст {тепло}\ праволіві стрілки 2\ mathrm {NO} _ {2} (g,\ текст {коричневий})\ nonumber
\ end {рівняння}
Підвищення температури зміщує рівновагу в ендотермічному напрямку для зняття напруги, як продемонстровано на рис.6.4.7.

