2.6: Періодичні тенденції властивостей елементів
Властивості елементів зазвичай показують періодичну тенденцію, яка корелює з їх положенням в періодичній таблиці. Властивості та їх періодичні тенденції описані нижче.
валентні електрони
Електрони у зовнішній оболонці - валентні електрони. На рис. 2.5.8 показані валентні електрони перших двадцяти елементів червоними шрифтами.
Всі елементи групи мають однакову кількість валентних електронів, що дорівнює першій цифрі їх групового числа. Наприклад, 1-а група водневих і лужних металів має один валентний електрон, 2-я група лужних металів - два валентних електрона, галогени 17-ї групи мають сім валентних електронів, а благородні гази 18-ї групи мають вісім валентних електронів.
Винятком із загальної тенденції валентних електронів, описаної вище, є перехідні метали в групах 3 - 12, і внутрішньо-перехідні метали, тобто лантаноїди і актиноїди -два ряди елементів, розміщених нижче таблиці Менделєєва. Валентні електронні конфігурації перехідних металів і внутрішньо-перехідних металів тут не описані; це виходить за рамки цієї книги.
Валентні електрони в основному визначають хімічні властивості елементів. Елементи в одній групі мають схожі хімічні властивості, оскільки мають однакову електронну конфігурацію валентної оболонки. Елементи поспіль демонструють поступову зміну хімічних властивостей, оскільки їх валентна оболонка електронна конфігурація поступово змінюється вздовж ряду.
символи Льюїса
- Символи Льюїса показують валентні електрони як точки навколо символу елемента. Одна точка являє собою один валентний електрон, наприклад,
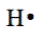 .
. - Крапки показані на будь-якій з чотирьох сторін символу.
- Одна точка зверху, знизу, зліва або справа показана чотирма валентними електронами. Потім починайте спарювання точок за межами чотирьох валентних електронів, як показано на рис. 2.6.1 для перших двадцяти елементів.
- Гелій - виняток, який має всього два валентних електрона, але вони показані парними.
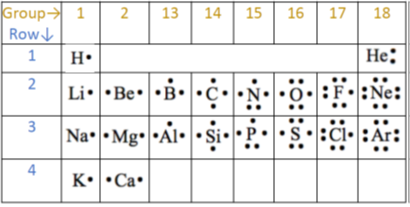
Електронні точки в структурі Льюїса - зручний спосіб визначити, скільки зв'язків може скласти атом елемента.
Як правило, кожна непарна точка може скласти один зв'язок.
Наприклад, атом водню з однією неочищеним крапкою може скласти один зв'язок, як у H-H. Зв'язок представлена лінією між зв'язаними атомами. Зв'язок утворюється шляхом спільного використання непарних валентних електронів. Його називають ковалентним зв'язком. Вуглець, азот, кисень та фтор з 4, 3, 2 та 1 непарною крапкою можуть утворювати зв'язок 4, 3, 2 та 1, наприклад, у наступних молекулах: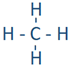
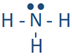 ,
,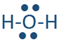 , і
, і .
.
- Кожна лінія в цих молекулах являє собою зв'язну електронну пару, і
- пара точок представляють валентні електрони, які не беруть участі в зв'язку, звані одинокою парою електронів.
Атомний розмір
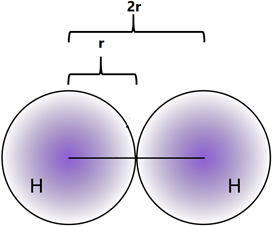
Електрони існують навколо ядра в хмарному вигляді без чітко визначених меж. Тому атомний розмір, як правило, відноситься до ковалентного радіуса атома, який становить половину відстані між ядрами, ковалентно зв'язаними в гомоядерній молекулі, як Cl 2, I 2, H 2, як показано на рис. 2.6.2.
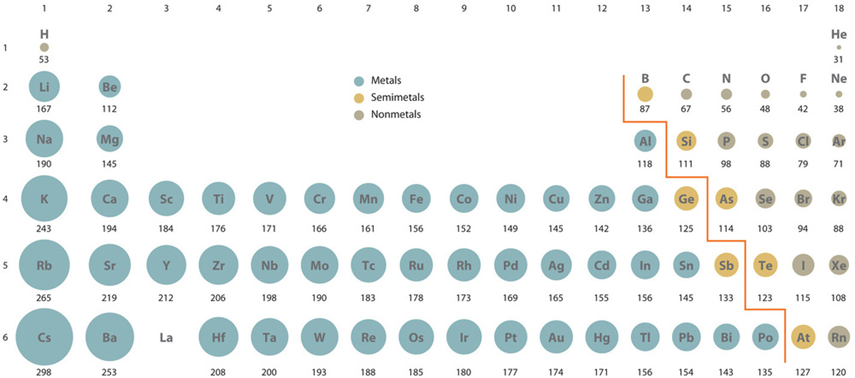
- Атомний розмір, як правило, збільшується зверху вниз в групі, оскільки валентні електрони додають у вищу оболонку в кожному послідовному члені групи вниз по стовпчику.
- Атомний розмір, як правило, зменшується зліва направо поспіль, оскільки валентні електрони знаходяться в одній оболонці, тоді як більше протонів додають до ядра, збільшуючи тягу валентних електронів, як показано на рис. 2.6.3.
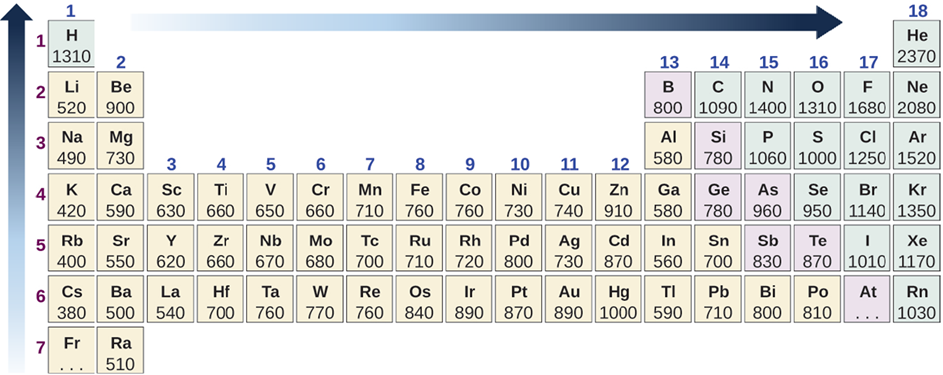
енергія іонізації
Позитивно заряджене ядро притягує негативно заряджені електрони. Тому видалення електрона з атома вимагає енергії. Іонізація виробляє катіон з меншою кількістю електронів, ніж вихідний нейтральний атом, тобто катіони.
Енергія іонізації - це енергія, необхідна для видалення електрона з нейтрального атома, як в наступній реакції.
Na+ ionization energy →Na1++e−
- Енергія іонізації, як правило, зменшується зверху вниз у стовпці, оскільки валентні електрони знаходяться далі і відчувають меншу тягу до ядра вниз по колоні.
- Енергія іонізації, як правило, збільшується зліва направо поспіль, оскільки валентні електрони знаходяться в одній оболонці, тоді як більше протонів додають до ядра, що збільшує тягу валентних електронів.
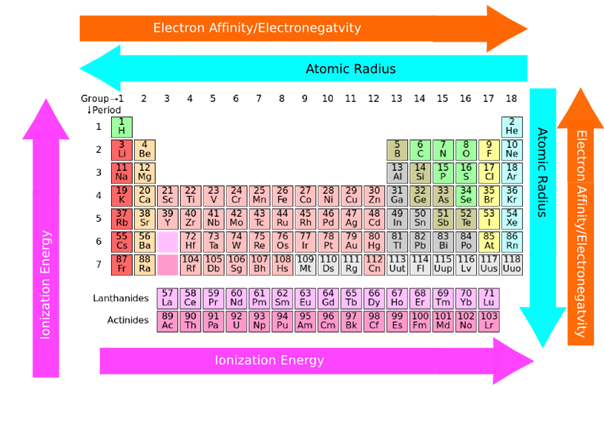
Рис. 2.6.4 ілюструє періодичну тенденцію в енергії іонізації.
Електронегативність
Електронегативність - це здатність атома в з'єднанні притягувати зв'язкову електронну пару до себе. Електропозитивність - протилежність електронегативності. Електронегативність - це властивість атома в з'єднанні, тобто зв'язаного атома, а не особливість окремого атома.
Існує кілька шкал електронегативності. Найбільш часто використовується шкала електронегативності Паулінга. На рис. 2.6.5 показані значення електронегативності за шкалою електронегативності Паулінга.
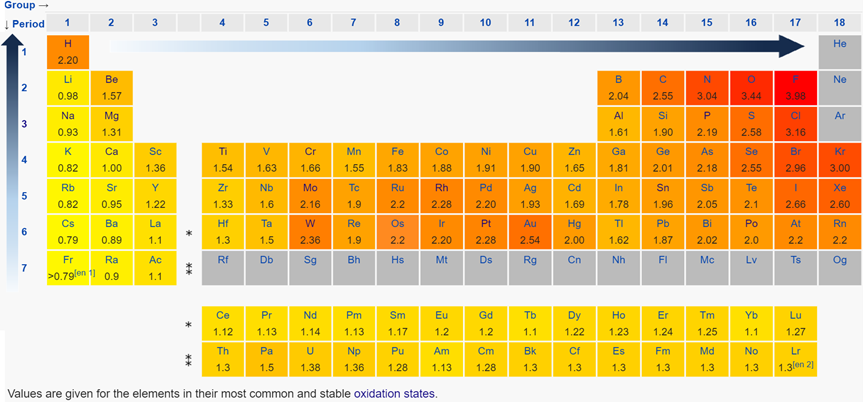
- Електронегативність, як правило, зменшується зверху вниз у стовпці, оскільки атомний розмір збільшується вниз по колоні, що робить ядро менш ефективним у витягуванні зв'язкових електронів.
- Електронегатив, як правило, збільшується зліва направо поспіль, оскільки розмір атома зменшується зліва направо поспіль, роблячи ядро більш ефективним у витягуванні зв'язкової електронної пари до себе.
Металевий характер
Металевий характер відноситься до легкості втрати електрона в хімічній реакції. Тенденція металевого характеру протилежна тенденції енергії іонізації.
- Металевий характер, як правило, збільшується зверху вниз у стовпці, оскільки атомний розмір збільшується вниз по стовпчику, роблячи валентні електрони менш щільно утримуваними та легше видаляються.
- Металевий характер, як правило, зменшується зліва направо поспіль, оскільки атомний розмір зменшується зліва направо, що робить валентні електрони більш щільно утримуваними та важкими для видалення.
Короткий зміст періодичних тенденцій
Енергія іонізації та електронегативність, як правило, збільшуються зліва направо поспіль і знизу вгору в стовпці. Атомний розмір і металевий характер протилежні, тобто вони збільшуються справа наліво поспіль і зверху вниз в стовпці. На рис. 2.6.6 підсумовується періодична тенденція у властивостях елементів.